胆道癌(BTC)是一种异质性肿瘤。虽然部分患者可完全切除,但仍有三分之二的患者会出现疾病复发。术后辅助治疗可降低复发、转移的可能性。美国临床肿瘤学会(ASCO)指南对可切除 BTC 患者推荐辅助化疗方案,但对辅助化疗(CT)和辅助放化疗(CRT)的疗效并没有对比说明。一项发表在 European Journal of Medical Research 上面的研究对 SEER 数据库的数据进行倾向性评分匹配分析,对比了术后辅助 CRT 和 CT 对患者的影响[1]。【肿瘤资讯】整理如下,以飨读者。
研究介绍
胆道癌是⼀种异质性肿瘤 ,每个亚组在病因、分子特征、治疗选择、预后和自然史方面存在明显差异[2]。根治性切除是治愈 BTC 患者最有效的方法。然而,既往研究发现,即使完全切除,仍有约三分之二的患者可能出现疾病复发,其中 15%-59%可能出现局部复发[3,4]。
因此,近年来,⼈们努力探索可切除 BTC 患者术后辅助治疗的最佳策略[包括放疗(RT)、化疗和放化疗], 以降低复发和转移的可能性,从而提高生存率。但辅助治疗的临床益处存在争议。直至 2019 年,随机Ⅲ 期 BILCAP 试验表明,BTC 根治性切除术后卡培他滨辅助治疗可显著改善无复发生存期(RFS)和中位总生存期(OS)[5],被 ASCO 指南推荐为标准辅助治疗方案[6]。然而,由于缺乏随机试验和小型、单⼀机构研究的数据,导致对辅助CRT 没有达成共识。尽管ASCO 对BTC 切除患者的治疗建议包括单独CT 或联合RT[6], 但最有效的辅助策略仍需进⼀步探索。
本研究的目的是根据 SEER 数据库的数据,比较辅助 CRT 和 CT 对根治性切除 BTC 患者的影响。我们评估了 CRT 和 CT 对主要队列 OS 的影响。我们还利用单变量和多变量 Cox 模型来分析与 OS 相关的变量。倾向性评分匹配(PSM)用于最大限度地减少非随机选择偏差造成的协同效应。此外,我们还探讨了可能从辅助 CRT 中获益的患者亚组。
研究方法
纳入 SEER 数据库中 2004 年至 2015 年间诊断的可切除 BTC 患者,包括肝内胆管癌(IHBDC)、肝外胆管癌(EHBDC)和胆囊癌(GBCA)。本研究的主要终点是 OS。
研究结果
共有 922 例患者(446 例男性[48.4%]和 476 例女性[51.6%])符合入组标准,纳入研究。497 例患者(53.9%)接受了辅助 CRT,46.1%(n=425)接受了辅助 CT。419 例患者(45.4%)的原发肿瘤部位为胆囊,其次是肝外胆管(39.5%)和肝内胆管(15.1%)。根据 AJCC 分期,大多数患者处于 T2 期(35.8%)或T3 期(40.1%),并且患有 I 级(43.9%)和Ⅲ级(33.8%)疾病。许多患者无淋巴结转移(N0 疾病:n=598, 53.5%),肿瘤大小小于 5 厘米(64.9%)是最常见的。考虑到手术切除的淋巴结数量,404 例(43.8%)患者进行了根治性手术,其中超过 4 个淋巴结被切除。
生存分析
在整个队列中,与辅助 CT 相比,辅助 CRT 对 OS 没有有利的影响(27.0 个月 vs. 27.0 个月,p=0.142)。此外,在 IHBDC 和 EHBDC 队列中,我们观察到 OS 的类似趋势(53.0 个月 vs. 43.0 个月,p=0.274;25.0 个月 vs. 27.0 个月,p=0.511),CRT 和 CT 之间无显著差异。然而,在 GBCA 队列中,接受辅助 CRT 的患者的 OS 比单独接受辅助 CT 的患者的 OS 更长(26.0 个月 vs. CT 19.0 个月,p<0.001)。
单因素和多因素 Cox 分析
在单变量 Cox 模型中,几个临床特征与低生存相关:年龄≥60 岁,原发肿瘤部位在肝外胆管或胆囊,T3 或T4,N1 或 Nx,肿瘤大小≥5 厘米,Ⅱ级或Ⅲ级。此外,手术切除 1-3 和>4 个淋巴结改善了预后,HR 分别为 0.688(0.561-0.844,p<0.001)和 0.711(0.589-0.859,p<0.001)。考虑到 RT 的临床意义及其与生存的潜在关联,我们加入治疗建立多变量 Cox 模型(年龄、原发肿瘤部位、T 分期、N 分期、肿瘤大小、淋巴结切除数、分级、治疗)。分级与 OS 在多变量分析中无统计学差异,但其他变量均有统计学意义。此外, CRT 与更有利的预后(HR)显著相关 0.823 (0.704-0.963,p=0.019)。
倾向性匹配队列的生存分析、单因素和多因素 Cox 分析
针对 CRT 组和 CT 组之间基线特征不平衡可能影响统计效力的问题,我们采用 PSM 来控制混杂因素,建立一个平衡良好的队列。患者的年龄、原发肿瘤部位、T 分期、N 分期、肿瘤大小、淋巴结切除数、治疗方法等特征按 1:1 匹配。在整个队列中,与 CT 相比,PSM 后 CRT 显示出生存获益(28.0 个月 vs. 25.0 个月, p=0.033)(图 1a)。在 IHBDC 或 EHBDC 患者中,与 CT 相比,CRT 的 OS 无显著改善(53.0 个月 vs 44.0 个月,p=0.277;27.0 个月 vs. 27.0 个月,p=0.768)(图 1b,c)。然而,在 GBCA 组中,相比 CT,接受 CRT 的患者在统计学上获得了更大的益处(25.0 个月 vs. 19.0 个月,p=0.003)。
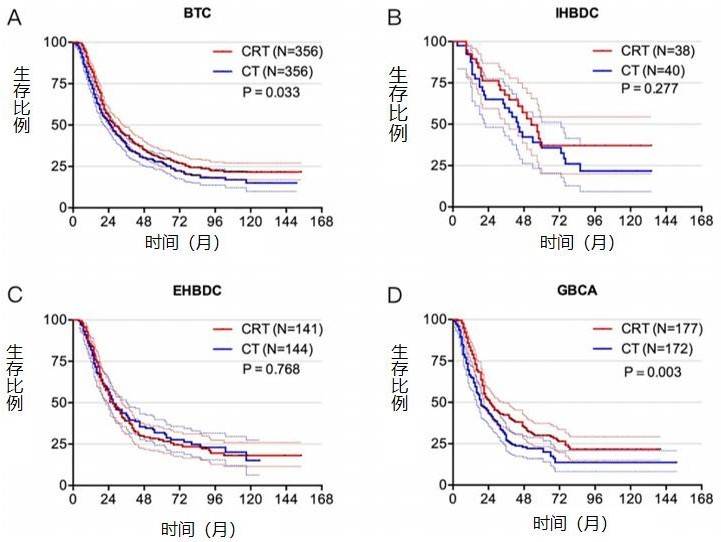
图 1 PSM 队列的 OS
a 整个队列(N=712)接受 CRT 和 CT 治疗患者的 OS;b IHBDC 队列(N=78)中接受 CRT 和 CT 治疗患者的 OS; c EHBDC 队列(N=285)中接受 CRT 和 CT 治疗患者的 OS;d GBCA 队列(N=349)中接受 CRT 和 CT 治疗患者的 OS
单变量和多变量的分析结果显示年龄≥60 岁、原发肿瘤部位在肝外胆管、胆囊、T3 或 T4、N1 或 Nx、肿瘤大小≥5 cm、II 级或 III 级与不良预后相关,而 CRT 和 1-3 或≥4 个手术切除淋巴结与预后改善相关。多变量 Cox 模型显示≥60 岁、T3 或 T4、N1 或 Nx 以及肿瘤大小≥5 cm 对 OS 有独立的不利影响, 而 CRT 和 1-3 或≥4 个手术切除淋巴结表明生存率更高。我们探讨了 CRT 对各种临床亚组的预后影响, 发现它与特定亚组的更好预后一致相关,包括 GBCA 患者(HR=0.698,95% CI:0.537–0.874, p=0.003)、年龄≥60(HR=0.781,95% CI:0.633–0.944,p=0.013)、女性(HR=0.737,95% CI: 0.572–0.926,p=0.011)、N1(HR=0.784,95% CI:0.605–0.996,p=0.050)、Nx(HR=0.234,95%CI:0.008-0.455,p=0.030)、肿瘤大小≥5cm(HR=0.735,95%CI:0.5500.957,p=0.025、无淋巴结切除(HR=0.572,95%CI:0.389-0.771,p=0.001)。
研究讨论
在我们的回顾性分析中,与辅助 CT 相比,CRT 预计可显着提高 BTC 患者(尤其是 GBCA)的生存,但对IHBDC 或 EHBDC 患者没有显着益处。此外,PSM 后,年龄≥60 岁、女性、淋巴结阳性、肿瘤大小≥ 5cm 且未切除淋巴结的特定患者亚群可以从辅助 CRT 中获益。
肝脏是 BTC 最常见的复发部位,其次是局部部位、腹膜和腹部淋巴结。GCBA 和 EHBDC 中局部侵袭、淋巴结转移和远处转移的发生率高,而 IHBDC 往往主要是肝内复发,这可能导致额外辅助放疗的获益有限。这解释了为什么在我们的报告中 CRT 明显改善了 GCBA 患者的预后,但对 IHBDC 或 EHBDC 患者没有显着的益处。根据我们的发现,最近根据 SEER GBCA 数据库构建的列线图模型表明,对于所有患者亚组, CRT 均优于 CT,预计那些 T2 或淋巴结阳性疾病的患者使用 CRT 更具生存优势。因此,对于手术切除后的特定患者亚群,应推荐辅助 CRT。
尽管如此,我们的研究仍然存在一些局限性。首先,作为数据库的回顾性研究,治疗和选择偏倚是不可避免的。因此,使用 PSM 分析来减少偏差。其次,SEER 缺乏疾病复发的信息;因此,我们选择 OS 作为主要终点。此外,SEER 数据库无法提供有关 CT 的详细信息,包括具体的 CT 方案、周期和放疗,包括放疗剂量、放疗靶区和放疗技术。此外,SEER 没有有关体能状态、治疗毒性和并发症的信息。但我们相信这些数据的多样性可能代表了现实世界中更为现实的生存状况。
研究结论
总之,我们的分析表明 BTC 患者,特别是 GBCA、年龄≥60 岁、女性、淋巴结阳性、肿瘤大小≥5 cm、未切除淋巴结的患者可能从辅助 CRT 中获得显著的益处。针对 IHBDC 和 EHBDC 患者,CRT 和 CT 组患者的生存率没有差异。有必要进行更大规模的前瞻性随机临床试验来研究辅助 CRT 对 BTC 的影响。
[1] Zhu YT, Liu X, Lin YY, et al. Adjuvant chemoradiotherapy vs. Chemotherapy for resectable biliary tract cancer: a propensity score matchin analysis based on the SEER database. European Journal of Medical Research, 2023;28:310.
[2] Rizzo A, Brandi G. Adjuvant systemic treatment in resected biliary tract cancer: State of the art, controversies, and future directions. Cancer Treat Res Commun. 2021;27: 100334.
[3] Matsukuma S, et al. Essential updates to the surgical treatment of biliary tract cancer. Ann Gastroenterol Surg. 2019;3(4):378–89.
[4] Lamarca A, et al. Current standards and future perspectives in adjuvant treatment for biliary tract cancers. Cancer Treat Rev. 2020;84: 101936.
[5] Primrose JN, et al. Capecitabine compared with observation in resected biliary tract cancer (BILCAP): a randomised, controlled, multicentre, phase 3 study. Lancet Oncol. 2019;20(5):663–73.
[6] Shrof RT, et al. Adjuvant therapy for resected biliary tract cancer: ASCO Clinical Practice Guideline. J Clin Oncol. 2019;37(12):1015–27.
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-140935
有效期至:2025/8/7
排版编辑:肿瘤资讯-REX











 苏公网安备32059002004080号
苏公网安备32059002004080号


