研究背景
卵巢癌(OC)是全球妇科肿瘤中致死率第二高的疾病,美国预计2023年将诊断19,710例新病例并导致13,270例死亡。大多数上皮性卵巢癌(EOC)在无明显早期症状的情况下晚期被发现,其常规治疗包括手术和紫杉醇(PTX)及卡铂化疗。然而,约70%晚期患者因化疗耐药而在三年内复发,这突出了开发早期诊断和克服耐药性的重要性。
本研究聚焦吡哆醇5'-磷酸氧化酶(PNPO),此前研究发现其是OC的潜在生物标志物。PNPO在OC细胞中高表达,与不良预后密切相关,并促进细胞周期蛋白B1活性及CDK1磷酸化,加速细胞周期。PNPO还通过增强溶酶体合成及自噬流影响细胞增殖和存活。研究显示,自溶酶体标记物LAMP2表达上调,PNPO的功能依赖于其与LAMP2的交互,形成PNPO-LAMP2轴。抑制PNPO或使用氯喹干预其自噬流均抑制肿瘤生长,特别在耐紫杉醇OC细胞中,PNPO过表达与耐药性相关,而PNPO-siRNA可提高对紫杉醇的敏感性。这些结果强调了PNPO作为治疗靶点,尤其在逆转紫杉醇耐药性和抑制肿瘤生长方面的应用潜力。
研究方法
细胞培养:我们从美国典型培养物保藏中心(ATCC)获得人上皮性卵巢癌细胞系OVCAR-3、SK-OV-3、A2780,以及非肿瘤性人卵巢表面上皮细胞系IOSE-80和人胚肾细胞系HEK293T。所有细胞系均在含10%胎牛血清的RPMI-1640或DMEM培养基中培养,并定期进行无病原体和无支原体检测。
分子操作:使用针对PNPO的siRNA、shRNA及过表达质粒进行细胞转染。使用X-treme GENE siRNA转染试剂和Lipo8000进行转染。
基因和蛋白分析:使用RNA-Quick纯化试剂盒提取总RNA,并利用Roche的cDNA合成试剂盒进行qRT-PCR分析。蛋白质通过SDS-PAGE电泳后转移到PVDF膜上,使用一系列特异性抗体进行西方印迹分析,并通过BeyoECL Moon检测信号。
免疫荧光与细胞功能实验:细胞用4%对甲醛固定后,用Triton X-100透化,使用特定抗体进行免疫荧光染色,并使用共聚焦显微镜成像。使用CCK-8试剂盒进行细胞活力测试,通过EdU标记、集落形成实验和流式细胞仪分析细胞增殖、周期和凋亡。
动物实验:通过在BALB/c裸鼠中进行皮下注射建立异种移植模型,评估PNPO干预的疗效。使用CQ和PTX进行药物敏感性测试,并通过测量肿瘤体积来评估治疗效果。
免疫组化与组织染色:从小鼠肿瘤组织中进行样本采集,固定和包埋后进行HE染色和免疫组化分析,使用特异性抗体检测PNPO、Ki67和LAMP2的表达。
研究结果
1.PNPO在OC中的过表达及其作为预后因素
与正常样本相比,基于TCGA-OV数据库的分析显示,OC患者中PNPO mRNA表达过高(图1A)。通过qRT-PCR和西方印迹验证,OC细胞中PNPO在mRNA和蛋白水平上均高于非癌变的IOSE-80细胞(图1B-D)。基因组分析显示,在OC患者中检测到PNPO的扩增(图1E)。基因集富集分析(GSEA)和基因集变异分析(GSVA)表明,OC中PNPO的表达与溶酶体、细胞周期、药物代谢、TGF-β信号通路和MAPK信号通路中富集的某些基因相关(图1F-G)。对GSE17260和GSE32062数据集进行主成分分析,去除批次效应后,使用Kaplan-Meier生存分析(图1H)和表S3中提供的GEO数据集信息。Kaplan-Meier Plotter分析表明,高PNPO水平的患者具有较低的总体生存率和无进展生存率(图1I-J)。
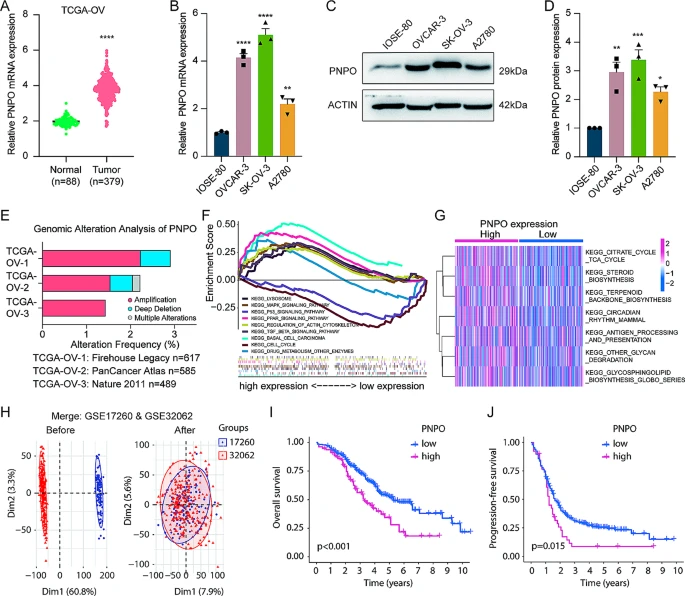
图1 PNPO 在卵巢癌中的表达和生物学功能富集
2.PNPO通过调节cyclin B1和磷酸化CDK1与OC细胞增殖正相关
通过CCK-8实验检测到,PNPO的敲低减少了,而PNPO的过表达增加了OVCAR-3和SK-OV-3细胞的活力(图2A-B)。此外,西方印迹证实,PNPO的敲低下调了,而oe-PNPO上调了细胞周期相关蛋白,如cyclin B1和磷酸化CDK1(图2C-F)。
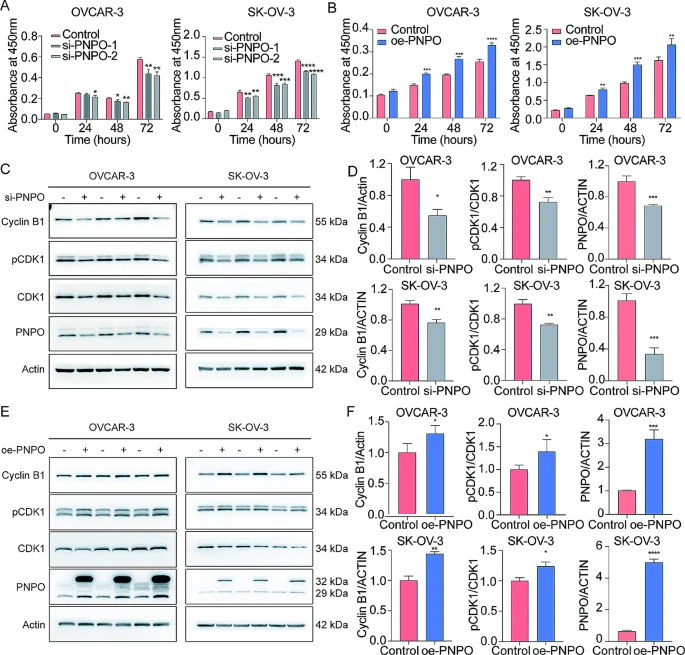
图2 PNPO 对 OVCAR-3 和 SK-OV-3 细胞生长的影响
3.过表达的PNPO增强了溶酶体的生物合成和近核分布
由于PNPO过表达与GSEA中显示的溶酶体途径相关(图1F),因此使用LysoTracker实验来追踪OC细胞中溶酶体的聚集和分布。研究发现,过表达PNPO增强了红色信号并增加了溶酶体的近核聚集(图3A)。通过增功能和失功能方法,发现PNPO的过表达增强了与溶酶体途径相关的基因表达,如LAMP1、Psap、Ctsa、Ctsg、Atp6ap1和Atp6v1e1(图3B-C)。LAMP2,一种在溶酶体膜上呈现的经典分子,通过GEPIA2分析发现与PNPO表达正相关(p < 0.0001)(图3D)。实际上,通过qRT-PCR检测,PNPO的过表达增加了,而PNPO的敲低减少了LAMP2 mRNA表达(图3E-F)。因此,免疫荧光染色证实了在PNPO过表达细胞中LAMP2蛋白的表达(图3G)。

图3 PNPO 对卵巢癌细胞溶酶体生物发生和分布的影响
4.PNPO促进了自噬体的降解并增强了OC细胞中的自噬流
在OVCAR-3和SK-OV-3细胞中,PNPO过表达导致自噬蛋白LC3-II的减少,而PNPO的敲低导致LC3-II的增加(图4A-D)。通过用Hank's平衡盐溶液(HBSS)替换完全培养基并孵育2小时来诱导自噬,观察到oe-PNPO引起的LC3-II减少,这通过营养耗竭诱导自噬(图4A)。此外,OC细胞中oe-PNPO引起的LC3-II减少在存在溶酶体抑制剂氯喹(CQ)时被阻断。CQ的添加挽救了PNPO对LC3-II的影响,表明PNPO并不影响自噬体的形成。这些数据表明,PNPO通过影响自噬体的降解而不是自噬的诱导来调节自噬。有趣的是,观察到PNPO促进了溶酶体的近核分布和水解功能。使用mCherry-GFP标记的LC3,发现过表达PNPO导致红色荧光更亮(图4E),而沉默PNPO导致黄色荧光增加(图4F),表明过表达PNPO可以诱导溶酶体的近核聚集。这些数据表明,PNPO通过抑制14-3-3的磷酸化促进TFEB从细胞质转移到核,从而调节LAMP2的表达。
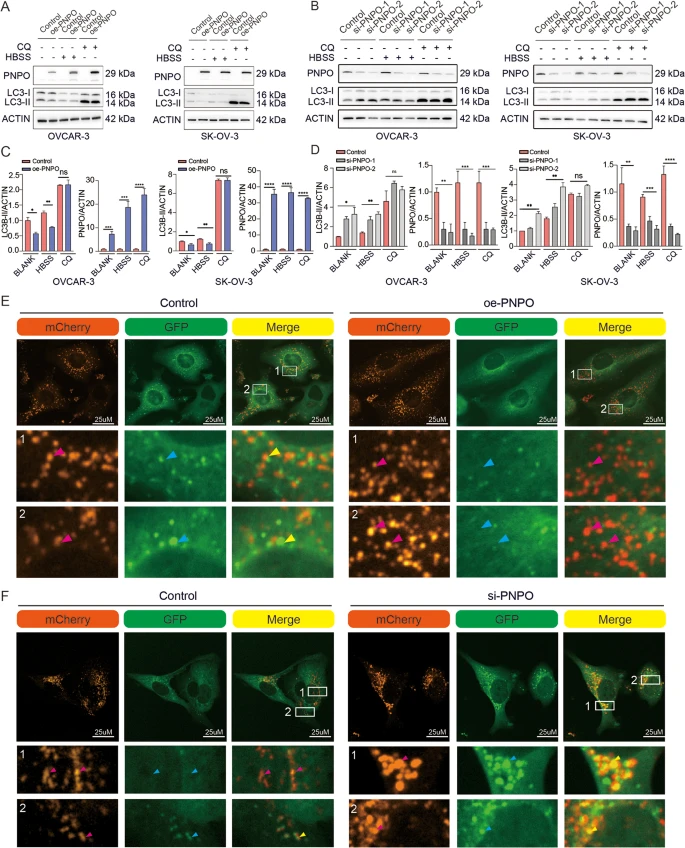
图4 PNPO对卵巢癌细胞自噬的影响
5.LAMP2在OC细胞中的上调与细胞生存负相关
对GSE26712、GSE8841和GSE17260数据集的Kaplan-Meier图分析表明,LAMP2的高表达与OC患者预后不良相关(图S6B-D)。通过qRT-PCR在RNA水平上验证了3种siRNA对LAMP2的敲低效率(图5A),并通过Western blot在蛋白水平上确认了2种siRNA(图5B)。因此,在OC细胞中观察到LAMP2敲低后细胞活力下降(图5C)。流式细胞术分析显示,在OVCAR-3和SK-OV-3细胞中LAMP2敲低后凋亡细胞增加(图5D-H)。这些数据表明,沉默LAMP2可能抑制OC细胞生长并诱导OC细胞凋亡。

图5 LAMP2-siRNA 对 OVCAR-3 和 SK-OV-3 细胞的影响
6.沉默LAMP2阻断了OC细胞中PNPO的作用
接下来,我们检查了si-LAMP2是否影响PNPO对OC细胞增殖、集落形成、凋亡和自噬的作用。在OVCAR-3和SK-OV-3细胞中,PNPO的过表达通过EdU实验增加了OC细胞增殖,而oe-PNPO诱导的增殖在LAMP2敲低时被抑制(图6A-B)。集落形成实验进一步证实了LAMP2对这些细胞中PNPO作用的影响(图6C)。沉默PNPO诱导了OVCAR-3和SK-OV-3细胞凋亡,而PNPO的过表达抑制了凋亡,这在LAMP2-siRNA存在时被取消(图6D)。这些数据表明,LAMP2的沉默可能通过调节自溶酶体,特别是通过LAMP2,阻断PNPO在OC细胞中的作用,证明了PNPO-LAMP2轴的存在。
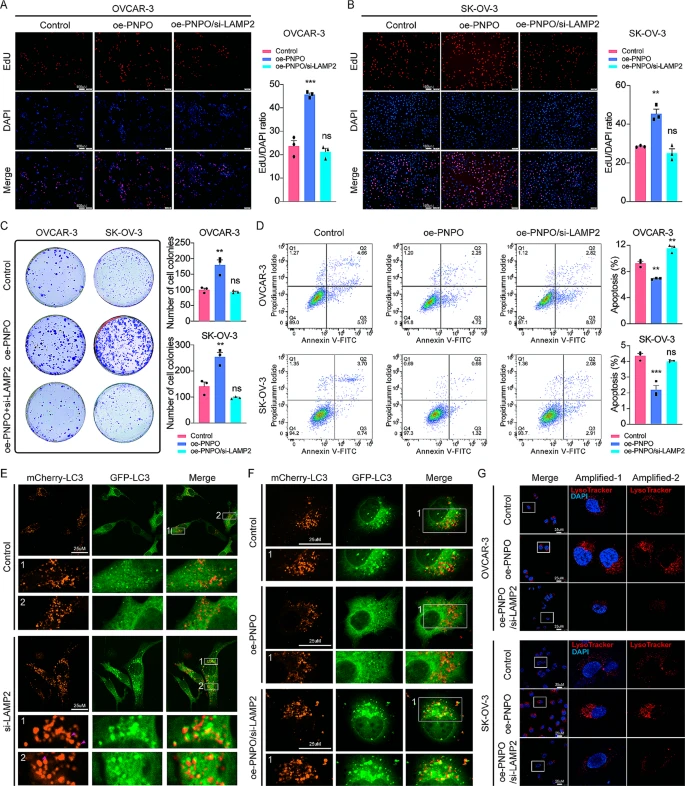
图6 PNPO 对卵巢癌细胞行为及 LAMP2 降解自噬的影响
7.通过抑制自噬流,PNPO的敲低抑制了异种移植瘤的形成
由于PNPO促进了自噬体的降解,我们随后检查了PNPO对体外和体内肿瘤生长与自噬关系的影响。使用CQ作为自噬流的抑制剂,首先发现50 µM的CQ降低了OVCAR-3和SK-OV-3细胞的活力(图7A)。接下来,我们也观察到CQ抑制了OVCAR-3和SK-OV-3细胞的集落形成(图7B-C)。此外,CQ显著增加了OVCAR-3和SK-OV-3细胞的凋亡率(图7D-E)。体内实验表明,PNPO的敲低和CQ的管理显著抑制了SK-OV-3细胞异种移植的肿瘤生长,而sh-PNPO和CQ的组合协同增强了抑制效果(图7F)。肿瘤体积的统计分析证实了对肿瘤生长的抑制效果(图7G-H)。HE染色显示了肿瘤组织的构造,Ki67染色和Tunnel实验表明,PNPO的敲低在肿瘤组织中减少了增殖细胞并增加了凋亡细胞(图7I)。此外,西方印迹揭示了PNPO的敲低和CQ的管理在肿瘤组织中通过降低LC3的降解刺激了LC3的积累(图7J)。这些数据证明了PNPO的下调可以阻断肿瘤的生长,而CQ的管理可以扩大sh-PNPO对肿瘤生长的抑制效果。
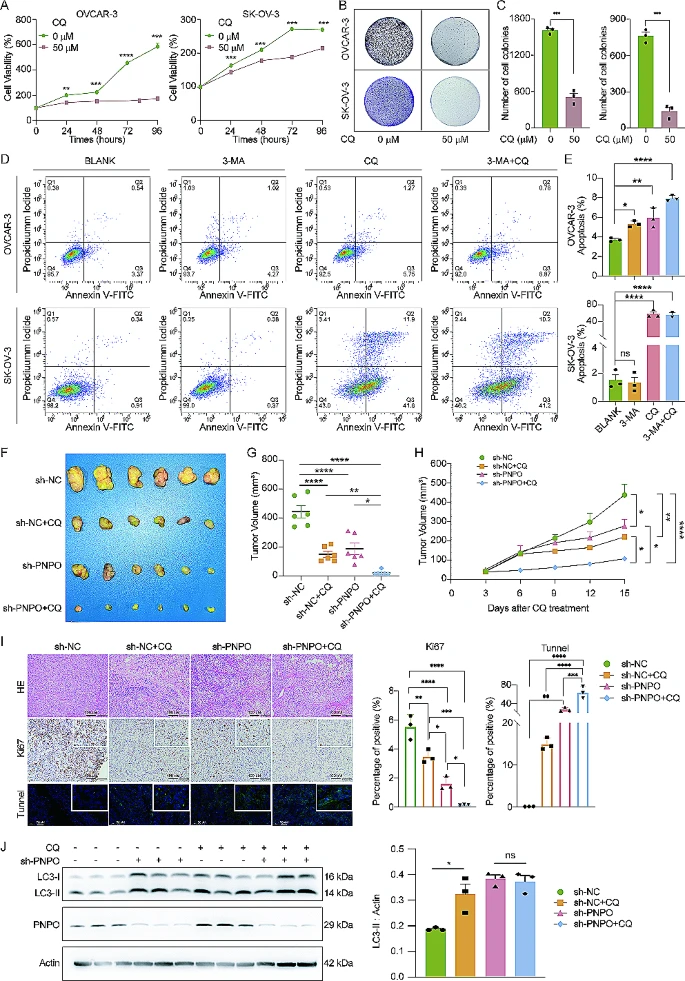
图7 氯喹 (CQ) 对 PNPO 敲低作用的促进作用
8.PNPO是OC细胞中紫杉醇耐药性的因素
RNA测序显示,与亲本敏感细胞A2780相比,耐药的OC细胞(A2780-PTX)中PNPO表达上调(图8A)。通过qRT-PCR和西方印迹在mRNA水平和蛋白水平上,分别确认了两个耐药细胞系(A2780-PTX和OV3R-PTX)与其对应的敏感细胞系(A2780和OVCAR-3)中PNPO的过表达(图8B-D)。接下来,我们通过感染OV3R-PTX细胞与PNPO-shRNA(sh-PNPO)生成了PNPO敲低细胞系。同时构建了阴性对照-shRNA细胞系(sh-NC)。三维(3D)培养显示,PNPO-shRNA减小了OV3R-PTX细胞的微球大小(图8E-F),表明通过敲低PNPO抑制了细胞生长。微球形成实验表明,敲低PNPO使OV3R-PTX细胞对PTX敏感(图8G)。沉默PNPO在两个耐药细胞(A2780-PTX和OV3R-PTX)中降低了PTX的IC50,而PNPO的过表达在两个敏感细胞(A2780和OVCAR-3)中增加了PTX的IC50(图8H-I)。这些数据表明,PNPO的下调可能会逆转OC细胞对PTX的耐药性。接下来,我们检查了PNPO-shRNA对裸鼠中肿瘤形成的影响。典型的光学图像显示,在sh-PNPO + PTX小鼠中出现了较小的肿瘤(图8J)。敲低PNPO抑制了肿瘤生长,并在PTX存在的情况下倾向于增加(图8K),尽管在sh-NC + PTX和sh-PNPO + PTX组之间没有统计差异(图8L)。
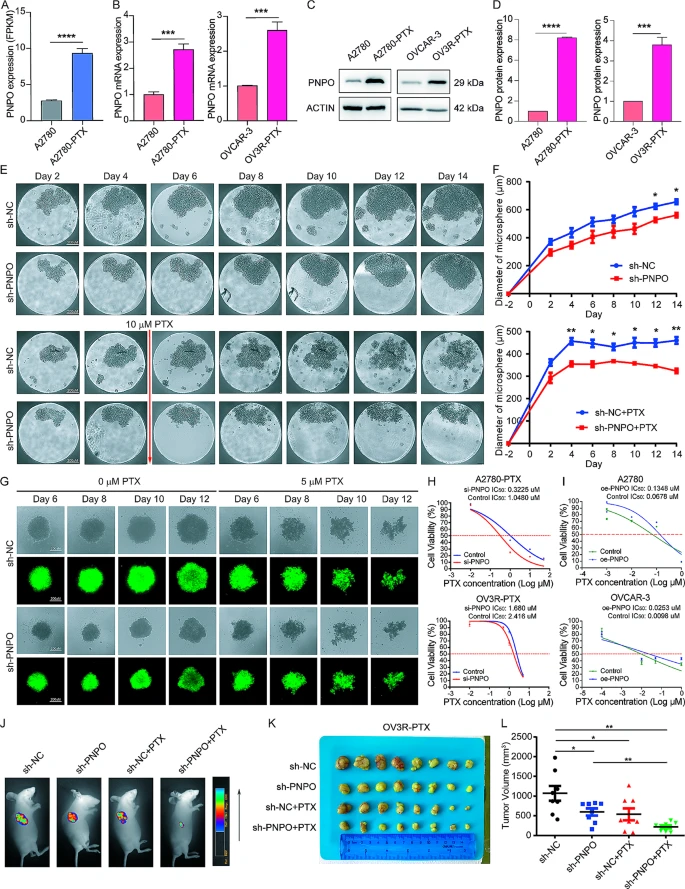
图8 通过敲低 PNPO 来增强紫杉醇敏感性
研究结论
本研究揭示了PNPO通过增强溶酶体生物合成和自噬流来促进卵巢癌细胞的增殖和肿瘤形成,并确认了PNPO是紫杉醇耐药性的一个关键因素。敲低PNPO能够抑制肿瘤生长,并增强卵巢癌细胞对紫杉醇的敏感性,表明靶向PNPO可能是治疗卵巢癌和逆转耐药性的潜在策略。
Li, X., Guan, W., Liu, H. et al. Targeting PNPO to suppress tumor growth via inhibiting autophagic flux and to reverse paclitaxel resistance in ovarian cancer. Apoptosis (2024). https://doi.org/10.1007/s10495-024-01956-3.
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批号:CN-135492
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


