我国是食管癌高发国家,发病率和死亡率在所有恶性肿瘤中处于前列,且半数以上患者在初诊时已属局部晚期或晚期[1]。由于局部晚期或晚期食管癌死亡率高,疗效差,单纯手术治疗对于提高患者总生存期(OS)率已达瓶颈[2]。
研究显示,新辅助放化疗治疗可明显延长食管癌患者术后OS[3],[4]。此外,免疫治疗加入新辅助放化疗也是探索方向之一,目前也有较多的临床研究证明了新辅助免疫联合化疗、新辅助同步放化疗联合免疫治疗等模式在可切除局部晚期食管癌中具有一定的疗效[5],[6]。但新辅助免疫治疗能否为食管癌手术带来更高的病理完全缓解(pCR)率和进一步延长患者术后OS呢?基于此,本文特分享一例食管癌转化治疗病例,为临床探索食管癌免疫治疗方案提供参考。
病例介绍
基本情况
患者男性,42岁。因“进食梗阻感1月余”入院。
既往史:无。
个人史:饮酒20年,250ml/天。
一般情况:T36.5℃ P82次/分 R19次/分 BP:112/71mmHg,身高:175cm,体重:71.5kg,发育正常,营养良好,体型适中,自主体位,正常面容,神志清晰,查体合作。
查体:心脏听诊未闻及病理性杂音,双肺未闻及干湿性啰音,腹平软,无压痛,未及异常包块,移动性浊音阴性。
治疗前辅助检查
2022.03.04行胃镜检查提示:(EJ019483)距门齿26cm处可见隆起性新生物,表面粗糙,上覆污苔,易出血,镜身不再通过。内镜诊断:食管癌。
2022.03.07活检病理示:“鳞状细胞癌”。未行PD-L1检测。
PET-CT提示:1、食管胸上段肿块,代谢增高,考虑食管癌。2、双侧气管食管沟淋巴结,代谢增高,考虑转移。
2022.03.08治疗前胸腹部增强CT诊断结果:
食管胸上段管壁明显增厚,符合食管癌表现,局部气管后壁可疑增厚,周围脂肪间隙消失。
双侧气管-食管旁增大淋巴结,考虑转移。
右肺上叶及中叶散在小斑片影,考虑炎性病变,建议治疗后复查。
右肺尖磨玻璃小结节,建议随访。
右肺少许纤维灶;双侧锁骨上稍大淋巴结,建议随访。
肝内散在小囊肿;肝裂旁稍低密度影,建议随访。
脾内散在稍低密度灶,考虑良性;右肾细小囊肿。
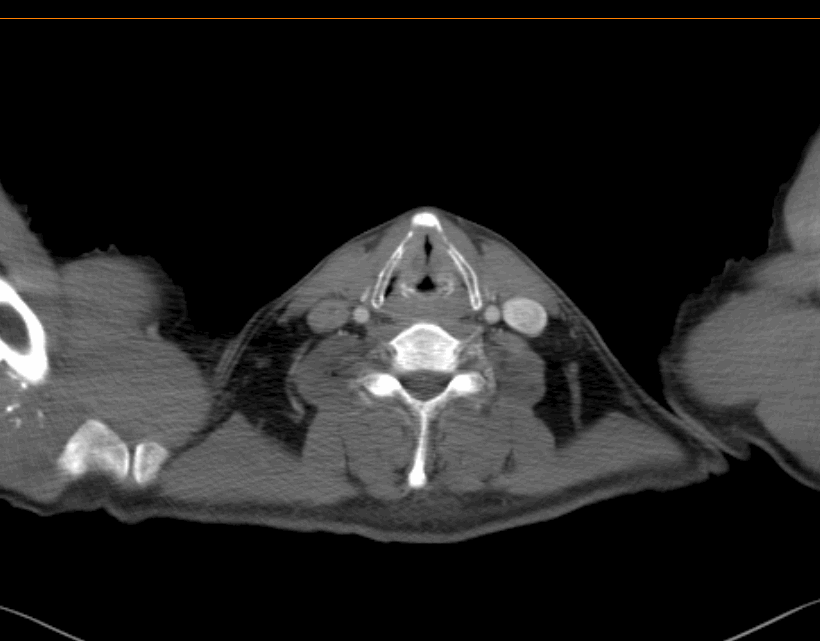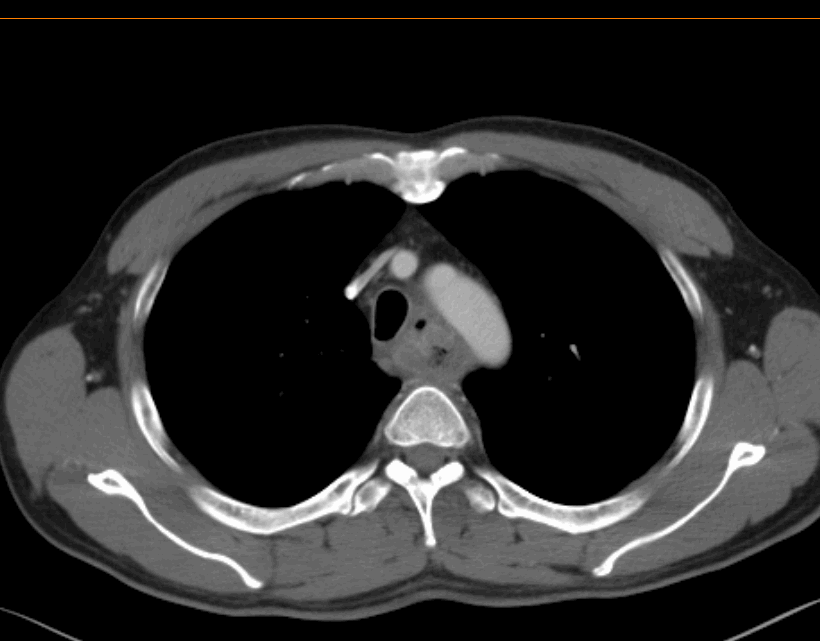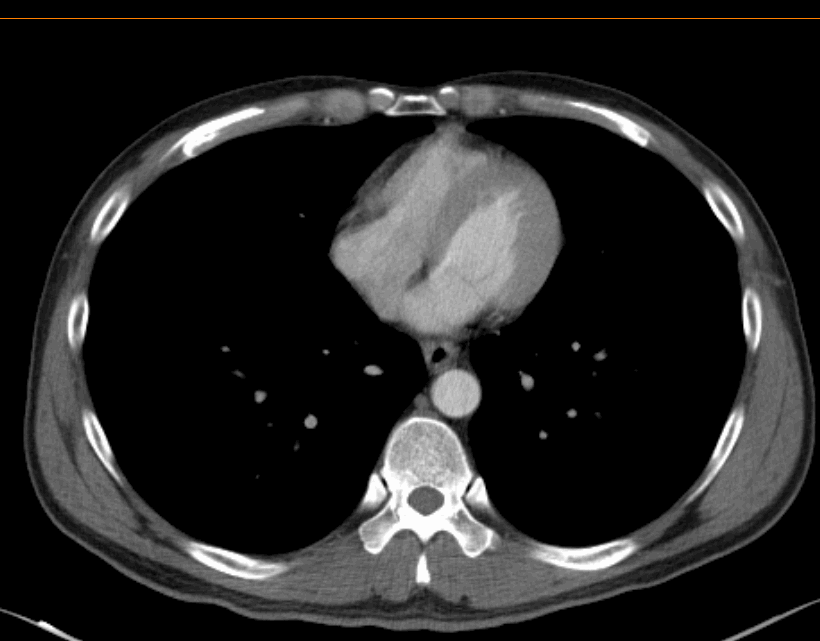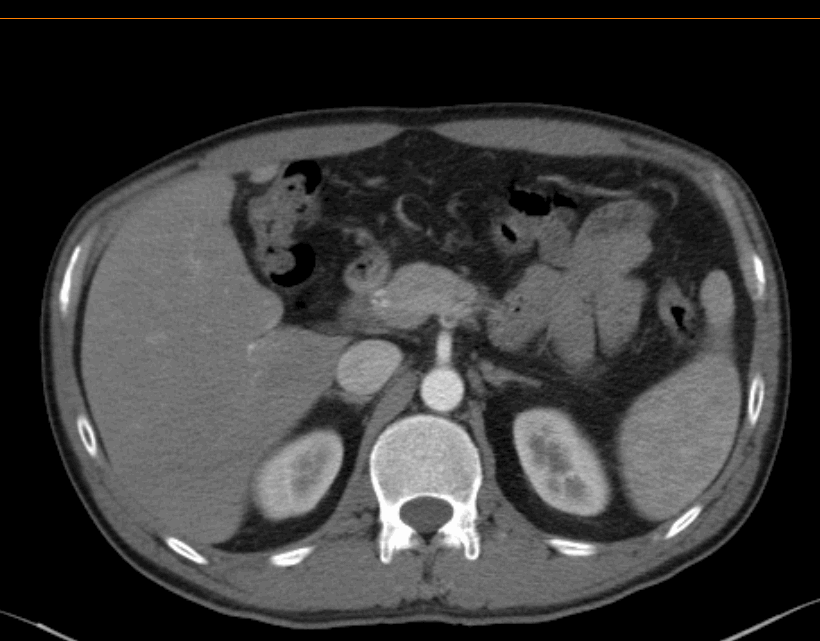 2022.03.08治疗前胸腹部增强CT
2022.03.08治疗前胸腹部增强CT
2022.03.15 B超引导下双侧锁骨上淋巴结穿刺病理诊断结果:"右侧锁骨上结节针吸”:见少量退变异型细胞伴大片坏死。"左侧锁骨上结节针吸”:见小团异型细胞伴大片坏死,倾向转移或浸润性癌。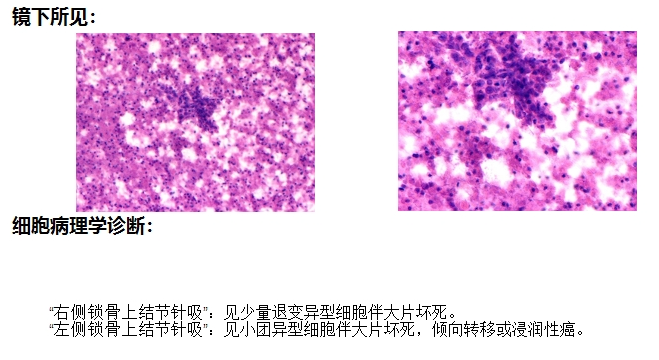 2022.03.15 B超引导下双侧锁骨上淋巴结穿刺病理
2022.03.15 B超引导下双侧锁骨上淋巴结穿刺病理
初步诊断
食管恶性肿瘤(鳞癌,cT3N2M1a)(cTⅣa)
治疗经过
新辅助治疗:
第1周期新辅助治疗:
完善化疗及免疫治疗前检查,未见明显禁忌。
患者于2022-03-14行第1周期新辅助化疗联合免疫治疗,方案为:白蛋白紫杉醇0.45g D1+卡铂750mg D1化疗+斯鲁利单抗200mg免疫治疗。治疗期间无明显不良反应。
用药后疗效评估:1周期治疗后胸腹部增强CT(2022.04.02)
食管癌新辅助治疗后,对比2022.03.08 CT:
食管胸上段管壁明显增厚,较前相仿,局部气管后壁可疑增厚,周围脂肪间隙消失。
双侧气管-食管旁增大淋巴结,考虑转移,较前相仿。
右肺炎症基本吸收。右肺少许纤维灶。
右肺磨玻璃小结节,较前相仿,建议随访。
双侧锁骨上稍大淋巴结,较前相仿,建议随访。
肝内散在小囊肿;肝裂旁稍低密度影,较前相仿,建议随访。
脾内散在稍低密度灶,较前相仿,建议复查。
右肾细小囊肿。
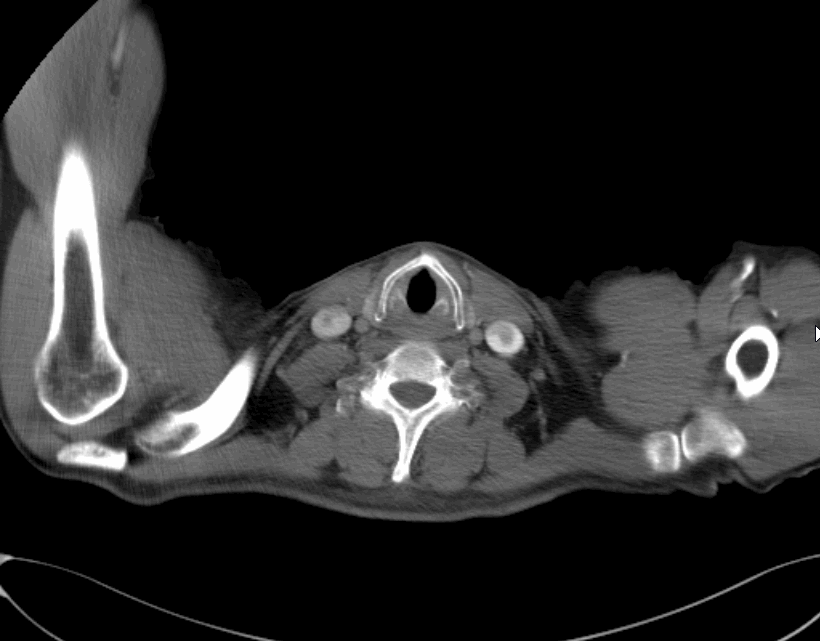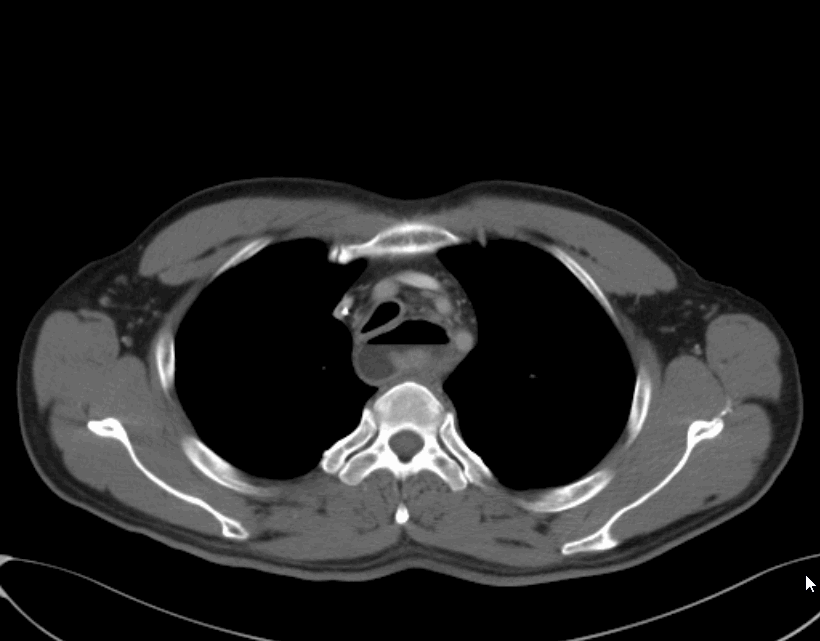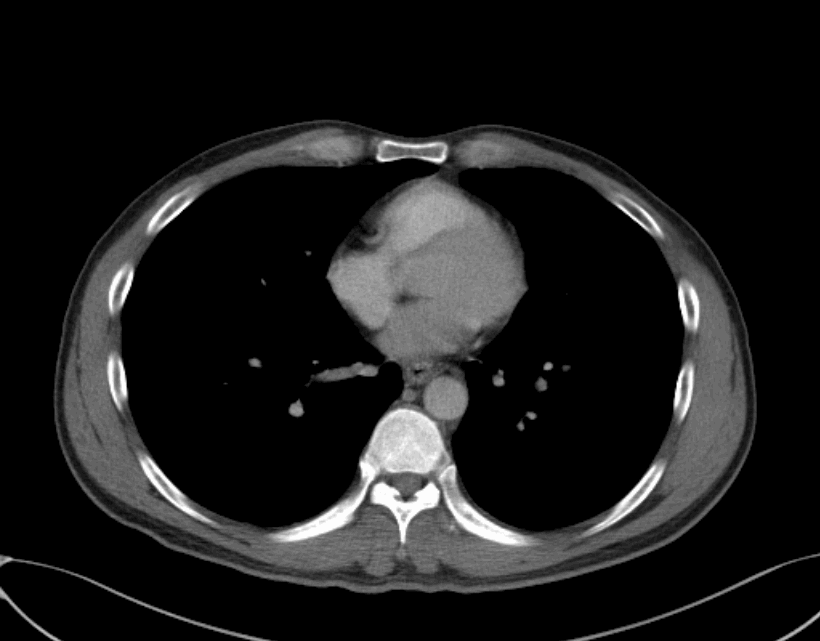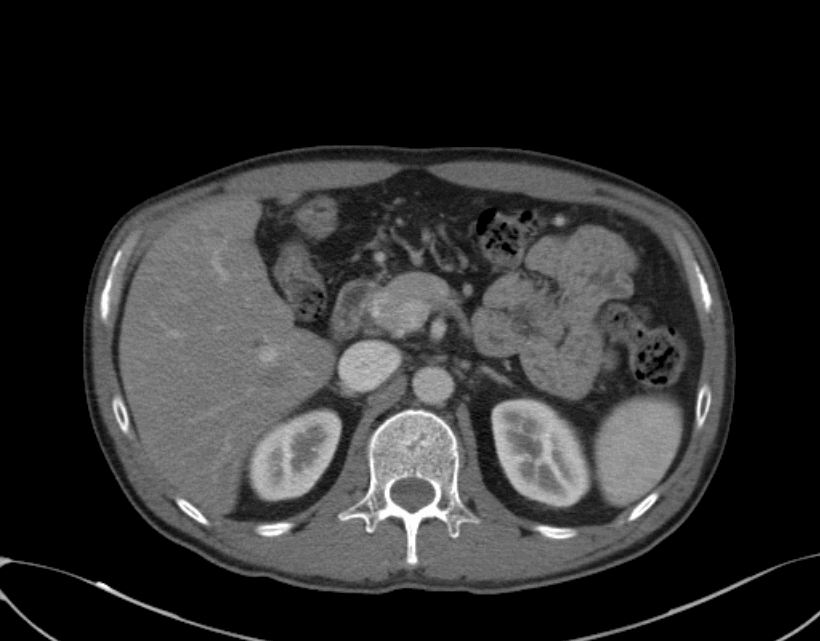
2022.04.02 术前治疗1周期治疗后胸腹部增强CT
评估:1周期治疗后,SD。
第2周期新辅助治疗:
患者于2022-04-07行第2周期新辅助化疗联合免疫治疗,方案为:白蛋白紫杉醇0.45g D1+卡铂750mg D1化疗+斯鲁利单抗200mg免疫治疗。治疗期间无明显不良反应。
用药后疗效评估:2周期治疗后胸腹部增强CT(2022.04.29)
食管癌新辅助治疗后,对比2022.04.02CT:
食管胸上段管壁增厚伴梗阻改变,较前好转;局部气管后壁略增厚较前好转。
双侧气管-食管旁转移淋巴结,大部分较前缩小;双侧锁骨上稍大淋巴结,其中右侧较前缩小,建议复查。
双肺新出现散在炎症,建议复查。右肺少许纤维灶。
右肺尖磨玻璃小结节,较前相仿,建议随访。
肝内散在小囊肿;肝裂旁稍低密度影,较前略缩小,建议结合MR检查。
脾内散在稍低密度灶,较前相仿,建议复查。
右肾细小囊肿。
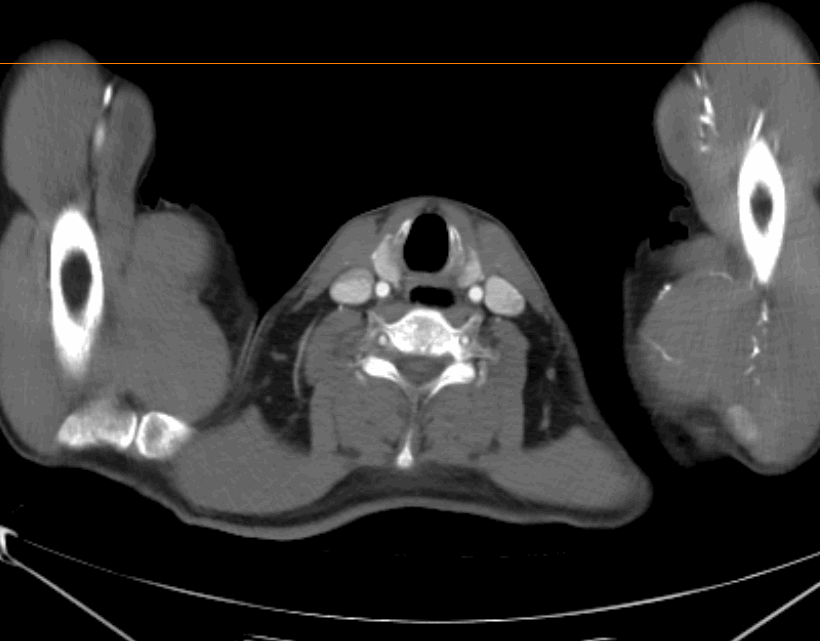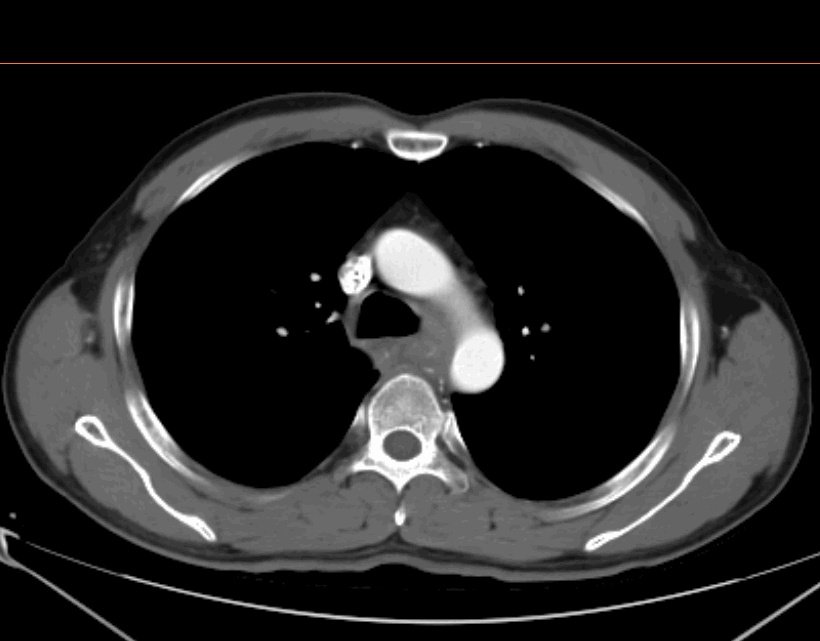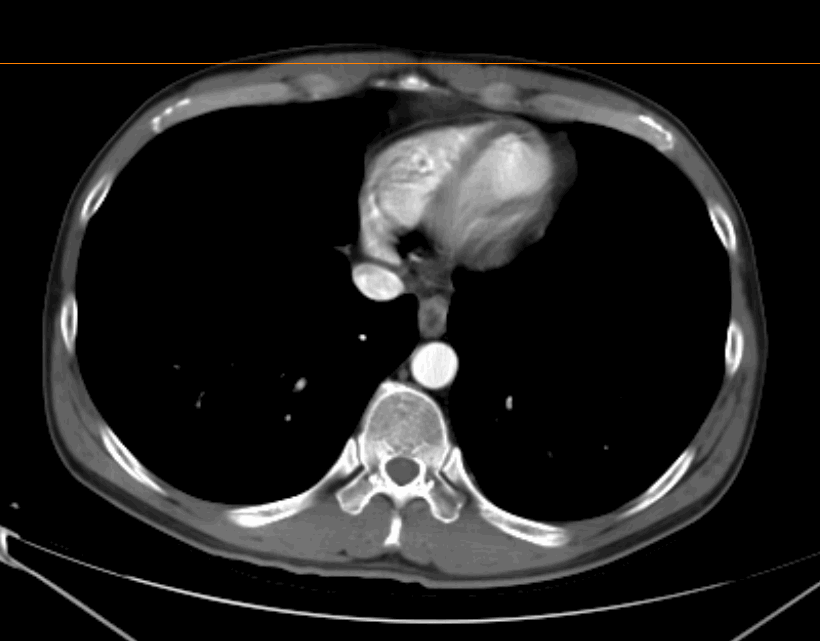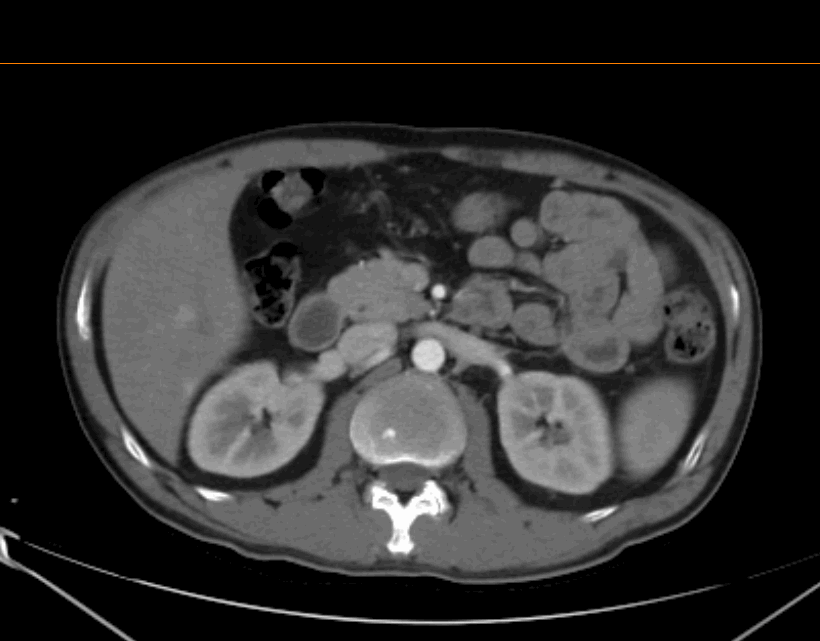 2022.04.29 术前治疗2周期后胸腹部增强CT
2022.04.29 术前治疗2周期后胸腹部增强CT
评估:2周期治疗后,PR。
第3、4周期新辅助治疗:
患者于2022-04-30及2022-05-23行第3、4周期新辅助化疗联合免疫治疗,方案为:白蛋白紫杉醇0.45g D1+卡铂750mg D1化疗+斯鲁利单抗200mg免疫治疗。治疗期间无明显不良反应。
用药后疗效评估:4周期治疗后胸腹部增强CT(2022.06.09)
食管癌新辅助治疗后,对比2022.04.29CT:
食管胸上段管壁仍增厚,较前略好转。
气管食管沟、左锁骨上小淋巴结,较前相仿;右锁骨上淋巴结较前缩小。
两肺炎症较前吸收;右肺少许纤维灶。
右肺尖磨玻璃小结节,较前相仿,建议定期复查。
肝内散在小囊肿;肝裂旁稍低密度影;均较前相仿。
脾内散在稍低密度灶,右肾细小囊肿,均较前相仿。
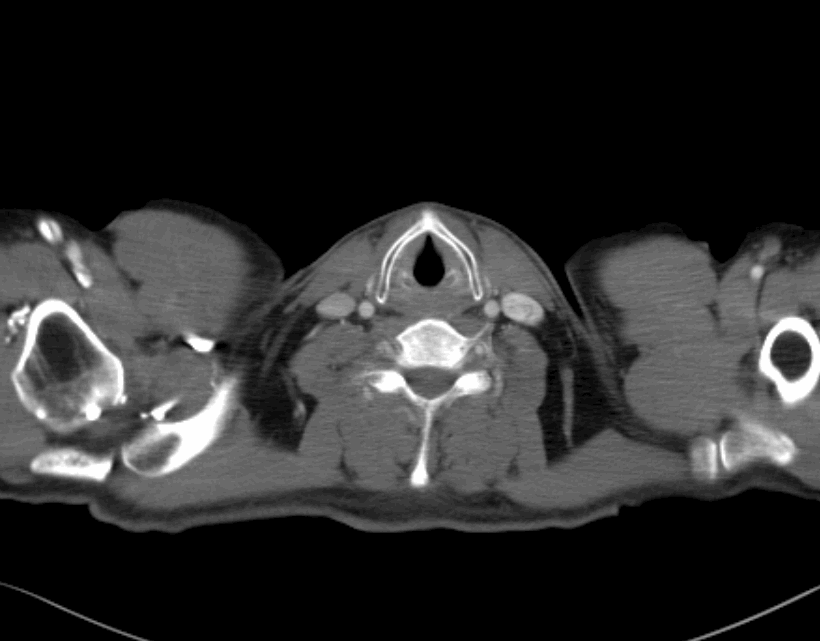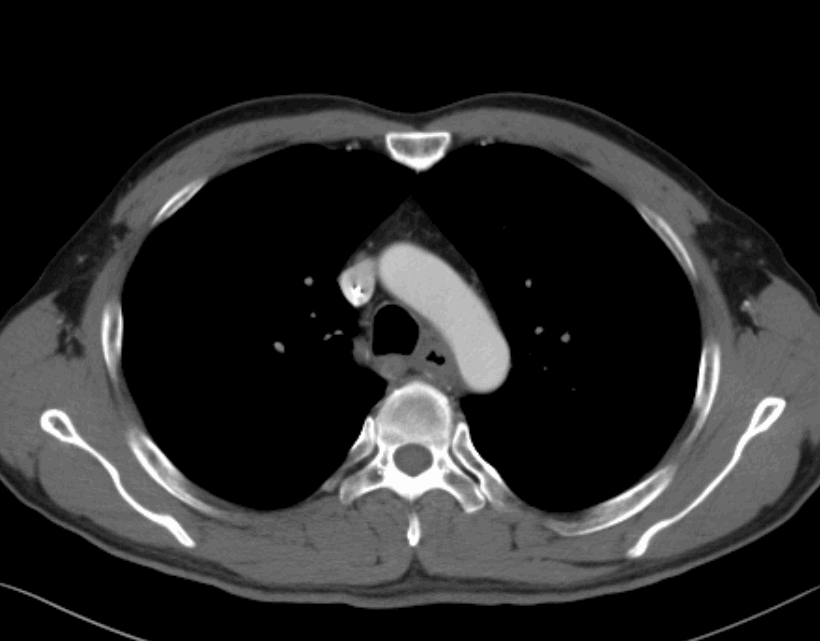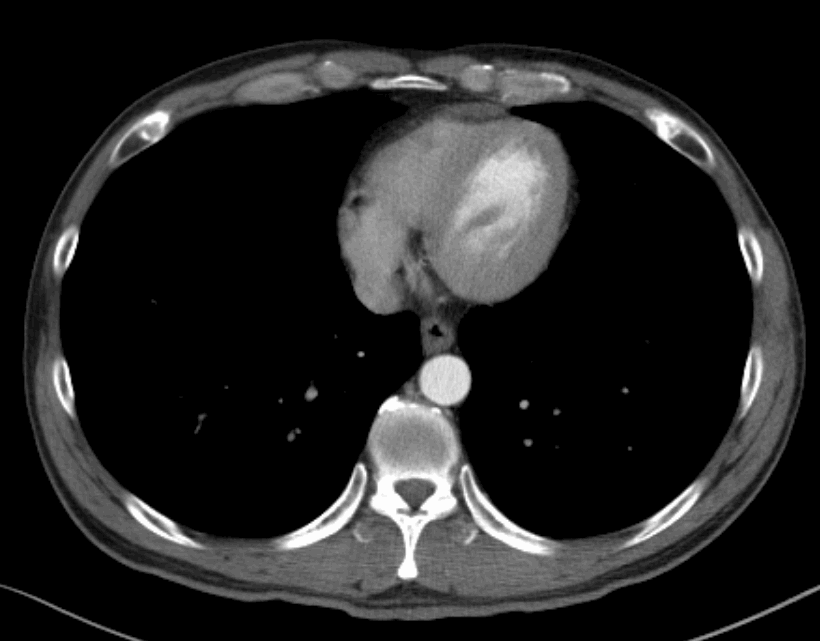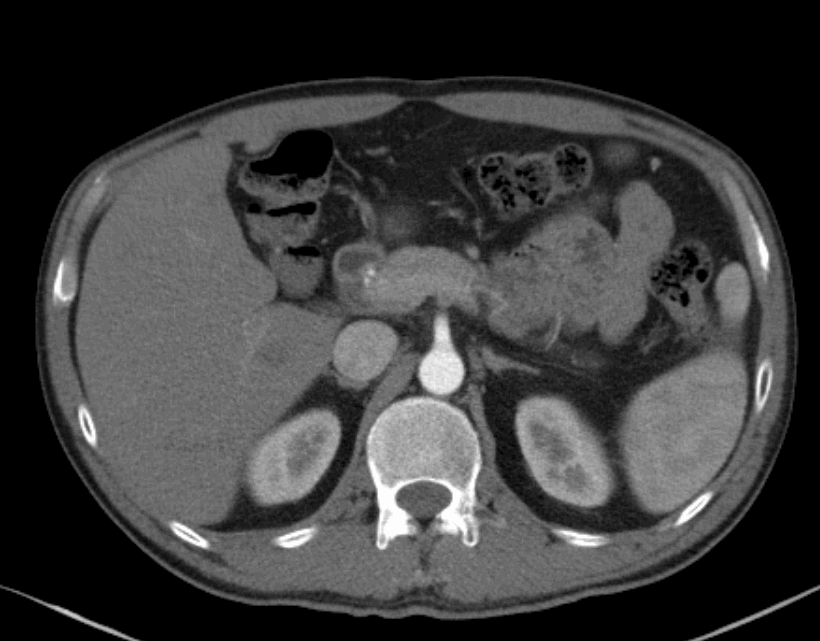 2022.06.09治疗前胸腹部增强CT
2022.06.09治疗前胸腹部增强CT
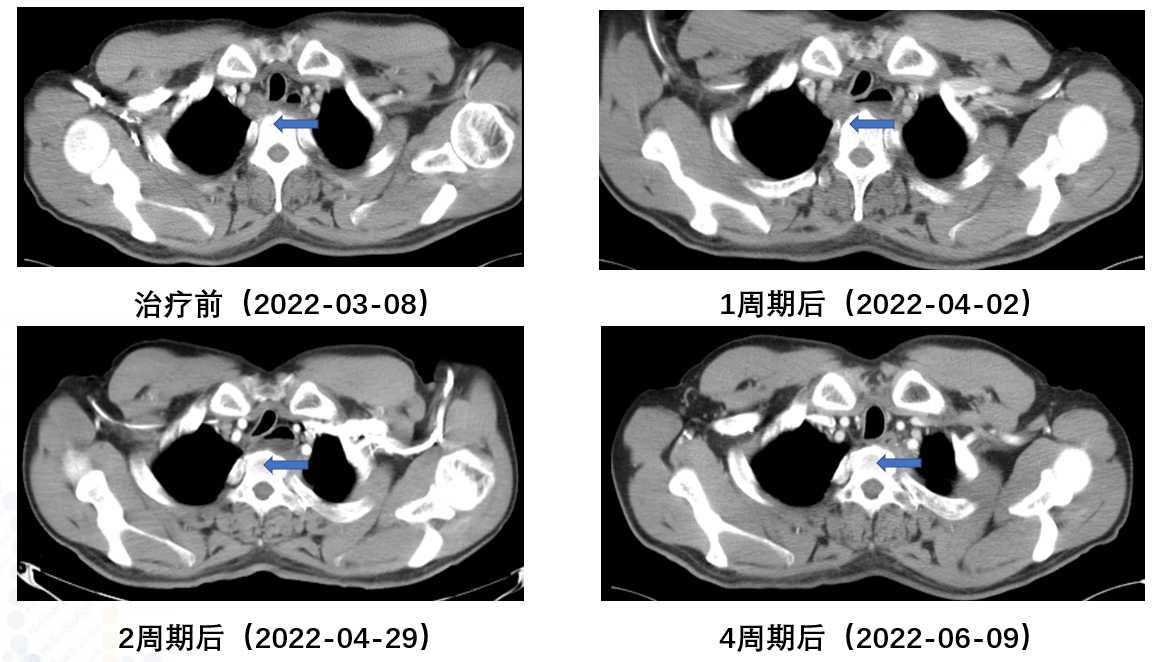 淋巴结新辅助免疫治疗前后对比
淋巴结新辅助免疫治疗前后对比
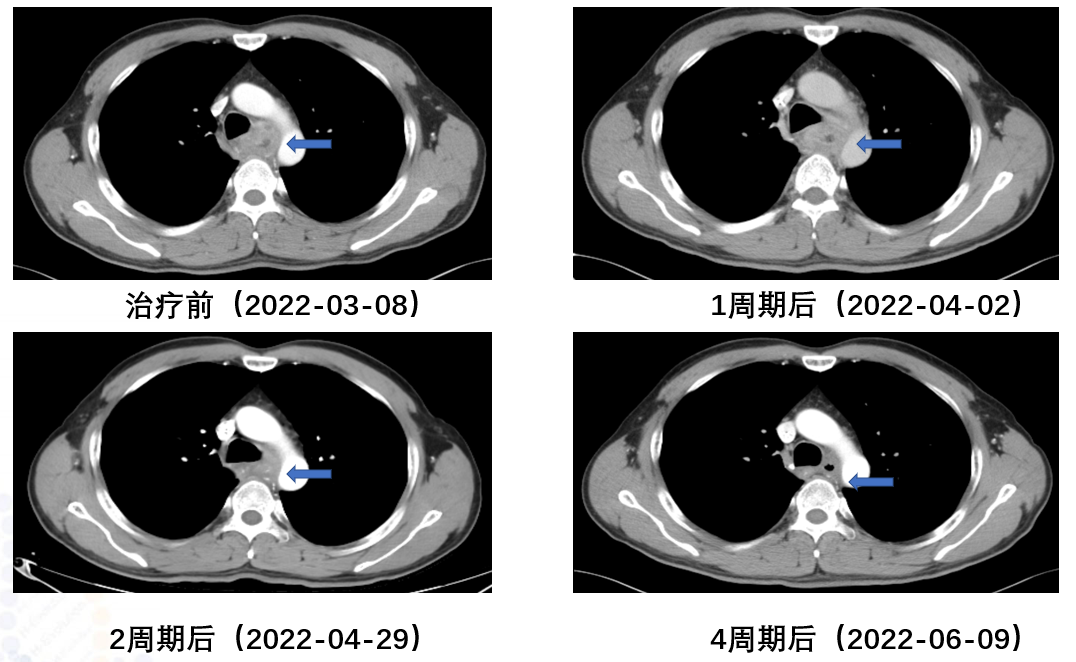 原发病灶新辅助免疫治疗前后对比
原发病灶新辅助免疫治疗前后对比
评估:4周期治疗后,肿瘤继续缩小,PR。
手术治疗:
排除手术禁忌后。患者于2022-7-4全麻下行颈部淋巴结清扫术+胸腹腔镜(McKeown)食管癌根治术。术后病理诊断:患者食管中上段鳞癌ypT1N2M0,IIIA期。

术后辅助治疗:
根据患者术后诊断(食管中上段鳞癌ypT1N2M1a,TⅣa期),术后辅助治疗选择放疗,以降低局部复发风险,延长生存时间。
2022-08-26到2022-10-05,患者行术后辅助放疗。患者的放疗剂量为5040cGy/28F,根治性术后辅助放疗计划为:靶区勾画:CTV=2、4、5、7区纵隔及双侧锁骨上淋巴引流区,PTV=CTV+5mm。靶区剂量:95%PTV体积剂量为50.4Gy/28F;危及器官受量:脊髓Dmax=3896cGy,双肺V5=39.65%,V20=11.56%,V30=4.55%,Dmean=758cGy,心脏V40=8.06%,Dmean=1093cGy。
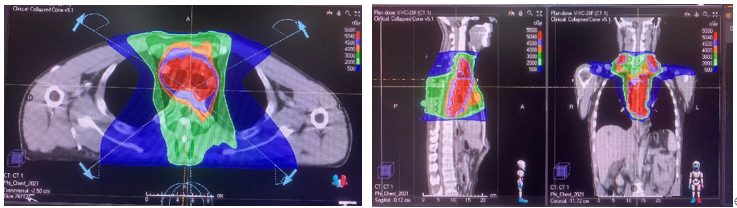 根治性术后辅助放疗计划
根治性术后辅助放疗计划
放疗后疗效评估:最近放疗后复查胸腹部增强CT(2023.02.08)
对比2022-11-2 CT:
食管术后改变,弓上吻合口区吻合口状况建议结合临床及相应检查。
两肺纵隔旁炎性灶,考虑放疗后改变,较前相仿。
右肺尖磨玻璃小结节,较前相仿,建议复查。
肝囊肿,肝裂旁稍低密度影,较前相仿。
脾内散在稍低密度影,较前相仿。
右肾细小囊肿。

2023.02.08 最近放疗后复查胸腹部增强CT
治疗经过:

讨论
近年来,新辅助免疫治疗已在一些I期和Ⅱ期临床研究中显示出初步的疗效[7],[8]。《食管癌放疗联合免疫治疗专家共识(2023年版)》提到,对于可切除的局部晚期食管癌患者, 新辅助放化疗联合免疫治疗可获得较高的病理学完全缓解(pCR)率, 不良反应和既往术前放化疗相似, 推荐开展临床研究[9]。但本例患者在4周期新辅助化疗联合免疫治疗实现部分缓解(PR)后,行颈部淋巴结清扫术+胸腹腔镜(McKeown)食管癌根治术却无法实现pCR(即Non-pCR),因此术后还需要行进一步的食管癌根治性术后辅助放疗。
患者术后如果存在高危复发因素,将会影响后续的复发和生存,其中,Non-pCR是术后高危复发因素之一。有研究显示,Non-pCR患者局部及远处复发率均更高[10],[11];此外,Non-pCR患者的无病生存期(DFS)更短,5年OS率也更低3。因此,进一步优化新辅助治疗策略,以实现可切除的局部晚期食管癌患者pCR,将是未来新辅助免疫治疗的探索方向。
研究显示,食管癌术后辅助化疗带来的获益比较局限[12]。对于本例患者而言,由于术后存在淋巴结转移,可选择术后辅助放疗,有研究提示,术后辅助放疗可提高有淋巴结转移患者的生存率[13]。除了辅助放疗外,近年来也有临床研究探索了术后辅助免疫治疗对于未达到pCR食管癌的疗效。CheckMate-577研究显示,接受过新辅助同步放化疗及R0切除后未达pCR的食管癌或食管胃交界部癌患者,术后接受免疫治疗后中位DFS为22.4个月, 是安慰剂组 (中位DFS=11.0个月)的两倍[14]。因此,对于可切除的局部晚期食管癌患者,《食管癌放疗联合免疫治疗专家共识(2023年版)》推荐,对于接受过新辅助放化疗的局部晚期可切除食管癌患者, 如果未获得 pCR,术后可使用抗PD-1单抗免疫维持治疗, 治疗时间推荐为1年9。
前段时间,斯鲁利单抗正式获得中国国家药品监督管理局(NMPA)批准上市,用于联合化疗一线治疗局部晚期/转移性食管鳞癌(ESCASC)患者,这进一步提高了肿瘤免疫治疗的可及性。目前,免疫治疗已成为局部晚期/转移性食管鳞癌一线治疗的标准疗法。近年来,免疫治疗也在可切除局部晚期食管癌围术期展开了更多的临床研究,随着未来对优势人群的进一步划分,以及对新辅助免疫治疗疗效预测因子的探索,新辅助免疫治疗或可进一步提高患者的生存获益,从而有望改写食管癌新辅助治疗模式。
浙江省肿瘤医院胸部肿瘤外科
临床擅长:常见胸部恶性肿瘤(食管癌,肺癌,纵隔肿瘤)的诊治及手术。
科研工作:主持及参与国家自然科学基金及多项浙江省自然科学基金项目。并在中外核心期刊上发表数篇论文。
[1] 中国食管癌放射治疗指南(2022年版).国际肿瘤学杂志,2022,49(11) : 641-657.
[1] 中国医师协会放射肿瘤治疗医师分会,中华医学会放射肿瘤治疗学分会,中国抗癌协会肿瘤放射治疗专业委员会,中国食管鳞状细胞癌新辅助放射治疗专家共识.国际肿瘤学杂志,2023,50(03) : 129-137.
[1] van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med. 2012;366(22):2074-2084.
[1] Yang H, Liu H, Chen Y, et al. Neoadjuvant Chemoradiotherapy Followed by Surgery Versus Surgery Alone for Locally Advanced Squamous Cell Carcinoma of the Esophagus (NEOCRTEC5010): A Phase III Multicenter, Randomized, Open-Label Clinical Trial. J Clin Oncol. 2018;36(27):2796-2803.
[1] Liu J, Yang Y, Liu Z, et al. Multicenter, single-arm, phase II trial of camrelizumab and chemotherapy as neoadjuvant treatment for locally advanced esophageal squamous cell carcinoma [published correction appears in J Immunother Cancer. 2022 Jun;10(6):]. J Immunother Cancer. 2022;10(3):e004291.
[1] Liu Y, Bao Y, Yang X, et al. Efficacy and safety of neoadjuvant immunotherapy combined with chemoradiotherapy or chemotherapy in esophageal cancer: A systematic review and meta-analysis. Front Immunol. 2023;14:1117448.
[1] Ge F, Huo Z, Cai X, et al. Evaluation of Clinical and Safety Outcomes of Neoadjuvant Immunotherapy Combined With Chemotherapy for Patients With Resectable Esophageal Cancer: A Systematic Review and Meta-analysis. JAMA Netw Open. 2022;5(11):e2239778.
[1] Xu L, Wei XF, Li CJ, et al. Pathologic responses and surgical outcomes after neoadjuvant immunochemotherapy versus neoadjuvant chemoradiotherapy in patients with locally advanced esophageal squamous cell carcinoma. Front Immunol. 2022;13:1052542.
[1] 中国抗癌协会肿瘤放射治疗专业委员会,中华医学会放射肿瘤治疗学分会,中国医师协会放射肿瘤治疗医师分会.食管癌放疗联合免疫治疗专家共识(2023 年版)[J].中华放射医学与防护杂志,2023,43(8):575-587.
[1] Soror T, Kho G, Zhao KL, Ismail M, Badakhshi H. Impact of pathological complete response following neoadjuvant chemoradiotherapy in esophageal cancer. J Thorac Dis. 2018;10(7):4069-4076.
[1] Xi M, Hallemeier CL, Merrell KW, et al. Recurrence Risk Stratification After Preoperative Chemoradiation of Esophageal Adenocarcinoma. Ann Surg. 2018;268(2):289-295.
[1] Wu YH, Lin MQ, Wang ZP, Li JC. Clinical significance of risk stratification of esophageal squamous cell carcinoma after neoadjuvant chemoradiation and surgery. Transl Oncol. 2021;14(5):101037.
[1] Yu S, Zhang W, Ni W, et al. A propensity-score matching analysis comparing long-term survival of surgery alone and postoperative treatment for patients in node positive or stage III esophageal squamous cell carcinoma after R0 esophagectomy. Radiother Oncol. 2019;140:159-166.
[1] Kelly RJ, Ajani JA, Kuzdzal J, et al. Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer [published correction appears in N Engl J Med. 2023 Feb 16;388(7):672]. N Engl J Med. 2021;384(13):1191-1203.
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


