欧洲肿瘤内科学会乳腺癌年会(ESMO BC)是乳腺癌研究领域内极具影响力的国际会议。2024年ESMO BC 于5月15日至17日(CEST)在德国柏林会展中心举行。 在本次会议的口头报告中,共有3项LBA研究值得关注。【肿瘤资讯】特此整理,以飨读者。
中文标题:Denosumab 联合2种不同的白蛋白结合型紫杉醇方案作为原发性乳腺癌患者的新辅助治疗——GeparX 2 × 2随机临床试验的至事件时间分析
原标题:Denosumab Added to 2 Different nab-Paclitaxel Regimens as Neoadjuvant Therapy in Patients With Primary Breast Cancer - Time to Event analysis from the GeparX 2 × 2 Randomized Clinical Trial
讲者:Sibylle Loibl (Neu-Isenburg, Germany)
研究背景
GeparX(NCT02682693)研究了地舒单抗与蒽环类/紫杉醇类基础的新辅助化疗(NACT)以及两种不同的白蛋白紫杉醇(nabP)方案。每周nabP方案显示出更高的病理完全缓解(pCR)率,而添加Dmab则没有。
研究方法
患者(n=780)以2×2的方式随机分配,接受Dmab(120 mg皮下注射,每4周1次,共6个周期)或不接受,以及接受nabP(125 mg/m2)每周一次或每3周的第1天和第8天各一次,共12周。三阴性乳腺癌(TNBC)患者接受额外的卡铂化疗,HER2阳性乳腺癌患者接受曲妥珠单抗生物类似药ABP980 8个周期,与帕妥珠单抗至少4个周期的治疗。所有患者随后接受标准的表柔比星/环磷酰胺治疗4个周期。这里公布预先计划的对侵袭性疾病无病生存期(iDFS)、远处疾病无病生存期(DDFS)和总生存期(OS)的分析。
研究结果
在平均随访62.3个月后,接受Dmab或不接受的患者之间的iDFS没有显著差异(HR=0.87,95% CI 0.62–1.21;p=0.39),不同nabP方案之间的差异也不显著(HR=0.87,95% CI 0.62–1.21;p=0.41)。接受Dmab治疗的患者虽然数值上DDFS更长,但未达到统计学显著性,HR为0.77(CI 0.54, 1.1)p=0.16,预计5年DDFS为85.8%(接受Dmab)与80.2%(不接受Dmab)。
在pCR组的中,尽管使用Dmab治疗的患者似乎有更高的DDFS,但这一趋势并没有达到统计学上的显著性(HR 0.46,CI 0.21, 1.01,p=0.054)。在接受或不接受Dmab的患者之间,或不同nabP方案之间,未检测到OS的显著差异。总体而言,手术时未实现pCR与较差的结果相关,5年iDFS率分别为73.9%(无pCR)vs 87.8%(有pCR),DDFS分别为76.1% vs 91.6%,OS分别为86.2% vs 95.4%。未观察到预料外的长期毒性。
结论
这是首次报告了将Dmab添加到蒽环类/紫杉醇类基础的新辅助疗法的随机试验的长期结果。尽管Dmab治疗的患者远处复发的数量上较少,但这一差异并未达到统计学显著性。尽管每周nabP治疗观察到pCR的增加,但这并未转化为改善的长期结果。
中文标题:TROPION-Breast01研究的额外安全性分析:Datopotamab deruxtecan(Dato-DXd) vs 化疗用于既往经治、无法手术/转移性HR+/HER2-乳腺癌
原标题:Datopotamab deruxtecan (Dato-DXd) vs chemotherapy (CT) in pretreated, inoperable / metastatic HR+/HER2- breast cancer (BC): Additional safety analysis from TROPION-Breast01
讲者:Komal Jhaveri (New York, United States of America)
研究背景
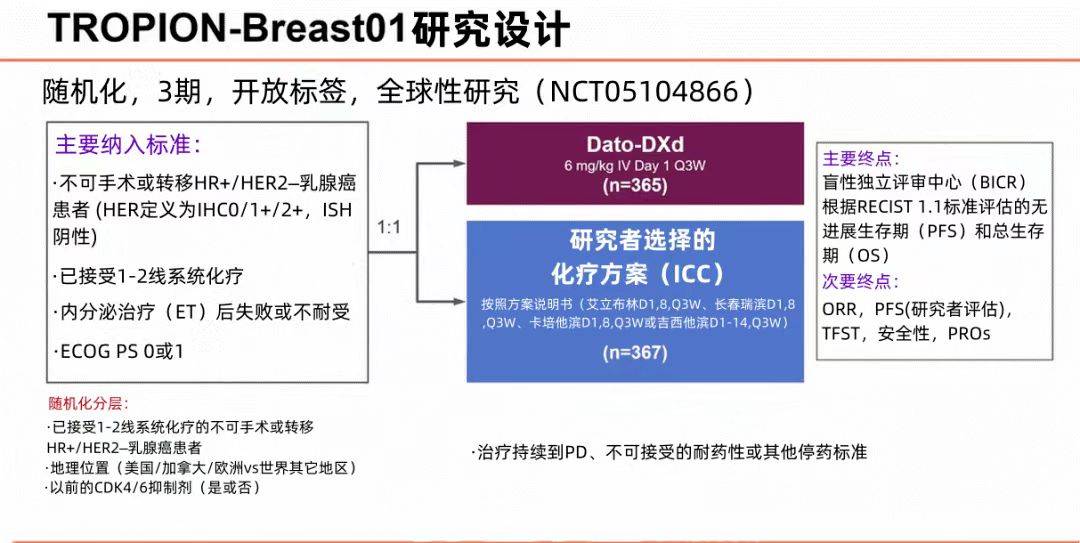
在 TROPION-Breast01(NCT05104866) 中,抗体偶联药物Dato-DXd与ICC相比,在HR+/HER2-乳腺癌患者中显示出更好的疗效,并且耐受性良好。在此本研究报告了额外的安全性分析。
研究方法
研究设计如前所述;安全性为次要终点。建议使用漱口水(如果可用,强烈推荐使用类固醇漱口水),并根据监管要求在筛选时和每三个21天周期进行眼科评估。
研究结果
在数据截止日期(2023年7月),360例患者接受了Dato-DXd,351例患者接受了ICC。
与ICC相比:
Dato-DXd的中位治疗时间更长(6.7 vs 4.1个月)。Dato-DXd的≥3级治疗相关不良事件(TRAEs)发生率较低 (21% vs 45%)。
Dato-DXd特别关注的不良事件(AESIs)包括口腔炎/口腔粘膜炎(OM;56%)、眼部事件(OE;40%)和判定的药物相关间质性肺病(ILD;3%)。
OE主要通过强制性眼部检查发现;超过50%是干眼症。
口腔炎/OM和OE大多数是低级别的(无症状/轻度,所有 Dato-DXd 患者中分别有25%和32%为1级);两者都可以通过毒性管理指南(TMGs)很好地管理,剂量中断(1%和3%)和停药(均为0.3%)的比率很低。
与Dato-DXd相关的判定药物相关ILD大多数是低级别的(无症状,1%的Dato-DXd患者为1级)。
相比之下,ICC的安全性特征中最值得注意的是高级别(≥3级)中性粒细胞减少症(31%),导致剂量中断(17%)/减少(13%)。
AESIs通常发生在最初的几个周期中:口腔炎/OM的中位发病时间为第2周期,OE为第3周期,ILD为第4周期。口腔炎/OM、OE、ILD的中位消退时间分别为37、67、28天。
研究结论
来自TROPION-Breast01的进一步数据显示,Dato-DXd的AESIs通常是低级别的,发生在最初的几个周期中,并且可以使用TMGs进行管理。此外,与ICC相比,Dato-DXd的≥3级TRAEs发生率不到一半,更少的TRAEs导致剂量中断/减少,表明Dato-DXd的耐受性优于ICC,并进一步强调了Dato-DXd作为临床实践中有利治疗选择的潜力。
中文标题:ipatasertib联合曲妥珠单抗和帕妥珠单抗 (HP) 双重抗HER2治疗PIK3CA突变HER2+晚期乳腺癌——来自Ib 期SOLTI-1507 IPATHER研究的主要结果
原标题:SOLTI-1507 IPATHER: Primary results of the phase Ib study of ipatasertib (IPAT) and dual anti-HER2 therapy with trastuzumab and pertuzumab (HP) in patients (pts) with PIK3CA mutant (mut) HER2+ advanced breast cancer (ABC)
讲者:Ana Mafalda Antunes De Melo e Oliveira (Barcelona, Spain)
研究背景
在 CLEOPATRA 试验中,HER2+ PIK3CAmut ABC 患者的无进展生存期 (PFS) 比 PIK3CAwt 患者短。 研究者提出了一种新的治疗策略,即 IPAT(对 PI3K/AKT 改变的肿瘤具有活性的 AKT 抑制剂)与 HP 联合治疗 PIK3CAmut HER2+ ABC 。
研究方法
IPATHER是一项开放标签、单臂、Ib期临床试验,旨在评估IPAT联合HP在PIK3CAmut HER2+ ABC患者中的安全性和疗效。研究对象为一线化疗后非因疾病进展而停药的患者。
主要目标:确定IPAT联合HP的最大耐受剂量(MTD),即在治疗的前28天内,前6名患者中不超过1名经历剂量限制性毒性(DLT)的最高剂量。(DLT:[G] ≥3 级腹泻 > 治疗前 28 天期间,72 小时,G ≥2 腹泻 >5 天 [d],其他治疗相关不良事件 [TRAE] G ≥ 3)。
剂量设定:初始 IPAT 剂量为 400mg d1-21,28 天周期,采用标准剂量 HP(递减剂量为 300mg 和 200mg)。
次要目标:评估安全性、客观反应率(ORR)、临床获益率(CBR)和无进展生存期(PFS)。
研究结果
患者入组:从 2020 年 2 月到 2023 年 11 月,共有 17 名患者入组,中位年龄 54 岁(41-78 岁)。 大多数人在诊断时患有 HR-肿瘤、内脏转移和 IV 期疾病(各 59%)。
PIK3CA突变:在108个HER2阳性肿瘤中,24个(22%)检测出PIK3CA突变。
治疗反应:截至2024年4月,6名患者(35%)仍在接受治疗。在前6名患者中未观察到DLT,因此确认IPAT 400mg + HP为MTD。在其余11名患者中,3名患者出现DLT。
不良事件:最常见的治疗相关不良事件(TRAEs)包括腹泻(82%)、恶心(47%)、食欲下降(35%),以及疲劳、皮疹和呕吐(各占29%)。3/4级TRAEs发生在35%的患者中,以腹泻和恶心最为常见(各占12%)。
疗效数据:中位随访19.9个月时,确认的ORR为31%,CBR为69%,中位PFS为15.4个月(9.4-NR),其中 48% 的患者在入组后 18个月后无进展。
研究结论
IPATHER研究的初步结果显示,IPAT 400mg联合HP作为维持治疗方案,在PIK3CAmut HER2+ ABC患者中具有可接受的安全性,并显示出有希望的疗效。这一发现支持了在HER2阳性ABC患者中进一步探索PI3K/AKT通路抑制剂与抗HER2治疗结合的潜力。
[1] Sibylle Loibl. Denosumab added to 2 different nab-paclitaxel regimens as neoadjuvant therapy in patients with primary breast cancer: Time to event analysis from the GeparX 2 × 2 randomized clinical trial. 2024 ESMO BC,LBA1.
[2] Komal Jhaveri, et al. Datopotamab deruxtecan (Dato-DXd) vs chemotherapy (CT) in pretreated, inoperable / metastatic HR+/HER2- breast cancer (BC): Additional safety analysis from TROPION-Breast01. 2023 ESMO BC abstract LBA2.
[3] Ana Mafalda Antunes De Melo e Oliveira, et al. SOLTI-1507 IPATHER: Primary results of the phase Ib study of ipatasertib (IPAT) and dual anti-HER2 therapy with trastuzumab and pertuzumab (HP) in patients (pts) with PIK3CA mutant (mut) HER2+ advanced breast cancer (ABC). 2023 ESMO BC abstract LBA3.
排版编辑:肿瘤资讯-张薪媛











 苏公网安备32059002004080号
苏公网安备32059002004080号


