
前言
4月26-27日,2024中国临床肿瘤学会(CSCO)指南会于济南顺利召开。此次大会报道了包括非小细胞肺癌(NSCLC)在内的多个瘤种最新指南的更新要点。表皮生长因子受体(EGFR)是NSCLC临床最为常见的治疗靶点,此次最新发布的《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2024》(下称《CSCO NSCLC指南2024》)中对于EGFR阳性晚期NSCLC的治疗推荐做出了哪些更新?本文特邀同济大学附属东方医院周彩存教授对此进行分析、解读。
针对EGFR敏感突变晚期NSCLC一线治疗
新版指南推荐、提及多种TKI联合治疗方案
EGFR是NSCLC临床诊疗领域最先发现的治疗靶点,2009年IPASS研究的出现开启了NSCLC靶向治疗的大门 [1]。随着抗肿瘤药物研发的不断进展,EGFR阳性NSCLC患者临床治疗选择愈发丰富。作为指导国内肿瘤医生临床实践的重要参考依据,CSCO指南的推荐与更新会根据药物临床循证证据、可及性以及适应证获批情况等多方面因素进行综合考量,从而给予不同等级推荐,以满足不同层次患者的临床治疗需求,周彩存教授表示。
表1 CSCO诊疗指南推荐等级

针对EGFR敏感突变NSCLC精准靶向治疗,相关酪氨酸激酶抑制剂(TKI)类药物当下已呈现出“三代同堂”的局面,针对EGFR敏感突变晚期NSCLC一线治疗此前已有8款EGFR-TKI获得指南Ⅰ级推荐,此次《CSCO NSCLC指南2024》基于IBIO-103研究的最新数据,新增了三代EGFR-TKI贝福替尼 [1]。
周彩存教授指出,相较于传统化疗,TKI单药靶向治疗显著提升了EGFR敏感突变晚期NSCLC患者生存获益,患者一线接受三代EGFR-TKI治疗可获得约20个月左右的无进展生存期(PFS),但这并未能帮助患者获得“临床治愈”,患者仍有诸多未被满足的治疗需求 [1]。
为进一步提升患者临床获益,TKI联合治疗成为了近些年备受临床关注的焦点。FLAURA2研究证明,相比于奥希替尼单药,奥希替尼联合化疗能显著延长患者的PFS(29.4个月 vs 19.9个月,HR 0.62,P=0.0002),针对基线伴有脑转移(24.9个月 vs 13.8个月,HR 0.47,95%CI:0.33-0.66)以及中国(27.4个月 vs 22.3个月,HR 0.56,95%CI:0.34-0.92)患者,奥希替尼联合化疗同样可显著提升该患者人群PFS [2,3]。
目前,奥希替尼联合化疗已被美国食品药品监督管理局(FDA)批准用于EGFR敏感突变晚期NSCLC一线治疗,但考虑到中国国家药品监督管理局(NMPA)当下尚未在国内批准该适应证,此次《CSCO NSCLC指南2024》将其列为了Ⅱ级推荐 [1]。
表2 《CSCO NSCLC指南2024》针对EGFR敏感突变晚期NSCLC一线治疗相关推荐

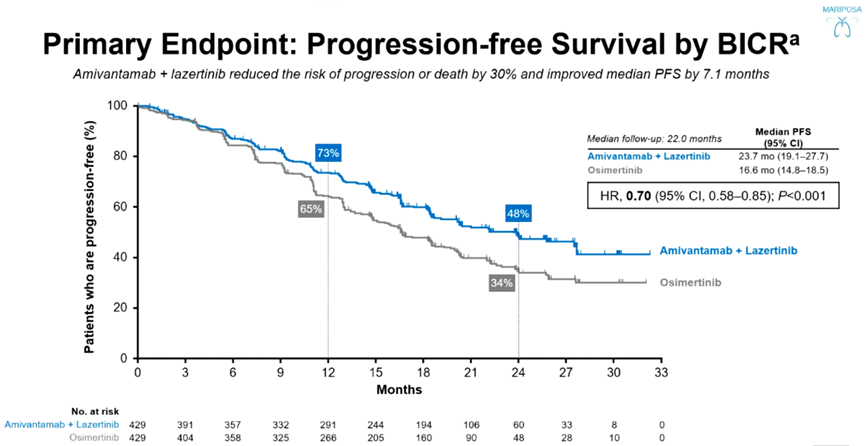
与FLAURA2研究不同的是,MARIPOSA研究探索了另一种TKI联合治疗方案(Amivantamab联合Lazertinib)在EGFR敏感突变晚期NSCLC一线治疗中的疗效及安全性。2023 欧洲肿瘤内科学会(ESMO)大会报道的MARIPOSA研究中期分析结果显示,相比于奥希替尼单药,Amivantamab联合Lazertinib用于EGFR敏感突变NSCLC患者一线治疗可有效延长其中位PFS(23.7个月 vs 16.6个月,HR 0.70,95%CI:0.58-0.85,P<0.001),且无论患者是否伴有脑转移,其PFS均可得到显著提升 [4]。
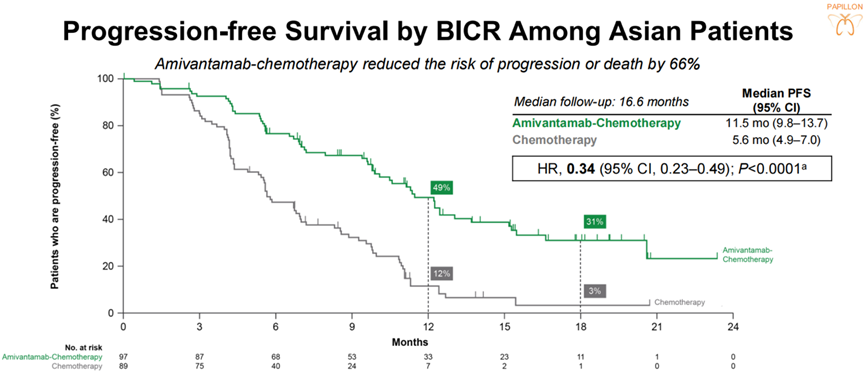
图1,2 MARIPOSA研究中全体人群与亚洲人群PFS数据(左右滑动)
随后在2023 欧洲肿瘤内科学会亚洲(ESMO Asia)大会中报道的MARIPOSA研究亚组分析数据进一步提示,该方案可为亚州患者人群带来与整体人群一致的PFS获益(27.5个月 vs 18.3个月,HR 0.65,95%CI:0.50-0.83,P<0.001) [5]。前不久刚刚结束的2024 欧洲肺癌大会(ELCC)中,研究者汇报了MARIPOSA研究的探索性分析结果,提示对于接受Amivantamab联合Lazertinib 治疗超过4个月的患者,无论患者治疗前4个月是否因不良反应(AE)出现治疗中断,患者PFS、ORR及缓解持续时间(DoR)均不会受到明显负面影响 [6]。
表3 MARIPOSA研究中治疗前4个月出现与未出现治疗中断患者以及所有患者的疗效数据

周彩存教授强调,与奥希替尼单药相比,Amivantamab联合Lazertinib可使患者PFS延长半年以上,达7.1个月,为患者生存获益带来了极大的改善。不仅如此,由于MARIPOSA研究非常重视对患者颅内病灶的控制情况,所有患者均要求进行持续的高频次定期MRI检查,这更加精确的展现出Amivantamab联合Lazertinib为患者所带来的生存获益 [4-6]。稍显遗憾的是,目前该方案国内外尚未获批相关适应证,此次《CSCO NSCLC指南2024》亦仅在文本描述部分对该研究进行了介绍与说明,但相信随着未来相关适应证的获批,《CSCO指南》对其的推荐也必然会有所提升 [1]。
针对EGFR敏感突变晚期NSCLC耐药后治疗
多款新型药物展现出极具前景的临床应用潜力
TKI靶向治疗虽然极大的改善了EGFR敏感突变晚期NSCLC患者生存获益,但所有患者均需要面对TKI耐药的难题,这也成为了阻碍患者生存获益进一步得到提升的桎梏。对于一、二代TKI耐药且再次活检呈T790M阳性的患者,三代TKI是其后续首选治疗方案,此次《CSCO NSCLC指南2024》基于IBIO-102研究,将贝福替尼新增为该类患者的Ⅰ级推荐方案 [1]。但相比于此,针对再次活检呈T790M阴性或者三代TKI耐药的患者,后续治疗方案该如何制定更为业内学者所关注。
表4 《CSCO NSCLC指南2024》针对EGFR敏感突变晚期NSCLC耐药后治疗相关推荐

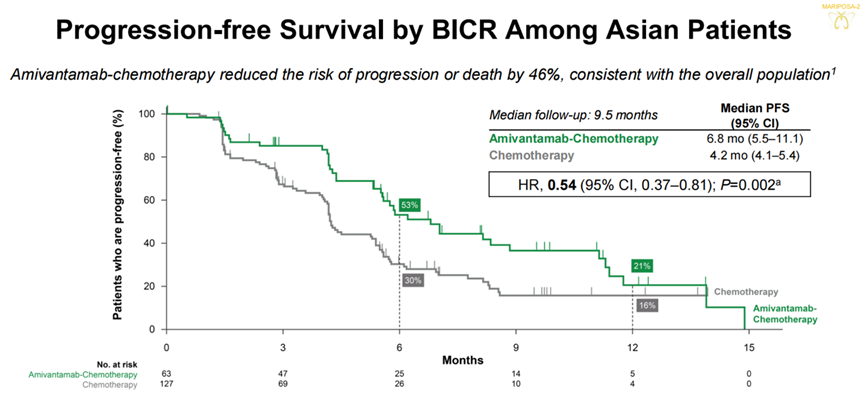
MARIPOSA-2研究评估了Amivantamab联合化疗与Lazertinib、Amivantamab联合化疗对比单纯化疗治疗奥希替尼耐药EGFR阳性NSCLC的疗效与安全性。2023 ESMO大会中报道的MARIPOSA-2研究中期分析结果显示,与单纯化疗相比,Amivantamab联合化疗与Lazertinib或Amivantamab联合化疗均可显著改善患者PFS,三组患者中位PFS分别为8.3个月、6.3个月以及4.2个月 [7]。在随后的2023 ESMO Asia大会中,研究者所公布的MARIPOSA-2研究亚洲人群数据提示,针对亚洲患者Amivantamab联合化疗的治疗方案可为其带来与整体患者一致的临床获益(PFS:6.8个月 vs 4.2个月,HR 0.54,95%CI:0.37-0.81,P=0.002) [8]。
图3,4 MARIPOSA研究中全体人群与亚洲人群PFS数据(左右滑动)
不仅如此,2024 ELCC进一步报道了MARIPOSA-2研究疾病进展患者结局,在疾病出现进展的患者中,Amivantamab联合化疗较单纯化疗可显著延长患者至停止治疗时间(TTD,11.0 vs 4.5个月;HR:0.37,95% CI 0.28-0.50;P<0.0001)、至后续治疗时间(TTST,12.1 vs 6.6个月;HR:0.42,95% CI 0.30-0.59;P<0.0001)和无二次进展生存期(PFS2,13.9 vs 11.3个月;HR:0.60,95% CI 0.40-0.92;P=0.017),且患者至症状恶化时间(TTSP,14.9个月vs 13.0个月;HR=0.74;95%CI:0.51-1.07;P=0.10)也得到一定延长,总体健康状况得到改善或稳定 [9,10]。
表5 MARIPOSA-2研究中患者TTD、TTST、PFS2以及TTSP数据

周彩存教授介绍道,化疗仍是目前临床针对EGFR敏感突变晚期NSCLC三代TKI耐药患者的标准治疗方案,虽然目前针对TKI耐药患者是否需要再次进行基因检测存在一定争议,但仍推荐临床医生为TKI耐药患者进行检测以了解患者耐药机制,从而给予其更为精准的后续治疗 [1]。MARIPOSA-2研究证实,相比于单纯化疗,Amivantamab联合化疗可显著提升患者PFS,对于出现疾病进展的患者其TTD、TTST以及PFS2均得到显著延长,患者生存获益得到了多方面的综合提升。
除MARIPOSA-2研究外,一项Ⅰ期临床研究显示,BL-B01D1(一款EGFRxHER3-ADC)在EGFR-TKI耐药患者中同样展现出了极具前景的数据结果 [1]。目前,多项针对EGFR敏感突变晚期NSCLC耐药后治疗新方案得到了《CSCO NSCLC指南2024》的新增介绍,相信未来随着相关适应证的获批,Amivantamab联合化疗等方案将有望颠覆临床现有治疗格局,成为针对EGFR敏感突变晚期NSCLC TKI耐药患者的新标准治疗方案。
针对EGFR ex20ins突变晚期NSCLC一线治疗
Amivantamab联合化疗成为指南唯一新增推荐
EGFR 第20号外显子插入(ex20ins)突变是EGFR罕见突变中最常见突变类型,因其空间构型特殊,异质性强,患者对传统EGFR-TKI类药物往往不敏感,临床预后通常较差 [11]。针对此类患者,此前莫博赛替尼展现出了极具潜力的抗肿瘤活性,《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2023》亦将其列为了EGFR ex20ins突变NSCLC后线治疗的Ⅰ级推荐方案 [12]。但随着EXCLAIM-2研究的失败,FDA已撤销了莫博赛替尼相关适应证,《CSCO NSCLC指南2024》中也相应地移除了莫博赛替尼相关推荐,而舒沃替尼则凭借其在WU-KONG6研究中所展现出的令人鼓舞的疗效数据,成为了指南中针对EGFR ex20ins突变NSCLC后线治疗新的Ⅰ级推荐方案 [1]。
表6 《CSCO NSCLC指南2024》针对EGFR ex20ins突变晚期NSCLC临床治疗相关推荐
此外,值得一提的是,目前Amivantamab同样持续展现着值得临床医生期待的疗效数据。Amivantamab作为抗体类药物其抗肿瘤作用机制与TKI类药物有所不同,可通过阻断配受体结合、诱导受体降解和介导ADCC杀伤等三重机制发挥抗肿瘤作用 [13]。此前,PAPILLON研究评估了Amivantamab联合化疗在EGFR ex20ins晚期NSCLC一线治疗中的疗效与安全性。2023 EMSO公布的PAPILLON研究初步分析数据显示,相比于单纯化疗,Amivantamab联合化疗显著延长了患者PFS(11.4个月 vs. 6.7个月;HR=0.395,95%CI 0.30-0.53;P<0.0001) [14]。2023 ESMO Asia报道的亚组分析显示,亚洲患者接受Amivantamab联合化疗治疗同样可获得与整体人群相似的临床获益 [15]。
图5,6 PAPILLON研究中全体人群与亚洲人群PFS数据(左右滑动)
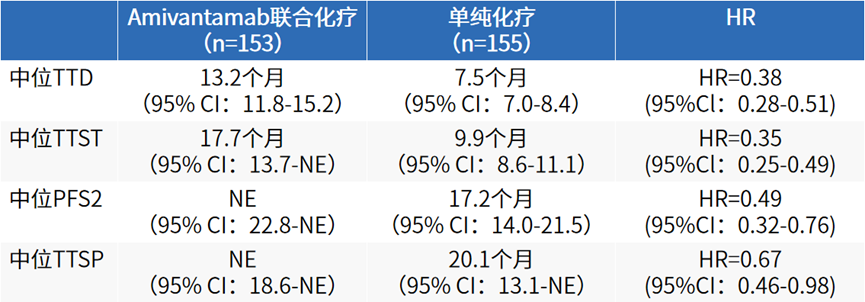
与MARIPOSA-2研究类似,2024 ELCC报道的PAPILLON研究疾病进展患者结局同样显示,采用Amivantamab联合化疗方案进行一线治疗出现疾病进展的患者,其TTD(13.2个月 vs 7.5个月,HR 0.38,95%CI:0.28-0.51,P<0.0001)、TTST(17.7个月 vs 9.9个月,HR 0.35,95%CI:0.25-0.49,P<0.0001)以及PFS2(NE vs 17.2个月,HR 0.49,95%CI,0.32-0.76,P=0.001)均得到显著延长,整体患者TTSP(NE vs 20.1个月,HR 0.67,95%CI:0.46-0.98,P=0.04)以及总体健康状况亦得到明显改善 [16,17]。
表7 PAPILLON研究患者TTD、TTST、PFS2以及TTSP数据
PAPILLON研究证实Amivantamab联合化疗用于EGFR ex20ins晚期NSCLC一线治疗不仅可显著提升患者PFS,出现疾病进展的患者其TTD、TTST、PFS2亦得到明显提升,患者甚至有望可凭此方案获得OS提升,这提示Amivantamab联合化疗更应该被积极地用于患者一线治疗,周彩存教授说道,虽然国内目前尚未批准Amivantamab联合化疗用于EGFR ex20ins晚期NSCLC一线治疗,但FDA已正式批准相关适应证,基于此,《CSCO NSCLC指南2024》中仍将其列为Ⅲ级推荐方案,成为了此次指南中针对EGFR ex20ins突变NSCLC一线治疗唯一新增用药方案,这不仅满足了部分患者的临床诊疗需求,亦体现了CSCO指南的先进性 [1]。
总 结
近年来,针对EGFR阳性NSCLC的靶向治疗药物层出不穷,临床研究更是呈现出井喷式的爆发,《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2024》在结合最新临床循证证据的基础上,充分考虑不同治疗方案的可及性以及不同患者的临床治疗需求,提供了全面而具有针对性的治疗推荐,帮助医生在临床实践过程中可以在更加规范化的前提下为患者提供更为精准的个体化诊疗。
- 周彩存 教授 -
· 同济大学附属东方医院肿瘤科主任,教授,主任医师,博士生导师
· 中国临床肿瘤学会执行委员
· 中国医促会胸部肿瘤分会主任委员
· 国际肺癌研究学会候任主席
· 中国临床肿瘤学会非小细胞专委会主任委员
· 中国抗癌协会肺癌专业委员会常委
· 上海市抗癌协会副理事长
· 上海市抗癌协会肺癌分子靶向和免疫治疗专委会主任委员
· 中国抗癌协会肿瘤药物临床研究专业委员会主任委员
· 中国医师协会肿瘤分会常委
· 上海市医师协会肿瘤分会副会长
· 上海市医学会肿瘤分会副主任委员
· 同济大学医学院肿瘤研究所所长
· 上海市领军人才
本资料为杨森公司所有,仅供医学药学专业人士参考,未经批准,严禁翻印、转载及传播。
本资料仅用于医学、科学交流,可能涉及尚未在中国获批的产品和适应症。杨森公司不支持、不鼓励任何未被批准的药品/适应症使用。















 苏公网安备32059002004080号
苏公网安备32059002004080号


