老年女性患者,既往“腔隙性脑梗、高血压、新冠肺炎、子宫肌瘤”等病史,诊断“晚期肺腺癌伴肝转移”,PS评分1分,驱动基因突变阴性,PD-L1 TPS=10%,MSI-H,TMB-H。患者拒绝化疗,一线使用“卡度尼利单抗+安罗替尼”治疗,2个月即达PR,持续缩瘤超过70%,CEA下降至正常水平并维持,目前PFS已达12个月,未见严重免疫相关不良反应。
病例分享专家

中国医药教育协会盆腔肿瘤专业委员会 秘书长
中国肿瘤驱动基因分析联盟(CAGC)执委会 常委
上海市社会医疗机构协会肿瘤学分会 常委
中国医药生物技术协会精准医疗分会委员 常委
国家肿瘤微创治疗产业技术创新战略联盟聚焦超声专业委员会 委员
中国研究型医院学会分子诊断医学专业委员会 委员
上海市抗癌协会肿瘤免疫治疗专业委员会 委员
上海市医学会肿瘤第十届委员会 青年委员
中国抗癌协会肿瘤超声治疗专业委员会 委员
上海市科研基金与科技奖励评审专家
病史回顾
【患者】女,71岁
【主诉】以“确诊肺恶性肿瘤近2年”为主诉入院。
【病例特点】患者2021年05月体检发现右肺上叶肿块,未进一步诊断治疗。2022年02月11日于外院行PET-CT检查,示“右肺上叶尖段MT可能;右侧肺门、纵膈淋巴结转移可能;右侧颈部及锁骨区淋巴结炎可能;右侧枕叶部糖代谢增高灶”;2022年03月行肺病灶穿刺活检病理:见恶性细胞,倾向非小细胞癌;基因检测:驱动基因阴性。未行手术、放化疗等治疗,接受中药治疗。2023年01月15日因“感染新冠肺炎”就诊同济大学附属第十人民医院,感染控制后于2023年02月21日入院拟行抗肿瘤治疗。既往“腔隙性脑梗”病史5年,“高血压、子宫肌瘤”病史多年(具体不详)。PS评分1分,NRS评分0分。
【辅助检查】
(2022.02.11)PET-CT:右肺上叶尖段MT可能;右侧肺门、纵膈淋巴结转移可能;右侧颈部及锁骨区淋巴结炎可能;右侧枕叶部糖代谢增高灶。
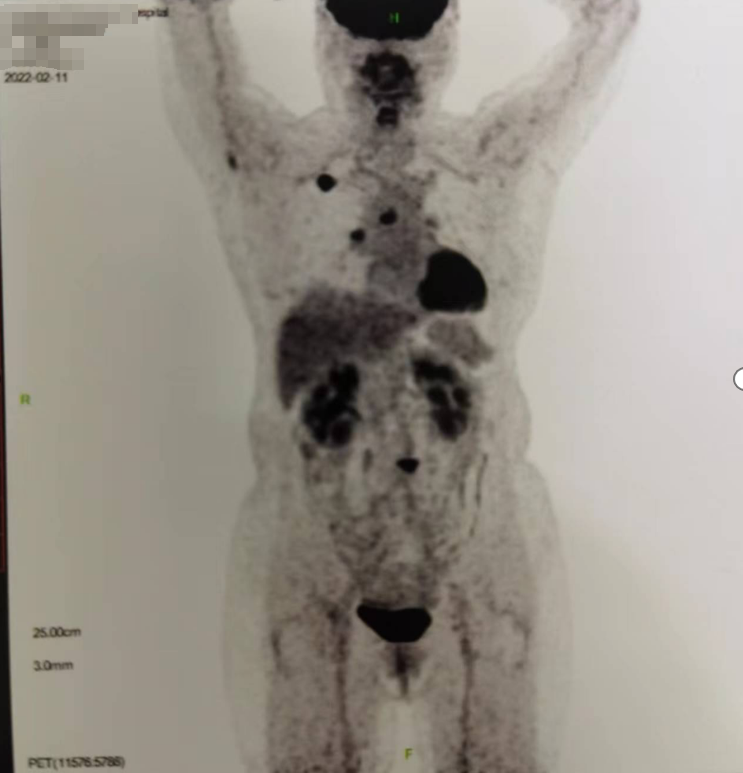
(2022.03)肺病灶穿刺活检病理:见恶性细胞,倾向非小细胞癌。
基因检测:驱动基因阴性。
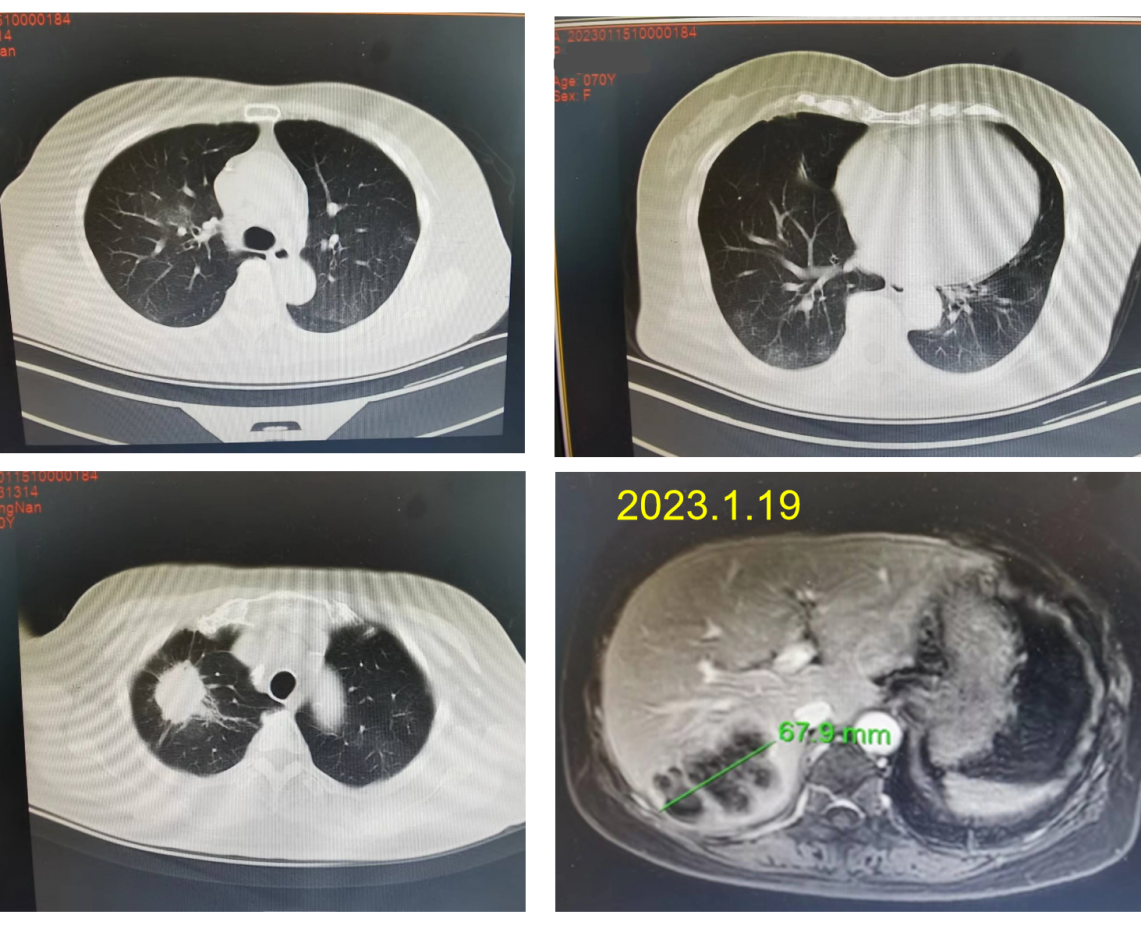
(2023.01.15)肺部CT:右肺上叶尖段占位,考虑恶性肿瘤,两肺门及纵膈内淋巴结肿大;两肺多发磨玻璃影,考虑炎性病变。
(2023.01.19)上腹部MR+:肝右叶转移。
(2023.02.21)血常规:RBC 9.26×10^12/L,WBC 6.88×10^9/L,PLT 245×10^9/L,Hb 104 g/L;
心肝肾功能:TNI 0.041 ng/mL, ALT 46.6 U/L,AST 39.7 U/L,BUN 4.4 mmol/L,Scr 42 umol/L;LDH 998 U/L;
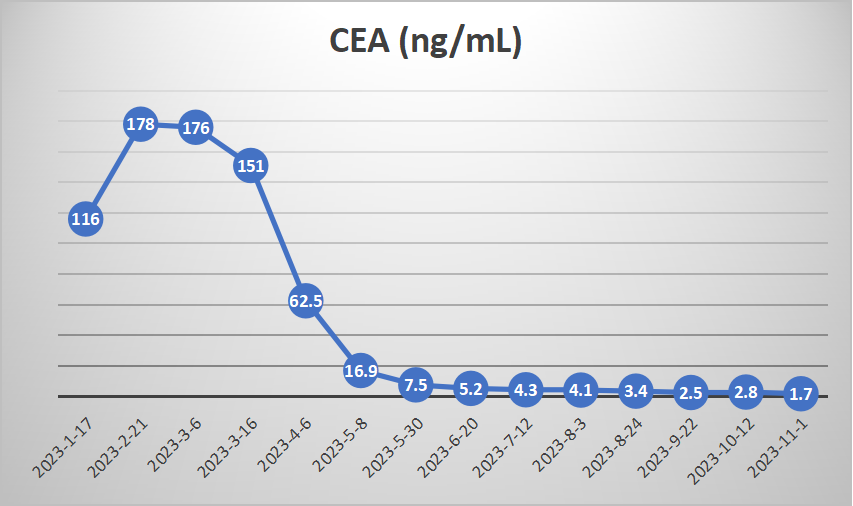
肿瘤标志物:CEA 178 ng/ml,CA153 115 U/mL, CA199 34.9 U/mL, NSE 135 ng/mL, CYFRA21-1 75.3 ng/mL , ProGRP 0.49 ng/mL。
(2023.2.22)肺CT:右肺上叶尖段占位,考虑恶性肿瘤,较前片2023.1.15增大,两肺门及纵膈内淋巴结肿大。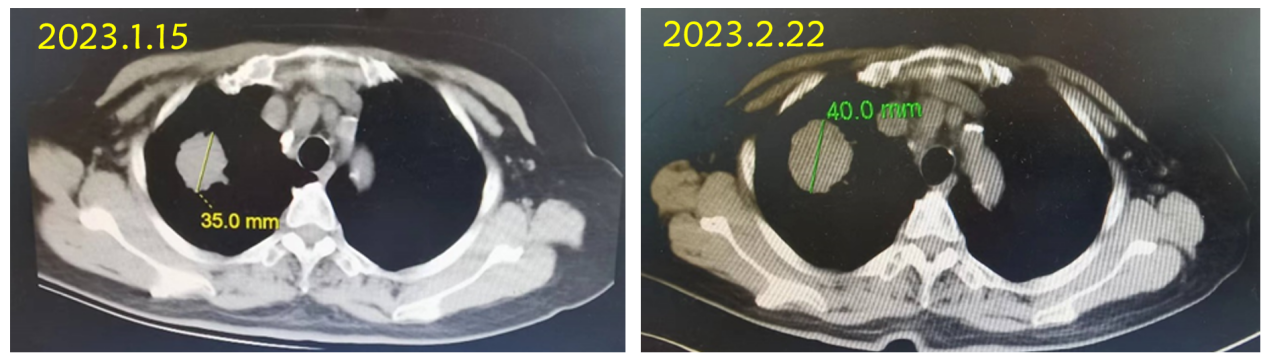
(2023.3)肝病灶穿刺活检,病理:腺癌,结合病史及免疫组化结果符合肺来源。
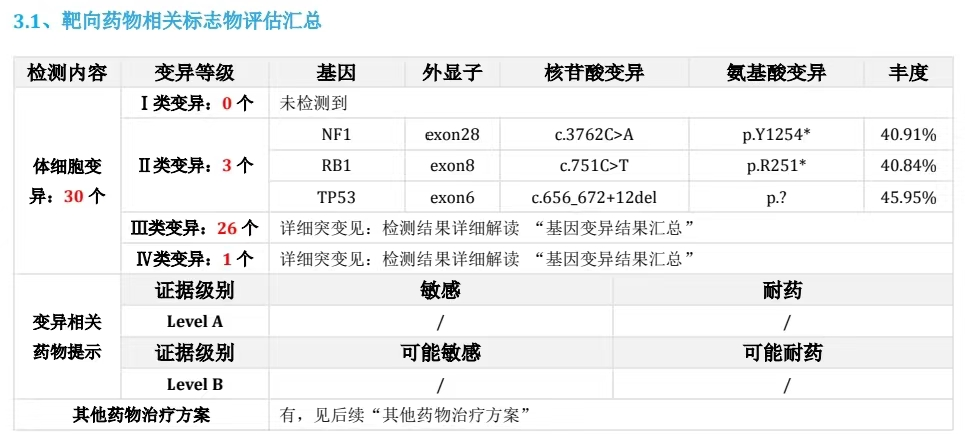
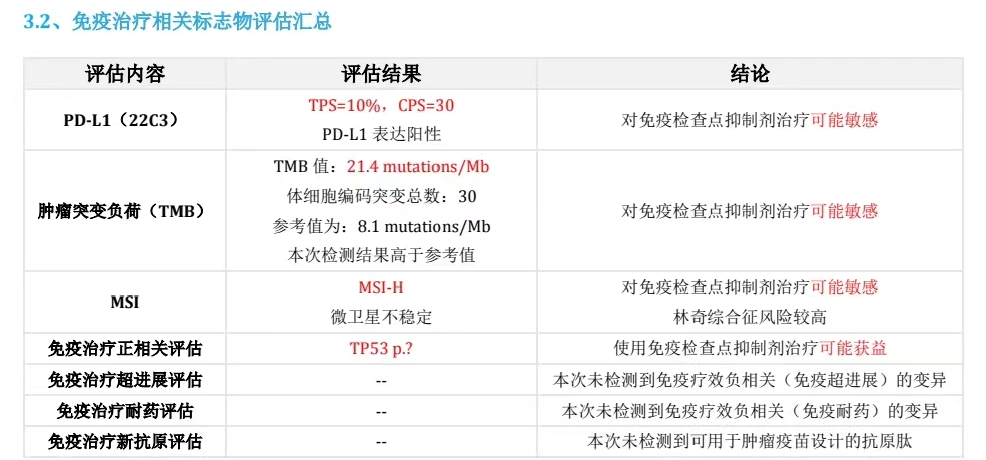
肝转移组织NGS检测:驱动基因阴性;MSI-H;TMB-H;PD-L1 TPS=10%,CPS=30%。
诊断
1、晚期肺腺癌伴肝转移
治疗
【一线治疗】
患者强烈拒绝化疗;EGFR、ALK等靶点均为野生型,无对应靶向药物可选;肿瘤突变负荷高,微卫星不稳定,免疫治疗可能获益;但PD-L1低表达,单免预期疗效欠佳。
故经充分沟通后,于2023年02月24日起,予“卡度尼利单抗+抗血管”方案治疗,具体为:卡度尼利单抗500mg d1+安罗替尼12mg(后因“Ⅱ级高血压”减量为10mg)d1-14 q3w。
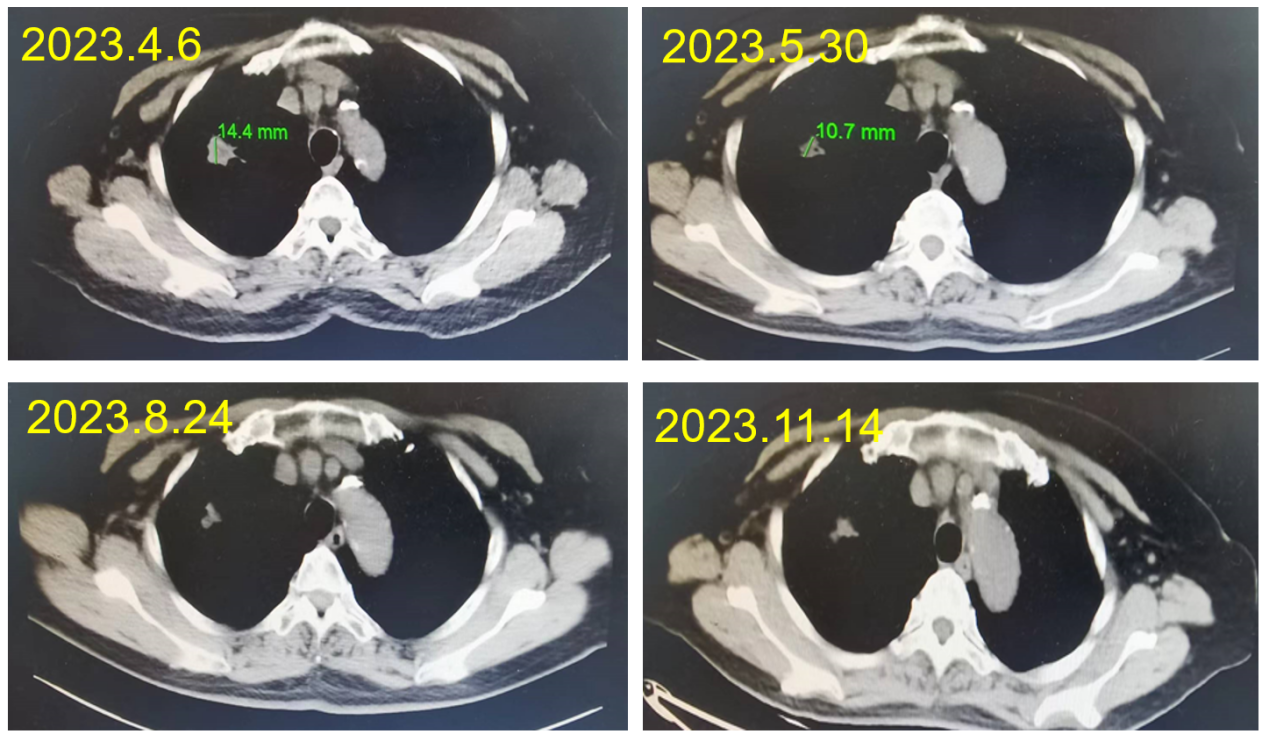
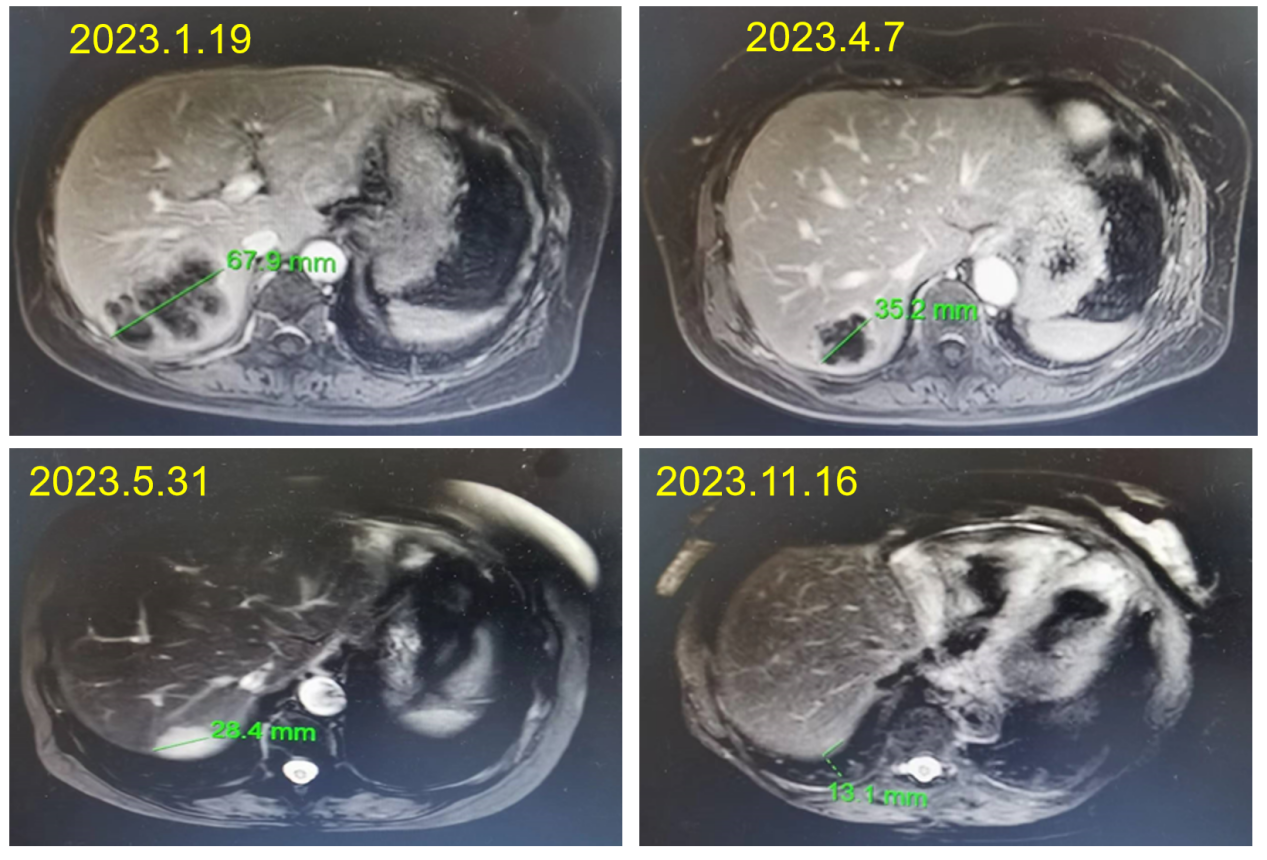
治疗2个月后,肺部病灶长径由40mm缩小至14.4mm,肝转移灶长径由67.9mm缩小至35.2mm,疗效评价为PR。
治疗3个月后,肺部病灶及肝转移灶持续缩小,疗效评价为PR。
CEA持续降低并维持于正常水平。截至目前PFS已达12个月,未见严重免疫相关不良反应。
病例专家点评

医促会胸部肿瘤分会委员
中国肿瘤医师协会青委会委员
中国临床肿瘤学会血管靶向治疗专家委员会委员
中国临床肿瘤学会肿瘤生物标志物专家委员会委员
中华医学会结核相关疾病专业委员会常务委员
上海市抗癌协会肿瘤分子靶向专业委员
上海市医学会肿瘤专科分会胸部肿瘤学组专业委员
病例点评
这是一例成功的晚期肺腺癌双抗免疫治疗案例。一位PD-L1低表达、TMB-H、MSI-H的晚期肺腺癌患者,一线使用“卡度尼利单抗+抗血管”方案治疗,2个月达PR,后持续缩瘤超过70%,PFS已达12个月。为我们带来了关于双抗免疫治疗,尤其是相关生物标志物的思考和启示。
PD-L1、TMB、MSI等都是当前常用的肿瘤免疫治疗相关生物标记物。PD-L1目前应用最为广泛,对于阴性或低表达人群往往需选用联合方案以加强肿瘤的免疫应答。研究显示,高TMB的NSCLC患者具有更长的PFS;肿瘤的TMB越高,肿瘤免疫原性越高,更可能导致T细胞的激活。肺癌中MSI-H与其他实体瘤相比较为罕见,且对化疗的获益也相对有限[1]。
所以,在免疫治疗及其联用方案的选择上,如何精准筛选获益人群、提高疗效、减少不良反应发生率,是临床上关注的重点。
卡度尼利单抗可同时靶向PD-1和CTLA-4,具有PD-1单抗和CTLA-4单抗联合疗法的协同疗效,且通过对Fc段的改构减少了不良反应的发生率[2]。在AK104-208研究中,卡度尼利10mg/kg联合安罗替尼一线治疗晚期NSCLC的ORR达到60%[3],是“去化疗”的优选方案。卡度尼利单抗联合化疗在PD-L1阴性NSCLC人群的Ⅲ期临床研究亦正在入组中,对于单免预期获益不佳的患者,双抗为免疫治疗带来了更多选择。
此病例依据各类免疫治疗相关生物标志物的辅助诊断,选用双特异性抗体联合抗血管治疗达到了良好的疗效,显著延长了患者的生存期,未见严重免疫相关不良反应,提高了患者的生活质量。可见,卡度尼利单抗的疗效及安全性均得到了初步证实。双特异性抗体在临床上展现出了不俗的潜力,肺癌免疫治疗的新时代已经开启。
1.McKean W B,Moser J C, Rimm D, et al. Biomarkers in Precision Cancer Immunotherapy: Promiseand Challenges[J]. American Society of Clinical Oncology Educational Book,2020, 40: e275-e291.
2.Pang X, et al. Cadonilimab, a tetravalent PD-1/CTLA-4 bispecific antibody with trans-binding and enhanced target binding avidity. MAbs. 2023;15(1):2180794.
3.Br J Cancer. 2023 Dec 18
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


