通过对2024.03.01-2024.03.31期间发表的前列腺癌领域最新文献进行检索和梳理,本期“前列腺癌新文连播”主要介绍了前列腺癌以ADT为基础的联合治疗的最新进展;同时介绍了ADT不良反应管理的随机对照研究。接下来,让我们一起来了解这些最新文献吧!
针对寡复发转移性前列腺癌的全身和靶向疗法(SATURN):2期临床试验的主要终点结果
Systemic and Tumor-directed Therapy for Oligorecurrent Metastatic Prostate Cancer (SATURN): Primary Endpoint Results from a Phase 2 Clinical Trial
PMID: 38494380 【European Urology, IF=23.4; JCR: Q1】
摘要
几乎所有接受间歇性雄激素剥夺疗法(ADT)治疗的转移性激素敏感性前列腺癌患者都会在睾酮恢复后6个月内发生复发。对此开展了一项单臂2期试验,以评估在间歇性ADT的基础上添加双雄激素受体通路抑制剂(ARPIs)和转移灶定向立体定向体放射治疗(SBRT)是否能提高既往根治性前列腺切除术后前列腺特异性膜抗原正电子发射断层扫描/计算机断层扫描(PSMA PET/CT)显示有1到5个非内脏、盆腔外转移灶的男性患者的复发率。患者接受6个月的雄激素歼灭治疗(AAT:亮丙瑞林、醋酸阿比特龙加泼尼松和阿帕他胺)和转移灶定向SBRT治疗。主要终点是睾酮恢复(≥150 ng/dL)6个月后前列腺特异性抗原(PSA)<0.05 ng/ml的患者比例,该研究的效力为1%至12%的改善。在2021年3月至2022年6月期间招募了28名符合入组标准的患者。中位随访时间为20个月(四分位数间距为16-22个月)。26名患者(93%)完成了SBRT并接受了6个月的激素治疗,其中6名患者中止了至少一个雄激素受体通路抑制剂(ARPI);2名患者提前退出。睾酮恢复后6个月时,13/26例患者(50%,95% Cl: 32-67%)的PSA<0.05 ng/ml。2级和3级AAT毒性发生率均为31%。研究结果证实,在强效全身治疗的基础上加用转移灶定向SBRT可以在睾酮恢复后维持低PSA,但仍需进一步研究以明确最佳的全身治疗方案。患者摘要:研究测试了针对转移性前列腺癌复发男性患者的强化激素疗法(称为雄激素歼灭疗法)和针对转移灶的放疗组合。结果发现,半数患者在睾酮水平恢复6个月后不再复发,只有不到四分之一的患者出现了严重的药物相关副作用。总体看来,这是一种副作用可以接受的有效疗法。该试验在ClinicalTrials.gov 上的注册号为NCT03902951。
中危前列腺癌患者接受剂量递增联合同步加量放疗对短期雄激素剥夺疗法(ADT)的影响
The effect of dose-escalation radiotherapy with simultaneous-integrated-boost on the use of short-term androgen deprivation therapy in patients with intermediate risk prostate cancer
PMID: 38528236 【Prostate,IF=2.8, JCR: Q3】
目的
比较中危前列腺癌(IR-PC)患者接受不同治疗方案的的生化失败率(FFBF)和前列腺癌特异性生存率(PCSS):接受雄激素剥夺疗法(ADT)治疗6个月联合78 Gy前列腺放疗的患者、接受ADT治疗并使用同步加量(SIB)调强技术对前列腺内病灶(IPL)进行86 Gy病灶增强(FB)治疗的患者,以及仅接受SIB治疗的患者。
材料与方法
对2012年1月至2021年4月期间接受治疗的320例中危前列腺癌患者进行了回顾性分析。根据治疗方案将患者分为三组:78 Gy+ADT(109例患者,34.1%)、78/86(102例患者,31.8%)和78/86+ADT。采用单变量和多变量分析确定FFBF和PCSS的预后因素。
结果
中位随访时间为8.8年。8年的FFBF和PCSS率分别为88.6%和99.0%。接受ADT治疗的患者治疗前的PSA水平和临床肿瘤分期明显更高。45名患者(7.3%)在根治性放疗(RT)后中位41.9个月出现疾病进展。在多变量分析中,年龄较小、穿刺核心活检阳性率(PCB)≥50%以及未使用ADT都是FFBF较差的独立预测因素,而PCB<50%且同时使用ADT的患者PCSS较好。单独接受78/86 Gy治疗的患者的FFBF比接受78 Gy和ADT治疗的患者差(危险比[HR]=3.39 [95% CI=1.46-7.88];P= 0.005),也比接受78/86 Gy和ADT治疗的患者差(HR=3.21 [95% CI=1.23-6.46];P=0.009)。然而,在多变量分析中,FB到IPL对PCSS没有影响。在急性和晚期≥2级泌尿生殖系统或胃肠道毒性方面,治疗组之间没有明显差异。
结论
本研究结果表明,单独接受78/86的患者比接受ADT联合78或78/86 Gy的患者预后更差。然而,由于中危前列腺癌患者的情况多样,因此需要进行更多的前瞻性试验来验证该研究结果。
高剂量维生素D(HDVD)减轻ADT治疗前列腺癌患者骨流失:随机Ⅱ期RCT
High-dose vitamin D to attenuate bone loss in patients with prostate cancer on androgen deprivation therapy: A phase 2 RCT
PMID: 38520382 【Cancer, IF=6.2, JCR: Q2】
背景
雄激素剥夺疗法(ADT)可抑制前列腺癌细胞的生长。然而,有报道指出ADT会导致骨密度(BMD)下降,增加骨折风险;目前,针对ADT引起的骨质流失的有效干预措施非常有限。
方法
一项2期随机对照试验研究了每周(共24周)服用高剂量维生素D(HDVD,50,000 IU/周)与安慰剂的可行性、安全性和初步疗效,该试验针对接受ADT的前列腺癌患者,所有受试者每天服用600 IU维生素D和1000 mg钙。受试者年龄≥60岁(平均年龄67.7岁),血清25-羟基维生素D水平<32 ng/ml,在过去6个月内开始接受ADT治疗。在基线和干预后,采用双能X射线吸收测量法评估BMD,并测量骨细胞、骨形成和骨吸收的水平。
结果
HDVD组(N=29)全髋关节BMD减少了1.5%,而对照组(N=30)减少了4.1%(p=0.03);股骨颈BMD减少了1.7%,而对照组减少了4.4%(p=0.06)。分层分析表明,对于基线 25-羟维生素D水平<27 ng/mL的患者,HDVD组的全髋部BMD减少了2.3%,而对照组减少了7.1%(p<0.01)。HDVD组患者的甲状旁腺激素(p<0.01)、骨保护素(p<0.01)、1型胶原蛋白的N端端肽(p< 0.01)和1型胶原蛋白的C端端肽(p<0.01)均有显著变化。两组在不良反应或毒性方面无差异。
结论
补充HDVD能明显减少髋部和股骨颈BMD的损失,尤其是对于血清25-羟维生素D基线水平较低的患者,但这对接受ADT的前列腺癌患者是安全可行的。
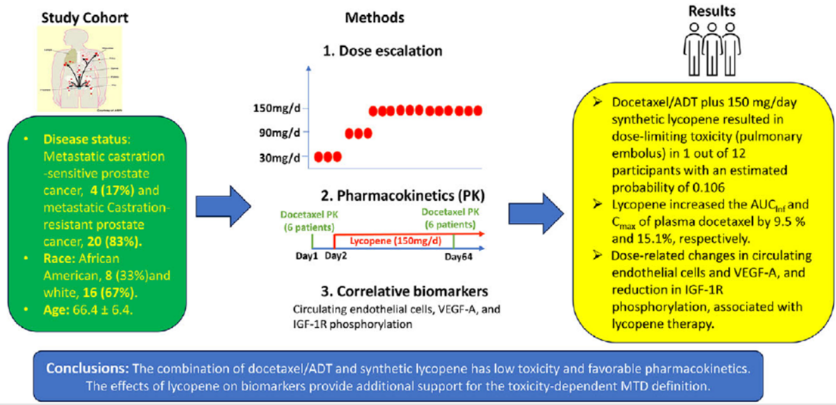
多西他赛联合合成番茄红素治疗转移性前列腺癌患者的Ⅰ期研究
A phase I study of docetaxel plus synthetic lycopene in metastatic prostate cancer patients
PMID: 38515274 【Clinical and translational medicine, IF=10.6, JCR: Q1】
目的
临床前研究表明,番茄红素能增强多西他赛在动物模型中的抗前列腺癌疗效。因此,进行了一项I期试验(NCT0149519),以确定合成番茄红素与多西他赛(和激素剥夺疗法[ADT])联用的最佳剂量,并评估其对转移性前列腺癌男性患者服用多西他赛的安全性和药代动力学的影响。
方法
受试者接受了21天为一个周期的75mg/m2多西他赛(联合ADT)以及30、90或150 mg/天的番茄红素治疗。采用贝叶斯模型平均持续再评估法指导剂量升级。还进行了多西他赛的药代动力学研究和多项相关研究。
结果
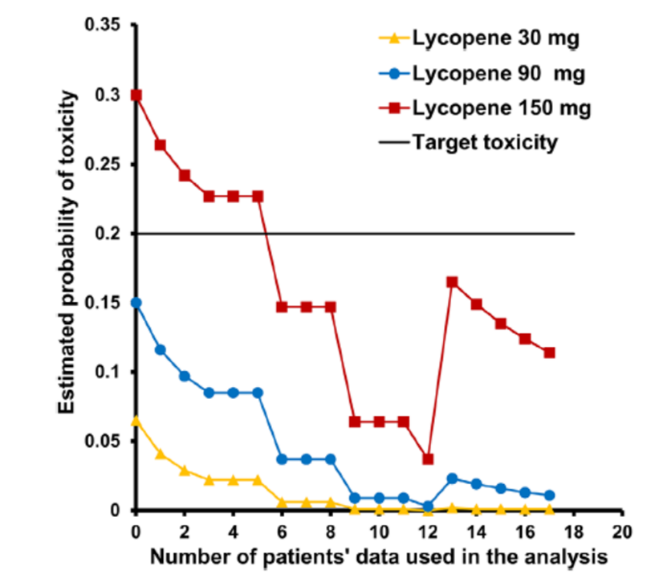
该研究共招募了24名参与者,其中18人参加了剂量递增队列以确定最大耐受剂量(MTD),6 参加了药代动力学队列。多西他赛/ADT加150毫克/天合成番茄红素导致12名参与者中有一人出现剂量限制性毒性(肺栓塞),估计概率为0.106,因此被选为MTD。番茄红素可使血浆多西他赛的AUCinf和Cmax分别增加9.5%和15.1%。相关研究显示,番茄红素疗法可使循环内皮细胞和血管内皮生长因子A发生剂量相关性变化,并降低胰岛素样生长因子1R的磷酸化。
结论
多西他赛/ADT与合成番茄红素的组合毒性低,药代动力学良好。番茄红素对生物标志物的影响为毒性依赖性MTD定义提供了更多支持。
研究亮点
用于治疗转移性前列腺癌患者的番茄红素MTD为150mg/d联合多西他赛/ADT,共同给予番茄红素观察到多西他赛血浆暴露的较小增加;机制上番茄红素与多西他赛/ADT共同给药后观察到血管生成和胰岛素样生长因子1信号传导的显著作用。
1. Nikitas J, Rettig M, Shen J, et al. Systemic and Tumor-directed Therapy for Oligorecurrent Metastatic Prostate Cancer (SATURN): Primary Endpoint Results from a Phase 2 Clinical Trial. Eur Urol. 2024;. doi:10.1016/j.eururo.2024.01.021.
2. Onal C, Guler OC, Erbay G, Elmali A. The effect of dose-escalation radiotherapy with simultaneous-integrated-boost on the use of short-term androgen deprivation therapy in patients with intermediate risk prostate cancer. Prostate. 2024;. doi:10.1002/pros.24693.
3. Peppone LJ, Kleckner AS, Fung C, et al. High‐dose vitamin D to attenuate bone loss in patients with prostate cancer on androgen deprivation therapy: A phase 2 RCT. Cancer. 2024;. doi:10.1002/cncr.35275.
4. Lilly MB, Wu C, Ke Y, et al. A phase I study of docetaxel plus synthetic lycopene in metastatic prostate cancer patients. Clin Transl Med. 2024;14(3):e1627. doi:10.1002/ctm2.1627.
排版编辑:肿瘤资讯-momo











 苏公网安备32059002004080号
苏公网安备32059002004080号


