肝脏是多种实体瘤转移的常见部位之一,不同实体瘤的流行病学研究中对肝转移发生情况有所论述,然而目前对实体瘤伴肝转移尚无整体的流行病学研究数据。既往研究报道,晚期肺癌肝转移人群发病率相对较高,临床多采用局部治疗但疗效有限,患者预后较差,因此亟需探索更为有效的系统性治疗方案。本次ELCC大会上公布的一项安罗替尼治疗肺癌伴肝转移的真实世界研究,为目前该类人群研究不足的现状进行了有效填补。【肿瘤资讯】特邀山东省肿瘤医院王哲海教授和北京大学肿瘤医院卓明磊教授接受专访,就该项研究的研究背景、研究内容及研究意义等展开详细讨论。
专家介绍
王哲海
山东省肿瘤医院副院长 主任医师
中国临床肿瘤学会常务理事
中国临床肿瘤学会非小细胞肺癌专家委员会副主任委员
中国临床肿瘤学会抗肿瘤药物安全专家委员会副主任委员
中国医促会胸部肿瘤分会副主任委员
中国初级卫生保健基金会基层肿瘤防治专业委员会主任委员
中国初级卫生保健基金会肺癌专业委员会副主任委员
山东抗癌协会常务理事
山东省癌症中心副主任
山东省抗癌协会肺癌分会主任委员
Q1:肝转移是影响晚期实体瘤患者生存的重要问题,目前伴有肝转移的实体瘤患者(尤其是伴肝转移的肺癌患者)的诊疗现状如何,能否请您结合实际情况聊一聊?
王哲海教授:肝脏是多种实体瘤转移的常见部位之一,包括肺癌、结直肠癌、胃癌、乳腺癌、卵巢癌等。以肺癌为例,初诊时约有5.8%的患者存在肝转移。如果按肺癌病理亚型区分,小细胞肺癌(SCLC)初诊肝转移发生率约为17.5%,非小细胞肺癌(NSCLC)约为3.8%;在晚期NSCLC中,肝转移的发生率可达13.4%~22%[1]。而在结直肠癌患者中,则约有15%~25%的患者群体在确诊时即伴有肝转移,另有15%~25%的患者在结直肠癌原发灶根治术后发生肝转移[2]。
肝转移的发生会显著影响多种实体瘤患者的生存,导致疾病侵袭性更强、患者预后更差,因此,临床上亟需寻找更为有效、且患者依从性更佳的治疗方案。目前,临床上对于肝转移的治疗手段主要包括手术治疗、局部治疗及药物治疗等。在药物治疗方面,虽然免疫治疗已改变了许多癌症的治疗格局,但转移到肝脏的肿瘤会直接或间接地诱导免疫抑制[3],导致患者无法从免疫治疗中获益,因此,仍需不断探索新的系统性治疗方案。
Q2:本次ELCC大会上,您团队公布了一项安罗替尼治疗肺癌伴肝转移的真实世界研究,这项研究的背景是怎样的?为何会选择安罗替尼作为此项研究的药物?
王哲海教授:面对肺癌伴肝转移人群发病率高、预后较差,以及该类人群治疗和相关研究未被满足的需求,此次ELCC大会上公布的安罗替尼治疗肺癌伴肝转移的真实世界研究结果,在一定程度上补充了该类人群的临床研究需求。安罗替尼是我国自主研发的一种新型多靶点抗血管生成药物。从作用机制上看,它能有效抑制VEGFR、FGFR、PDGFR及c-kit,具有独特的“肿瘤血管基质重编程”机制,可以通过干扰血管生成信号通路,阻断肿瘤血管新生;其次,它可以改善肿瘤细胞重编程,抑制肿瘤生长和转移并改善缺氧,调节代谢;第三,它可以调节肿瘤免疫微环境重编程,增强免疫细胞浸润,调节抗肿瘤/促肿瘤免疫细胞比例和细胞因子水平,从而实现单药治疗有效、联合化疗/免疫治疗发挥协同增效的作用[4-8]。
从既往多项临床研究来看,安罗替尼可为多种伴有肝转移的实体瘤患者带来较好的临床获益,且该获益不逊于无转移的患者。在肺癌治疗方面,如针对NSCLC的ALTER0303研究和针对SCLC的ALTER1202研究,相关亚组分析结果均显示,肝转移患者在接受安罗替尼治疗后仍能得到生存改善[9,10]。在消化道领域,今年ASCO GI大会上公布了一项安罗替尼联合化疗一线治疗伴不可切除肝转移消化道肿瘤的II期前瞻性研究(ALTER-G-001),结果显示了安罗替尼联合化疗可以实现较好的空间缩瘤比例,使患者有相对较高的手术转化机会,且毒性可控[11,12]。
此外,安罗替尼口服方便,临床上广泛应用于多种实体瘤的治疗,疗效佳且安全性较好,患者依从性相对较高。因此,在真实世界背景下,选择安罗替尼作为研究药物,回顾性分析其在治疗伴有肝转移的实体瘤患者中的疗效和安全性,希望能为这部分晚期患者的临床治疗决策带来更多的选择。
专家介绍
北京大学肿瘤医院胸部肿瘤内科 主任医师 副教授 硕导
中国抗癌协会肿瘤精准治疗专业委员会青年委员会委员
中国医药教育协会肿瘤化疗专业青委会秘书长
北京医学奖励基金会肺癌专业青委会副秘书长
北京健康促进会肺癌诊疗专家委员会副主任委员
中国老年学学会老年肿瘤专业委员会执行委员
中国人体健康科技促进会肿瘤化疗专委会常委
北京肿瘤病理精准诊断研究会青委会常委
《中华医学杂志》审稿专家
人民卫生出版社《肿瘤综合治疗电子杂志》编委
中山大学肿瘤防治中心《癌症》杂志编委
《Frontiers in Oncology》审稿编委
美国MD 安德森癌症中心访问学者
Q3:您参与的安罗替尼治疗肺癌伴肝转移的真实世界研究数据于今年 ELCC 大会上公布,请您介绍一下主要的研究结果及其亮点。
卓明磊教授:本次公布的安罗替尼治疗实体瘤伴肝转移的真实世界回顾性研究[13],收集了2016年1月1日至2023年2月28日期间,在北京大学肿瘤医院、山东省肿瘤医院、郑州大学第一附属医院、浙江省肿瘤医院及中山大学肿瘤防治中心等5家大型医院就诊的实体瘤伴肝转移、同时接受安罗替尼治疗的患者,其中有141例肺癌患者,包括98例NSCLC和43例SCLC。此外,有78.01%患者在75岁以下,66.67%患者BMI正常,97.87%患者接受安罗替尼三线治疗,90.07%患者采用安罗替尼单药治疗。从入组人群分布及人口学特征看,该项研究可真实反映当前的临床实际情况。
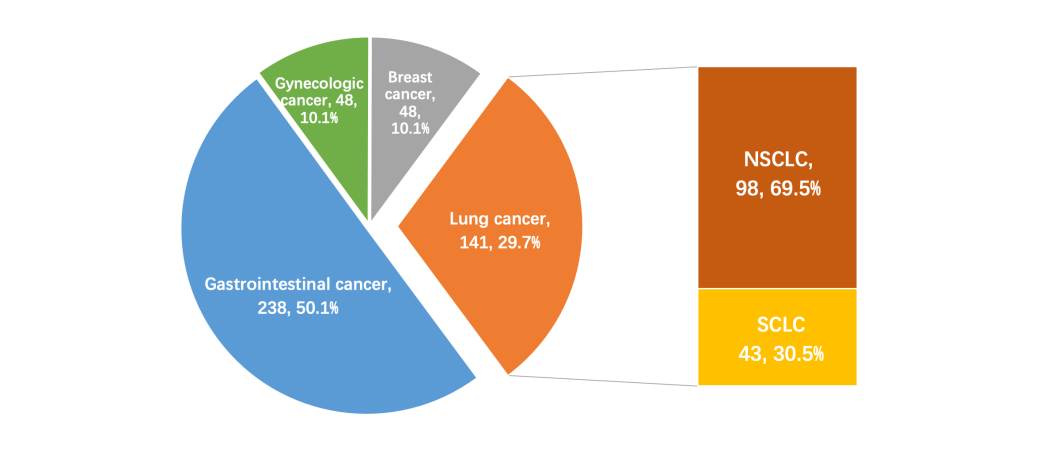
图1 入组患者分布
研究结果显示,截止2023年2月28日,安罗替尼治疗 NSCLC 及 SCLC 患者的中位PFS分别达5.80个月(95%CI: 5.00-7.20)和5.43个月(95%CI: 4.30-NE),肝转移灶的中位PFS(hPFS)分别达6.43个月(95%CI: 5.00-NE)和7.27个月(95%CI: 4.53-NE)。总生存期方面,NSCLC的中位OS达7.63个月(95%CI: 7.20-NE),SCLC的中位OS尚未达到(95%CI: 7.37-NE)。NSCLC和SCLC两组间的中位 PFS、肝转移病灶的中位 PFS 均无统计学差异;提示无论是NSCLC还是SCLC患者,均能从安罗替尼治疗中获益。同时,进一步分析发现,高龄(年龄≥75岁)、肝脏有多个转移病灶或是既往接受过多线治疗者,均能从安罗替尼治疗中获益。
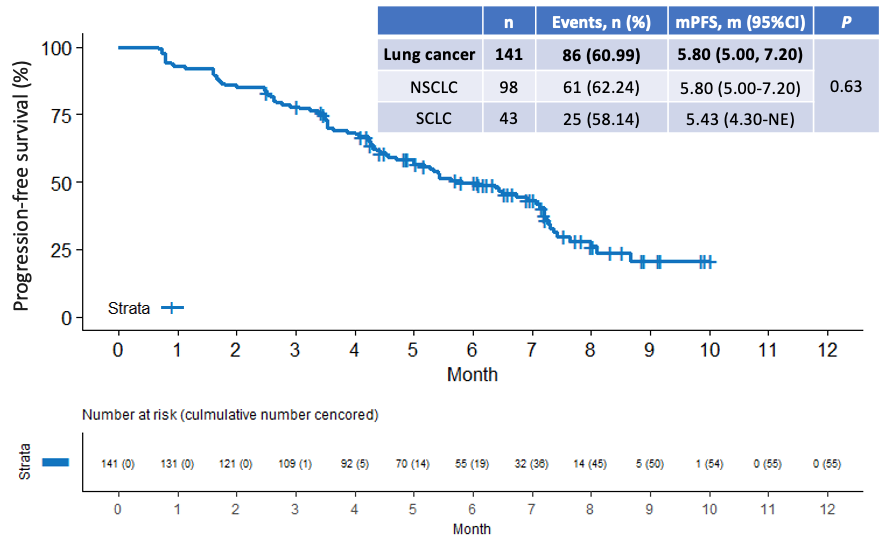
图2 肺癌伴肝转移患者的PFS曲线图
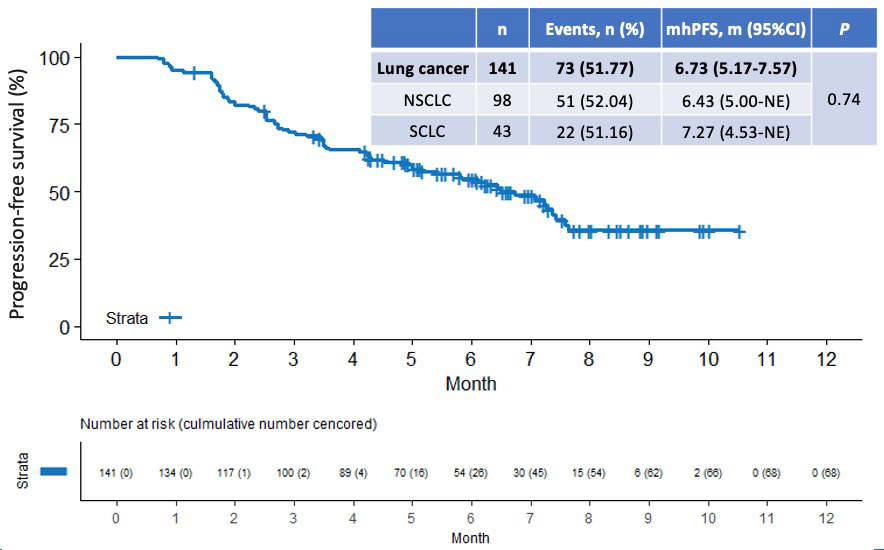
图3 肝转移病灶的PFS曲线图
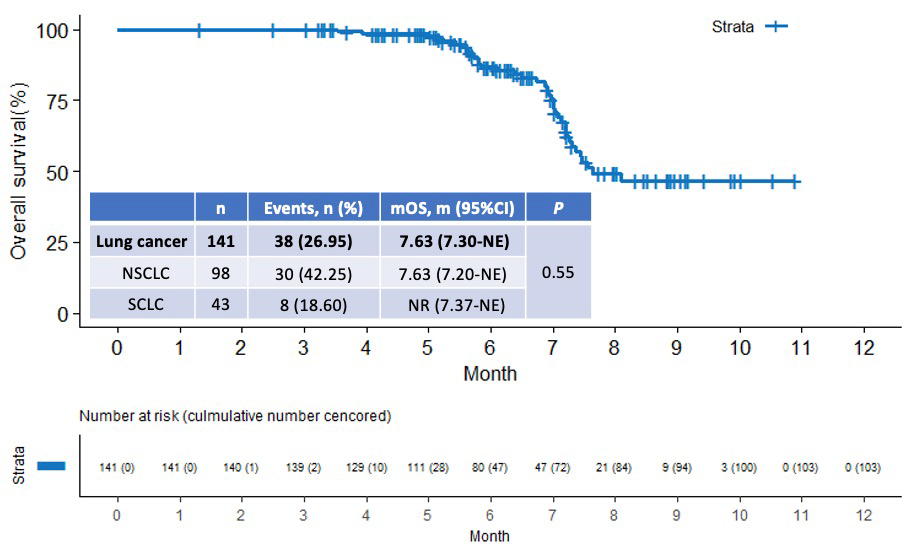
图4 肺癌伴肝转移患者的OS曲线图
从安全性方面来看,患者整体表现可耐受,治疗期间出现的不良事件(TEAEs)的发生率为19.2%,3级及以上TEAEs的发生率仅2.1%;最常见不良事件主要体现在血液系统和消化系统,如白细胞降低、腹泻等。对此,该类患者如果联合化疗治疗,相关不良反应需要临床医师积累更多的经验,尤其是针对像白细胞减少的这类问题需要通过临床实践去摸索,将患者的不良反应扎扎实实管理好。
总而言之,这是目前针对伴有肝转移的实体瘤患者应用安罗替尼治疗的一项最大样本的真实世界研究,本次在 ELCC 大会上公布的研究结果从真实世界层面证实了安罗替尼治疗肺癌伴肝转移的有效性和安全性,对临床实践具有一定的指导意义。此外,该研究的消化道及妇科肿瘤的数据也已于今年的ASCO GI及SGO大会上公布,随着安罗替尼在实体肿瘤肝转移中的循证证据不断完善,相信安罗替尼有望成为伴有肝转移实体瘤患者治疗的新选择,也将为更多肝转移患者带来更长、更高质量的生活!
Q4:如您所述,此次公布的是迄今为止安罗替尼治疗实体瘤的最大真实世界研究,您认为本研究对于临床的诊疗有哪些积极的指导意义?对于安罗替尼治疗伴有肝转移的实体瘤患者,您认为接下来还有哪些方面可以进一步深入探索?
卓明磊教授:真实世界研究中,患者的基线情况会比RCT研究中更为多样,往往患者获得的疗效并不如RCT研究结果。但该项真实世界研究结果亮眼,提示安罗替尼确可为肺癌伴肝转移患者带来较好的临床获益,且该获益不劣于没有肝转移的患者。同时,这与此前报道的多项II期研究及III期研究中的肝转移亚组分析结果相互印证,再次为这类患者的临床实践与决策提供了有力的指导。
此外,由于真实世界研究中的患者情况更为复杂,此次研究结果为广大医生在临床实践中使用安罗替尼治疗伴有肝转移的肺癌及其他实体肿瘤时提供了充足的信心基础,也使患者可以在治疗过程中更加安心。
未来对于安罗替尼的相关研究展望,一方面,可以对人群进行更为精准的分层,探讨潜在的优势人群特征;另一方面,还可探索安罗替尼在前线治疗中的应用,包括联合治疗中的应用等。
小结
安罗替尼作为我国自主研发的一种新型多靶点抗血管生成药物,无论是在基础研究中的机制作用方面,还是在临床研究数据方面,都表现出了令人惊喜的作用优势。该药疗效、安全性及依从性均能有效满足临床医师和患者的使用需求,为实体瘤伴肝转移患者的治疗决策提供了新的选择。后续研究方面可进一步加强优势人群特征的精准化分层,提升前线治疗作用,未来应用前景值得期待。
1. OUINT LE, TUMMALA S, BRISSON LJ, et al. Distribution of distant metastases from newly diagnosed non-small cell lung cancer. Ann Thorac Surg. 1996 Jul;62(1):246-50.
2. 中国医师协会外科医师分会, 中华医学会外科分会胃肠外科学组, 中华医学会外科分会结直肠外科学组, 等. 中国结直肠癌肝转移诊断和综合治疗指南(V2023)[J]. 中华胃肠外科杂志, 2023, 26(1): 1-15.
3. Yu J, et al. Liver metastasis restrains immunotherapy efficacy via macrophage-mediated T cell elimination. Nat Med. 2021;27(1):152-164. 2021 Jan;27(1):152-164.
4. Xie C, Wan X, Quan H, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor. Cancer Sci. 2018;109(4):1207-1219.
5. Su Y, Luo B, Lu Y, et al. Anlotinib Induces a T Cell-Inflamed Tumor Microenvironment by Facilitating Vessel Normalization and Enhances the Efficacy of PD-1 Checkpoint Blockade in Neuroblastoma. Clin Cancer Res. 2022 Feb 15;28(4):793-809.
6. Huang Y, Kim BY, Chan CK, et al. Improving immune-vascular crosstalk for cancer immunotherapy. Nat Rev Immunol. 2018 Mar;18(3):195-203.
7. Khan KA, Kerbel RS. Improving immunotherapy outcomes with anti-angiogenic treatments and vice versa. Nat Rev Clin Oncol. 2018 May;15(5):310-324.
8. Galluzzi L, Humeau J, Buqué A, et al. Immunostimulation with chemotherapy in the era of immune checkpoint inhibitors. Nat Rev Clin Oncol. 2020; Dec;17(12):725-741.
9. Shen Y, et al. Effect and outcomes analysis of anlotinib in non-small cell lung cancer patients with liver metastasis: results from the ALTER 0303 phase 3 randomized clinical trial. J Cancer Res Clin Oncol. 2023 Apr;149(4):1417-1424.
10. Cheng Y, et al. Anlotinib for patients with small cell lung cancer and baseline liver metastases: A post hoc analysis of the ALTER 1202 trial. Cancer Med. 2022 Feb;11(4):1081-1087.
11. Wu J, et al. ASCO GI 2024, Poster 112.
12. Wu J, et al. ASCO GI 2024, Poster 653.
13. Zhuo ML, Wang Zh. ELCC 2024, Poster 172.
排版编辑:肿瘤资讯-Doris











 苏公网安备32059002004080号
苏公网安备32059002004080号


