通过对2024.1.01-2024.1.31期间发表的乳腺癌领域内分泌治疗的最新文献进行检索和梳理,本期“乳腺癌新文连播”介绍了如何选择使用OFS治疗患者的监测生物标志物;HR+/HER2+患者在抗HE2治疗后连用OFS的效果;monachE研究长期随访结果,以及CDK4/6抑制剂在不同乳腺癌以及联合不同内分泌治疗的不良反应,以便医生在临床上的决策。接下来,让我们一起来了解这些最新文献吧!
选择合适的生物标志物监测绝经前雌激素受体乳腺癌患者卵巢功能抑制的有效性1
PMID: 38242892 【NPJ Breast Cancer IF=5.98; Q2】
背景
在美国,大约20%的乳腺癌发生在绝经前妇女。保留卵巢功能是这些年轻患者的重要考虑因素。在内分泌治疗中加入抑制卵巢功能是一种预防卵巢功能不全、生育能力受损和提前绝经的策略,同时提高化疗后月经恢复率和怀孕的可能性。SOFT-TEXT以及ASTRRA试验的结果表明,在他莫昔芬或芳香酶抑制剂(AI)中添加卵巢功能抑制可提高无病生存率,避免远处复发。最近的一项荟萃分析分析了25项随机试验,使用了来自近15,000名女性的个体患者数据,证实了乳腺癌15年复发和死亡风险的降低。在对超过11000名绝经前乳腺癌妇女进行的15项研究的系统文献综述中,发现了一致的10年研究结果。在化疗后仍未绝经的高危患者,或40岁及以下复发风险较高的患者中尤其如此。药物抑制卵巢功能的可逆性比手术或放疗消融术的可逆性更有优势,特别是对于那些可能有许多剩余生育年龄或希望未来卵巢功能的绝经前妇女。在设计评估GnRH激动剂的新研究时,出现了一个问题,即在绝经前雌激素受体阳性(ER)乳腺癌患者中,哪种生物标志物是卵巢功能抑制最有意义的替代物。
结果
ASCO关于卵巢抑制的指南是基于GnRH激动剂1个月剂型的试验数据。在先前评估GnRH激动剂疗效的试验中,E2 < 30 pg/mL的结果一致表明大多数绝经前妇女卵巢功能受到抑制。不论年龄、化疗史和肿瘤特征,不同药物(leuprolide和goserelin)的雌二醇水平是一致的。其他生物标志物不太一致,因为FSH水平的差异与患者年龄(P= 0.02)、cERB-B2(+)肿瘤(P= 0.05)和化疗方案中紫杉烷的缺乏(P= 0.05)有关。同样,在GnRH激动剂和肿瘤分期(T1、T2和T3、T4, P= 0.03)之间观察到LH水平的差异(P= 0.03)。在前列腺癌的情况下,在GnRH激动剂治疗期间,FSH和LH都没有被测量。在前列腺癌雄激素剥夺治疗期间,睾酮是记录去势水平的首选生物标志物。这与乳腺癌中E2的测量相似。有关部门已经发布了2022年用于评估GnRH类似物治疗晚期前列腺癌疗效的适当临床终点指南,血浆睾酮被建议作为主要终点,水平<50 ng/dL被定义为建立去势水平的阈值。从前列腺癌的情况推断,利用E2作为GnRH激动剂在乳腺癌疗效的主要生物标志物并非不合理。
结论
基于以上讨论,我们建议在乳腺癌试验中,E2水平来衡量卵巢功能抑制的主要终点。应使用雌二醇,因为雌二醇最能反映卵巢功能,是激活乳腺雌激素受体的最相关激素。ASCO指南指出,在接受GnRH激动剂治疗的妇女中检测绝经前E2水平是卵巢不完全抑制的标志。FSH和/或LH水平的测量可能是次要终点。不论激素水平如何,恢复月经都表明治疗失败。当评估任何制剂时,主要关注的是如果GnRH激动剂制剂在给药期结束时,在下一个剂量计划之前逐渐消失,E2逃逸的可能性。我们建议接近给药间隔结束时也检查E2水平,以确认它仍然被抑制。虽然在临床实践中,评估月经恢复和/或更年期症状的周期性波动是很重要的,但临床试验程序是否包括此类评估需要考虑。
关键词: breast cancer, hormone receptor, ovarian function suppression,pre-menopausal.
接受曲妥珠单抗治疗的绝经前HR+/HER2+早期乳腺癌患者卵巢功能抑制的预后因素和受益人群:来自长期随访的现实世界研究的证据2
PMID: 38185807 【Breast Cancer; IF=3.223; Q3】
背景
激素受体阳性(HR+)/人表皮生长因子受体2阳性(HER2+)乳腺癌表现出相当大的异质性,对于需要曲妥珠单抗治疗的绝经前HR+/HER2+的乳腺癌患者是否能从类似于HR+/HER2-乳腺癌的卵巢功能抑制(OFS)治疗中获益具有很好的研究价值。绝大多数HR+ /HER2+乳腺癌患者接受了曲妥珠单抗治疗,超过一半的患者接受了蒽环类药物治疗,这两种疗法都有一定程度的心脏毒性,OFS药物可能会进一步增强这种毒性。因此,仔细选择真正受益于OFS治疗的HR+ /HER2+乳腺癌患者是很重要的。基于以往的研究和临床实践,我们对经曲妥珠单抗治疗的绝经前HR /HER2早期乳腺癌患者进行了回顾性研究,以探讨可能受益于OFS的人群和临床病理因素的预后价值。
方法
回顾性分析2009年10月至2018年10月期间接受曲妥珠单抗治疗的253例绝经前HR+/HER2+早期乳腺癌患者的多中心数据。生存率分析采用Kaplan-Meier法,生存率比较采用log-rank检验。采用单因素和多因素Cox回归分析,分析影响侵袭性无病生存(IDFS)的独立危险因素。
结果
中位随访98.50个月后,与单独他莫昔芬/托瑞米芬相比,他莫昔芬/托瑞米芬/芳香酶抑制剂联合OFS在总体研究人群中显示出显著的获益(HR=0.289, 95% CI: 0.100-0.835, p=0.022, 8年IDFS率:90.78% vs. 95.54%),特别是在淋巴结阳性亚组和年龄≤40岁亚组中。年龄≤40岁,组织学分级>2级,淋巴结受累,PR≤50%,单独使用他莫昔芬是独立的预后因素。
结论
对于绝经前HR+/HER2+乳腺癌患者,年龄、组织学分级、淋巴结状态、PR表达和OFS治疗是该人群的独立预后因素。
关键词: breast cancer, hormone receptor, human epidermal growth factor receptor 2, ovarian function suppression, trastuzumab.
辅助Abemaciclib +内分泌治疗HR+/HER2-,高危早期乳腺癌:来自预monarchE 总生存期中分析的结果,包括5年疗效结果3
PMID: 38194616 【J clin cncol; IF=50.717】
摘要
在激素受体阳性、人表皮生长因子受体2阴性、淋巴结阳性、高危早期乳腺癌(EBC)患者中,2年的辅助治疗abemaciclib联合内分泌治疗(ET)可显著改善侵袭性无病生存(IDFS)和远端无复发生存(DRFS),并持续超过2年的治疗期。在这里,我们报告了预先指定的总生存期(OS)中期分析的5年疗效结果。在意向治疗人群中,中位随访54个月,abemaciclib的获益持续存在,IDFS的风险比为0.680 (95% CI, 0.599至0.772),DRFS的风险比为0.675 (95% CI, 0.588至0.774)。abemaciclib的持续获益转化为曲线的持续分离,5年内IDFS和DRFS的绝对改善率分别为7.6%和6.7%,而4年和3年的绝对改善率分别为6%和5.3%和4.8%和4.1%。与单独ET组相比,abemaciclib联合ET组的死亡人数较少(208 vs 234), OS未达到统计学意义。没有观察到新的安全信号。总之,abemaciclib加ET在治疗结束后继续降低发生侵袭性和远处疾病复发的风险。5年的绝对改善增加与结转效应一致,并进一步支持在高危EBC患者中使用abemaciclib。
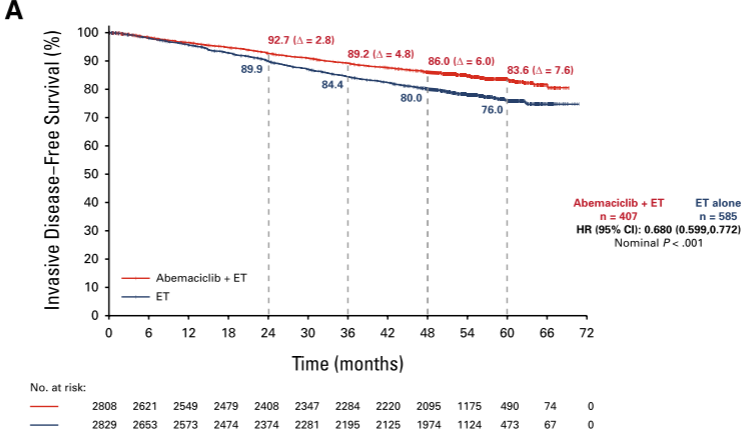

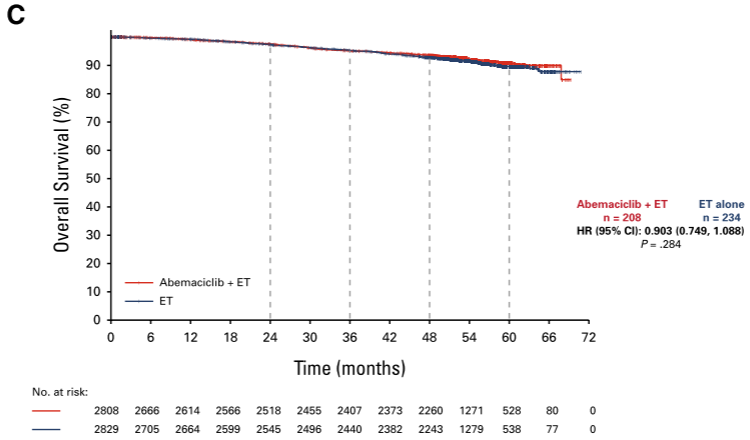
关键词: Abemaciclib, Endocrine Therapy, Early Breast Cancer
CDK4/ 6抑制剂治疗HR+/ HER2-乳腺癌的不良事件:随机对照试验的荟萃分析综述4
PMID: 38288438 【Front Pharmacol IF=5.988; Q2】
背景
三种CDK4/6抑制剂的临床选择是一个具有挑战性的问题,因为缺乏独特的临床病例特征、生物标志物,以及它们在无进展生存期和总生存期方面的可比临床益处。为了利于临床治疗决策,我们对CDK4/6抑制剂联合内分泌治疗HR+/HER2-乳腺癌的不良事件进行了全面评估。
方法
我们检索了Cochrane、PubMed、Embase和Web of Science数据库,从它们成立到2022年8月1日。对结果进行叙述性总结,并通过AMSTAR-2、PRISMA和GRADE评估AE的方学质量、报告质量和证据质量。
结果
我们的分析包括24项荟萃分析系统评价,评估了13例早期乳腺癌(EBC)和158例晚期乳腺癌的AE,发现CDK4/6抑制剂的添加显著增加了早期乳腺癌任何级别的AE和3级或更高级别的AE,同时显著增加了治疗中断的风险。在晚期乳腺癌中,高质量和中等质量的证据表明,CDK4/6抑制剂显著增加了所有级别的AE,包括3/4级AE、白细胞减少症、3/4级白细胞减少症、中性粒细胞减少症、3/4级中性粒细胞减少症、贫血、3/4级贫血、恶心、3/4级便秘、疲劳、发热、静脉血栓栓塞腹痛和咳嗽。然而,它们并没有显著提高3/4级腹泻的发生率。亚组分析显示palbociclib主要增加血液学毒性,特别是3/4级中性粒细胞减少、贫血和血小板减少。Ribociclib主要与3/4级中性粒细胞减少、QT间期延长和脱发相关。Abemaciclib与腹泻和血肌酐水平升高密切相关。
结论
与CDK4/6抑制剂相关的ae各不相同,需要个性化和精确的临床选择以获得最佳管理。治疗方法应根据患者的病史和不同CDK4/6抑制剂的不同特点来改善患者的生活质量。
关键词: CDK4/6 inhibitor, adverse event, umbrella review, randomized controlled trial, endocrine therapy, HR+/ HER2-breast cancer。
激素受体阳性乳腺癌的新辅助内分泌治疗:是否会导致更多的保乳手术?5
PMID:38265568 【Breast Cancer Res Treat; IF=7.4; Q1】
背景
在局限性乳腺癌中,化疗作为一种新辅助治疗来降低肿瘤的分期并改善手术效果早已被确立。新辅助化疗(NCT)可以导致乳房切除术和腋窝清扫数量减少,pCR率增加。基因表达研究已经确定了有助于确定预后和治疗选择的亚型。基因监测手段如MammaPrint和Oncotype DX有助于确定哪些患者将从化疗中受益。在局部晚期HR+乳腺癌患者中,选择NET的主要原因是为了获得保乳手术(BCS)。然而,NET常常导致“饼干碎”效应;在内分泌治疗期间,肿瘤会破裂,但乳房的受影响区域保持不变。此外,由于分散肿瘤细胞的面积难以检测,NET后磁共振成像(MRI)评估反应的结果可能会产生误导。缺乏比较原发性手术和NET治疗HR+患者的随机试验。Chiba等人的一项研究(85.884例患者)显示,与初次手术相比,接受NET的患者更有可能接受BCS而不是乳房切除术(46.4%比43.9%;P = 0.02) ,本研究我们旨在进一步确定NET在HR患者中的作用,包括pCR、BCS和手术转换率。
结果
19项研究报告了NET后的病理完全缓解(pCR)率。总pCR率为1%。与新辅助化疗(NCT)相比,化疗后BCS率显著提高(OR 0.60;95% ci, 0.51-0.69;P < 0.00001)。8项研究报告了手术转换率,平均为30.2%。
结论
本综述发现三分之一的患者在接受NET治疗后符合BCS的条件。然而,为了真正回答NET是否有助于外科医生获得BCS的临床问题,应该进行一项比较原发性手术与NET的随机临床试验。进一步的研究必须集中在更好地选择患有HR+肿瘤的患者,这些患者将受益于NET,从而提高BCS率。
关键词: Breast cancer; Breast conserving surgery; Neoadjuvant endocrine treatment.
早期乳腺癌患者内分泌治疗期间的血脂变化6
PMID:38191454 【Lipids in Health and Disease; IF=4.35; Q3】
背景
内分泌药物可能影响乳腺癌患者的脂质代谢。本研究探讨不同内分泌药物对早期BC患者脂质变化的影响。
方法
回顾性分析2013年1月至2021年12月2756例BC患者内分泌治疗期间血脂变化趋势。采用广义线性混合模型评估四项脂质参数的变化,包括总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)和高密度脂蛋白(HDL-C)。这些参数在基线和内分泌治疗开始后6、12、18、24、36、48、60和72个月进行量化。此外,根据绝经状态或药物类型进行了亚组分析。
结果
共纳入1201例使用芳香化酶抑制剂(AIs)的患者,包括阿那曲唑(ANA)、来曲唑(LET)或依西美坦(EXE), 1555例使用托瑞米芬(TOR)。治疗5年间TC、TG水平均有显著升高趋势(P < 0.05)。TOR组HDL-C水平较基线升高(P < 0.05)。与绝经后AI组相比,随着时间的延长,绝经前AI组TC、TG、LDL-C升高趋势更为明显(β = 0.105、0.027、0.086)。在3年内,ANA组和LET组的TC、TG和LDL-C水平显著高于基线(P < 0.05)。此外,EXE组的TG水平显著低于ANA和LET组(P < 0.05),但3年后这种显著差异消失。
结论
AIs对血脂的影响明显大于TOR。AIs对绝经前患者的血脂有较大的影响。甾体类AIs (EXE)对脂质水平的影响小于非甾体类AIs (ANA和LET)。
关键词: Lipid profile, Breast cancer, Endocrine therapy, Toremifene, Aromatase inhibitors
1. Kelly E McCann, Shari B Goldfarb, et al. Selection of appropriate biomarkers to monitor effectiveness of ovarian function suppression in pre-menopausal patients with ER+ breast cancer. NPJ Breast Cancer. 2024 Jan 19;10(1):8.
2. Jie Ju, Song-Lin Gao, et al. Prognostic factors and benefit populations of ovarian function suppression in premenopausal HR+/HER2+ early-stage breast cancer patients who received trastuzumab: Evidence from a real world study with long-term follow-up. Thorac Cancer. 2024;1–9.
3. Priya Rastogi , Joyce O'Shaughnessy, et al. Adjuvant Abemaciclib Plus Endocrine Therapy for Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative, High-Risk Early Breast Cancer: Results From a Preplanned monarchE Overall Survival Interim Analysis, Including 5-Year Efficacy Outcomes. J J Clin Oncol. 2024 Jan 9:JCO2301994.
4. Dongqing Pu , Yue Wu , et al. The adverse events of CDK4/ 6 inhibitors for HR+/ HER2- breast cancer: an umbrella review of meta-analyses of randomized controlled trials. Front Pharmacol. 2024 Jan 15:15:1269922.
5. Merel E. van de Loo, Layla Andour, et al. I Neoadjuvant endocrine treatment in hormone receptor‑positive breast cancer: Does it result in more breast‑conserving surgery?. Breast Cancer Research and Treatment. 24 January 2024.
6. Yue chong Li, Zixi Deng, et al. Lipid changes during endocrine therapy in early-stage breast cancer patients: A real-world study. Lipids in Health and Disease. 2024 Jan 8;23(1):9.
排版编辑:肿瘤资讯-momo











 苏公网安备32059002004080号
苏公网安备32059002004080号


