导语
从最新研究进展看TNBC的治疗现状,展望其未来。
三阴性乳腺癌(TNBC)被定义为缺乏雌激素受体、孕激素受体和HER2表达的乳腺癌亚型,约占全部乳腺癌的10%-20% [1] ,是最具侵袭性的乳腺癌亚型。相比其他类型乳腺癌,TNBC缺乏相关靶点,治疗手段单一,预后较差。近年来,晚期TNBC的治疗手段取得了长足进展,关于新型化疗药物、抗体药物偶联物(ADC)、靶向治疗以及免疫治疗的研究成果为晚期TNBC患者带来了新的希望,尤其新型ADC药物T-DXd的出现改变了HER2低表达TNBC患者的治疗格局;而靶向TROP2的ADC药物Dato-DXd、戈沙妥珠单抗(SG)等也在TNBC领域展现了卓越疗效,其单药或联合方案为晚期TNBC患者提供更佳治疗方案。ADC Academy特此邀请 中山大学孙逸仙纪念医院刘洁琼教授阐述ADC药物在TNBC的应用现状及前景,以启迪临床思考。
传统化疗或免疫单药疗效有限,免疫联合治疗方案为晚期TNBC带来新的希望
TNBC对传统化疗相对敏感,然而复发率较高。相较于其他分子亚型,具有更高的突变负荷,易产生诱导免疫应答的肿瘤特异性抗原;并且有研究证实,肿瘤浸润淋巴细胞(TILs)是影响乳腺癌预后的独立因素,且高TILs浸润能延长患者的总生存期(OS),结果尤其是以TNBC患者人群为显著 [2]
;基于这些生物学特征,TNBC也成为免疫治疗的潜在对象。然而,单独使用免疫检查点抑制剂(ICIs)在转移性TNBC患者中疗效欠佳,客观缓解率(ORR)从未筛选人群的5%到一线PD-L1阳性人群的23%不等
[3-6]
,后续III期研究探索集中于联合治疗方案。
基于III期研究Impassion130的积极结果,阿替利珠单抗联合白蛋白紫杉醇成为首个获批TNBC适应症的免疫联合化疗方案,然而后续评估阿替利珠单抗联合紫杉醇一线治疗的III期IMpassion131研究未达到主要研究终点,该适应症最终被撤销。
III期KEYNOTE-355研究 探索了帕博利珠单抗联合化疗对比单纯化疗一线治疗晚期TNBC的疗效 [7,8] ,结果显示,在PD-L1 CPS≥10的患者中帕博利珠单抗联合化疗的中位无进展生存期(PFS)明显长于安慰剂联合化疗组(9.7个月 vs 5.6个月;HR=0.65)。基于此,FDA批准帕博利珠单抗联合化疗用于治疗PD-L1高表达(CPS≥10)的局部复发、不可切除或转移性TNBC患者。在国内进行的 III期TORCHLIGHT研究 中 [9] ,特瑞普利单抗联合化疗相比单纯化疗一线治疗TNBC主要终点PD-L1阳性人群的PFS阳性,BICR评估的中位PFS 分别为8.4个月 vs 5.6个月,HR=0.65(双侧P=0.0102)。这两项III期研究均展现了免疫治疗联合化疗在PD-L1阳性人群的潜力,也获得了PFS和OS双获益, 然而可以看到即使在PD-L1阳性这一优势人群,中位PFS也难以超过1年, 显示了晚期TNBC的难治性。
而在早期TNBC中,KEYNOTE-522研究显示,在化疗的基础上加入帕博利珠单抗显著提高pCR率及EFS,该方案用于早期TNBC患者的适应症在FDA和中国均已获批。


图1. KEYNOTE-355和TORCHLIGHT研究中主要终点人群的PFS结果
另外,刘洁琼教授团队探索了免疫治疗联合化疗及抗血管生成疗法(卡瑞利珠单抗联合艾立布林及阿帕替尼)在晚期TNBC患者的疗效和安全性。II期研究结果显示,纳入的46例患者在晚期疾病阶段的中位治疗线数为3线,17.4%在晚期阶段接受过免疫联合化疗,ORR为37.0%,中位PFS为8.1个月 [10] 。同时,该团队在真实世界研究中验证了免疫联合化疗新辅助治疗在早期TNBC患者中取得了有临床意义的病理学完全缓解(pCR)率和无复发生存期(DFS)获益 [11] ,丰富了其循证依据。值得一提的是,刘洁琼教授团队还开发了一个利用人工智能来预测晚期乳腺癌患者接受ICIs联合治疗响应的影像组学模型 [12] ,以更好的筛选可能从ICIs联合治疗中获益的患者。
ADC时代的来临,在TNBC掀起了一轮新的浪潮
ADC药物的出现是近年来TNBC治疗领域的一大重要突破,自2020年以来已有两款ADC药物在晚期TNBC获批。 ASCENT研究显示,在既往接受过至少二线化疗的转移性TNBC患者中, SG相比医生选择的化疗(TPC)显著改善中位PFS(5.6个月 vs 1.7个月,HR=0.39,P<0.0001)和中位OS(12.1个月 vs 6.7个月,HR=0.48,P<0.0001) [13] 。
DESTINY-Breast04研究则确立了T-DXd在HER2低表达乳腺癌患者的治疗地位。该研究纳入既往接受过1-2线化疗的HER2低表达转移性乳腺癌患者,在HR阳性组及总人群中,T-DXd组的中位PFS和中位OS均优于TPC组, 在HER2低表达/HR阴性亚组中也取得了相同获益趋势,T-DXd组的中位PFS相较于TPC组延长5.6个月(8.5个月 vs 2.9个月),中位OS延长了9.9个月(18.2个月 vs 8.3个月) [14] 。基于这一显著成果,乳腺癌的治疗告别了既往非阳即阴的二分格局,开启了HER2阳性、低表达、阴性的三分类新时代。2023年ESMO大会中公布的中位随访32.0个月的结果与首次研究一致 [15] ,进一步夯实了T-DXd在HER2低表达乳腺癌的治疗地位。

图2. DESTINY-Breast04最新随访结果
DESTINY-Breast15这一IIIb期研究旨在评估T-DXd在不可切除或转移性HER2低表达(IHC 1+或IHC 2+/ISH-)或HER2 IHC 0乳腺癌患者中的疗效和安全性 [16] ,将纳入150例HR-患者。期待这一研究能够再次取得突破性成果,进一步明确T-DXd在TNBC的适用人群范围,丰富其循证医学证据。

图3. DESTINY-Breast15研究设计
目前针对TNBC的二线治疗,《NCCN乳腺癌临床实践指南2023 v5》将T-DXd作为HER2 IHC 1+或2+/ISH-患者的一类推荐方案 [17] 。对于HER2低表达乳腺癌,二线选择T-DXd还是SG目前缺乏头对头研究,但真实世界数据或许可提供一定参考。2023年SABCS大会中公布的一项真实世界研究评估T-DXd或SG作为起始治疗及序贯不同方案对转移性乳腺癌患者生存结局的影响 [18] 。结果显示, 起始接受T-DXd治疗组的患者中位OS为22.9个月,高于SG起始治疗组的16.4个月(p=0.049)。T-DXd组的中位PFS为7.6个月,显著高于SG组的4.6个月(p=0.005)。SG序贯T-DXd组的中位PFS(5.5个月 vs 2.4个月,p=0.97)和中位OS(NE vs 13.9个月,p=0.84)均与T-DXd序贯SG组相当。

图4. 不同ADC药物治疗方案的生存数据
该研究在真实临床环境中证实了T-DXd相比SG在HER2低表达乳腺癌的优效性。进一步支持HER2低表达的TNBC患者首选T-DXd进行治疗,患者不存在HER2低表达再行选择SG或其他化疗方案,从而为患者提供更具生存优势的最佳治疗方案。
免疫联合ADC展现广阔前景,未来可期
ADC药物可直接将高活性载药精准递送至肿瘤细胞,相比传统化疗药物和单克隆抗体,具备高效低毒的特性,这使得ADC药物具备了替代化疗的潜力。此外,ADC药物还能够通过抗体依赖性细胞毒性(ADCC)、抗体依赖性细胞介导的吞噬作用和/或补体依赖性细胞毒性来激活免疫系统
[19]
。这些机制为ICIs与ADC的协同作用提供了有力的生物学理论基础。鉴于ADC药物已在晚期TNBC中被证实优于化疗,免疫联合ADC是否优于免疫联合化疗,或者在TNBC中扩展免疫联合的适用人群,是TNBC中重要的关注点。
目前,多种ADC药物联合免疫的探索已经向肿瘤一线治疗发起冲击,并展现出积极的应用前景。在乳腺癌领域,一项正在进行的开放标签、多臂、两部分、多中心的Ib/II期研究BEGONIA旨在评估PD-L1抑制剂度伐利尤单抗联合其他疗法(包括ADC)用于晚期TNBC一线治疗的疗效和安全性。
队列6纳入了HR-/HER2低表达(IHC2+/ISH-、IHC1+/ISH-)的不可切除的局部晚期或转移性TNBC患者 [20] ,截至2022年7月22日,共有58例患者接受了 T-DXd联合度伐利尤单抗治疗,cORR为56.9%,中位PFS为12.6个月。 安全性结果显示未报告剂量限制性毒性(DLT),常见不良事件(AE)集中在胃肠道和血液学方面,治疗相关的AE多为1/2级。8例患者发生治疗相关ILD/非感染性肺炎:3例1级、3例2级、1例3级和1例5级(COVID相关性肺炎)。
BEGONIA研究队列7则为 Dato-DXd (Trop-2 ADC) 联合度伐利尤单抗 一线治疗局部晚期或转移性TNBC患者 [21] ,2023年ESMO大会中公布的结果显示,共62例患者接受治疗(29例仍在进行中), cORR为79%, 其中6例(10%)患者CR,43例(69%)患者PR。 中位DoR为15.5个月,中位PFS为13.8个月。 尤其值得关注的是, 该研究纳入的患者绝大多数 (87%) 为PD-L1阴性或表达较低的人群 (肿瘤或免疫细胞联合评分TAP<10%)。
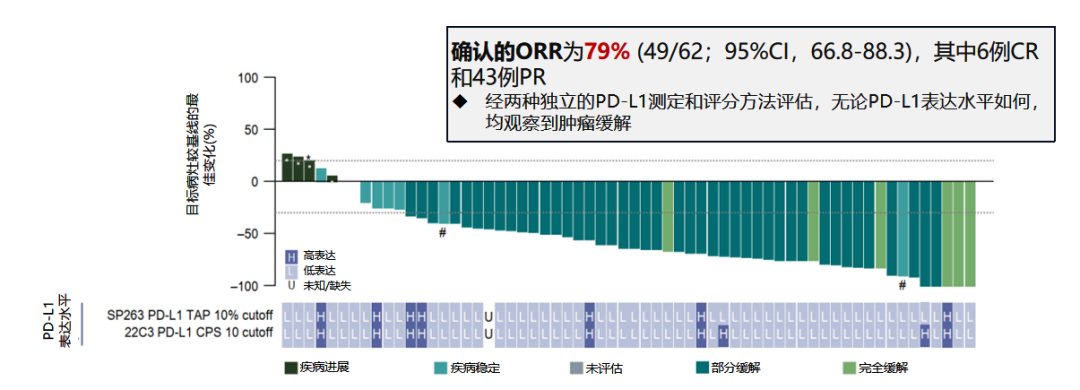
图5. BEGONIA研究队列7的cORR高达79%
安全性方面,最常见的AE是恶心和口腔炎,发生率均为40%,35例(57%)患者发生任何3/4级AE,14例(23%)患者发生严重AE。贫血(15%)、腹泻(13%)和中性粒细胞减少(5%)的发生率较低。仅有3例(5%)患者发生了1/2级与治疗相关的ILD/非感染性肺炎,无与治疗相关AE的死亡病例。未报告新的安全信号。

图6. BEGONIA研究安全性结果汇总
目前,在乳腺癌治疗领域,免疫疗法仅在TNBC中展现卓越成效,是晚期TNBC的一线标准治疗方案之一。但其使用受PD-L1表达水平影响,不能广泛覆盖TNBC。值得庆幸的是,ADC药物打破了人群筛选的界限,BEGONIA研究队列7显示, 无论PD-L1表达如何,Dato-DXd联合度伐利尤单抗一线治疗在晚期TNBC患者中持续显示出稳健、持久的抗肿瘤反应,以及良好的安全性。
Dato-DXd联合ICIs治疗TNBC的III期研究也在进行中,从晚期一线、辅助到新辅助阶段惠及广泛TNBC患者:
III期开放标签、随机TROPION-Breast05研究(NCT06103864)在PD-L1阳性、局部复发不可手术或转移性TNBC患者中比较Dato-DXd±度伐利尤单抗与研究者选择的化疗+帕博利珠单抗的疗效和安全性;
III期开放标签、随机TROPION-Breast03研究(NCT05629585)纳入经过新辅助治疗后未达到病理学完全缓解(pCR)的I-III期TNBC患者,比较Dato-DXd±度伐利尤单抗与研究者选择方案的差异;
III期开放标签、随机TROPION-Breast04研究(NCT06112379)评估Dato-DXd+度伐利尤单抗新辅助/辅助治疗TNBC或HR低表达/HER2阴性乳腺癌的疗效和安全性。
SG联合免疫治疗同样在TNBC中进行了积极的探索:III期开放标签、随机研究(NCT05633654)纳入手术和新辅助治疗后仍有侵袭性疾病的TNBC患者,比较SG+帕博利珠单抗与医生选择方案的疗效和安全性;III期开放标签、随机ASCENT-04研究(NCT05382286)评估SG+帕博利珠单抗对比研究者选择方案+帕博利珠单抗一线治疗PD-L1阳性晚期TNBC患者的差异。
期待这些ADC联合免疫的III期研究早日公布阳性结果,也期待在PD-L1阴性人群中ADC联合免疫治疗的确证性研究尽快开展,进一步变革TNBC患者的治疗格局。
专家介绍
刘洁琼 教授
主任医师、博士生导师
中山大学孙逸仙纪念医院乳腺外科主任医师
中山大学孙逸仙纪念医院乳腺中心诊断科副主任
第8届“羊城好医生”,广东省杰出青年医学人才
2017年CSCO“35 under 35”最具潜力肿瘤医生
中华医学会肿瘤分会乳腺学组青年委员
CSCO转化医学专委员会委员
中国抗癌协会肿瘤转移专委会委员
中国抗癌协会乳腺癌专业委员会青年学者
中国康复医学会修复重建外科专委会体表肿瘤学组委员
中国女医师协会专委会常务委员
Front Immunol 客座主编
2008-2010哈佛大学麻省总医院联合培养博士
2014-2015年约翰霍普金斯医院乳腺中心博士后
以第一或通讯作者在PNAS、CCR 、JITC、NC等杂志发表SCI论文37篇,主持科研基金12项

ADC Academy Online
ADC Academy Online是聚焦于抗体偶联药物的学术交流平台。平台紧跟相关领域的最新进展,致力于促进相关专业人士的科学交流和继续医学教育。












 苏公网安备32059002004080号
苏公网安备32059002004080号


