转移性结直肠癌(mCRC)全程管理需在疾病一线、二线、三线及后线治疗中的每一阶段均做到合理、规范的精准诊断及精准治疗,以最大限度地提高患者生存获益。目前,mCRC三线及后线的治疗药物疗效有限,仍存在未被满足的临床需求。初始RAS/BRAF野生型(WT)mCRC患者,抗EGFR单抗再挑战作为三线及后线治疗策略之一备受关注。【肿瘤资讯】特邀青岛大学附属医院吕静教授对抗EGFR单抗再挑战的相关研究进行分享解读。
青岛大学附属医院肿瘤内二科主任
CSCO(中国临床肿瘤学会)理事
CSCO结直肠癌/ 肝癌/ 肿瘤药物安全管理专委会委员
中华结直肠癌MDT联盟副主席/ 青岛分会主任委员
山东卫生人力资源管理协会消化肿瘤MDT人才发展专委会主任委员
北京癌症防治学会结直肠癌防治专委会常务委员
CGCA(中国抗癌协会胃癌专业委员会)青委会委员
中国医师协会结直肠肿瘤专委会青委会委员
山东省抗癌协会常务理事/ 青年理事会副理事长
山东省抗癌协会姑息治疗分会 / 女医师分会副主任委员
山东省抗癌协会消化道肿瘤分会常务委员
山东省研究型医院协会肿瘤转移分会副主任委员
山东省临床肿瘤学会结直肠癌分会常务委员
研究简介[1]
2023 ESMO大会发布了一项个体患者数据汇总(IPD)分析,纳入CRICKET、CAVE、CHRONOS和VELO四项前瞻性II期研究的患者,以更好地了解抗EGFR单抗再挑战在RAS/BRAF WT mCRC持续治疗的潜在作用。
114例循环肿瘤DNA(ctDNA) 检测证实为RAS/BRAF WT mCRC患者纳入分析,其中13例患者接受西妥昔单抗+伊立替康,48例患者接受西妥昔单抗+Avelumab,27例患者接受帕尼单抗,26例患者接受帕尼单抗+TAS-102(图1)。
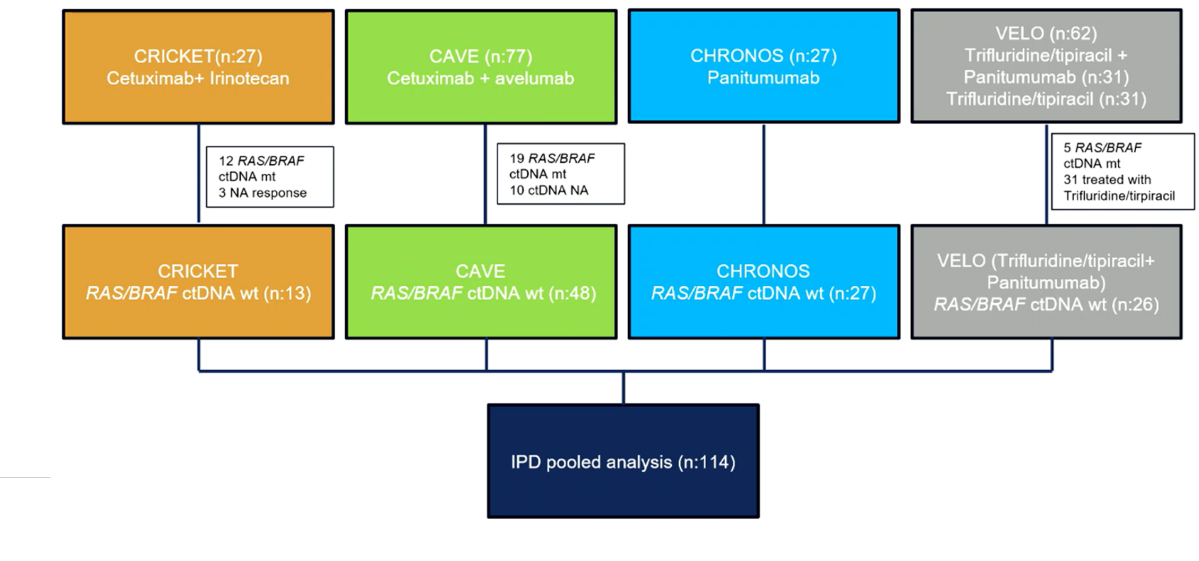
图1:研究设计
研究人群中有83/114(72.8%)和31/114(27.2%)分别在三线或四线接受抗EGFR单抗再挑战治疗(表1)。
表1:基线特征
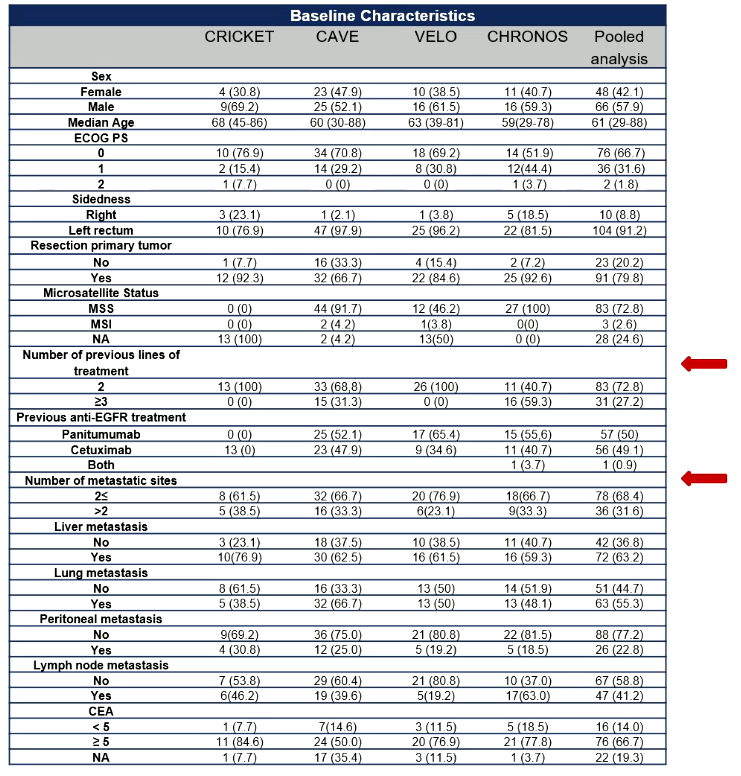
在肿瘤缓解方面(表2),1例患者达到完全缓解(CR),19例患者部分缓解(PR),65例患者疾病稳定(SD),29例患者疾病进展(PD)。客观缓解率(ORR )17.5%,疾病控制率(DCR)74.6%。
表2:肿瘤缓解
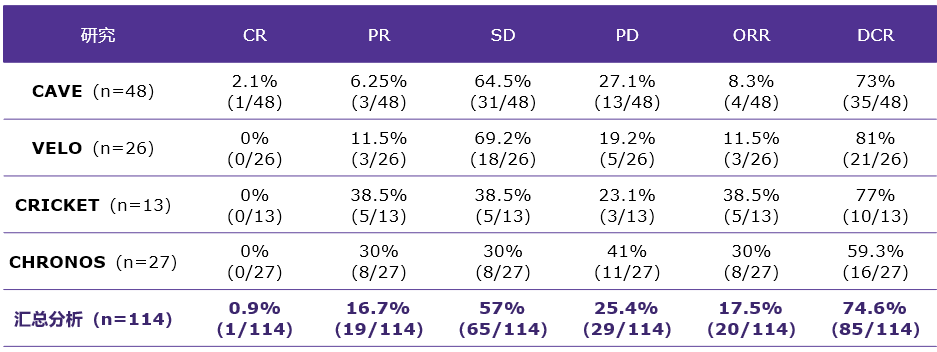
在汇总分析中,中位无进展生存期(mPFS)4.0个月(95%CI,3.2个月~4.7个月),中位生存期(mOS)13.1个月(95%CI,9.5个月~16.7个月)。约1/3患者显著获益于再挑战治疗,表现为6个月PFS率32.5%,18个月OS率36%(图2)。
图2:PFS与OS
无肝转移患者与存在肝转移患者的mPFS 分别为5.7个月和3.6个月(HR: 0.56, 95%CI, 0.37~0.83, p=0.004),mOS分别为17.7个月和 11.5个月(HR: 0.63, 95%CI, 0.41~0.97, p=0.0036)(图3)。
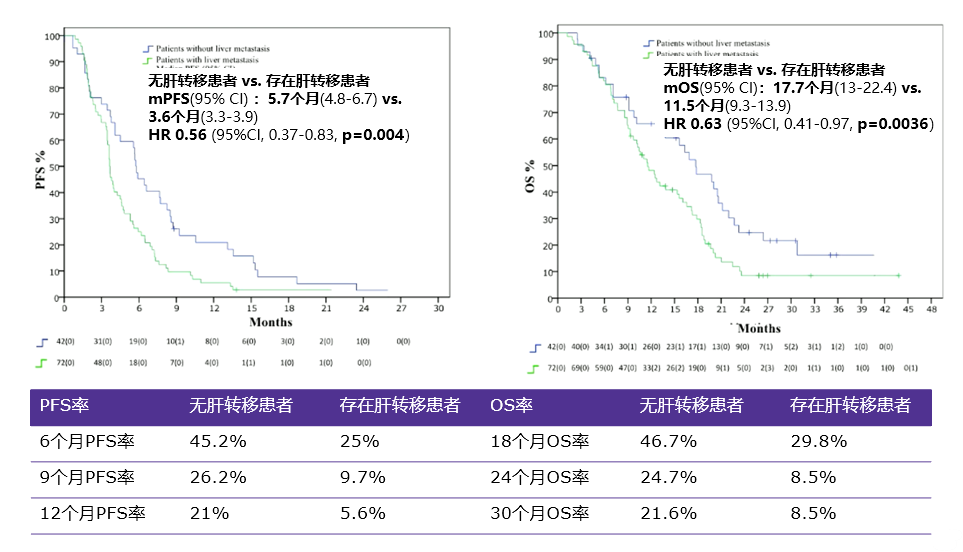
图3:肝转移亚组PFS与OS
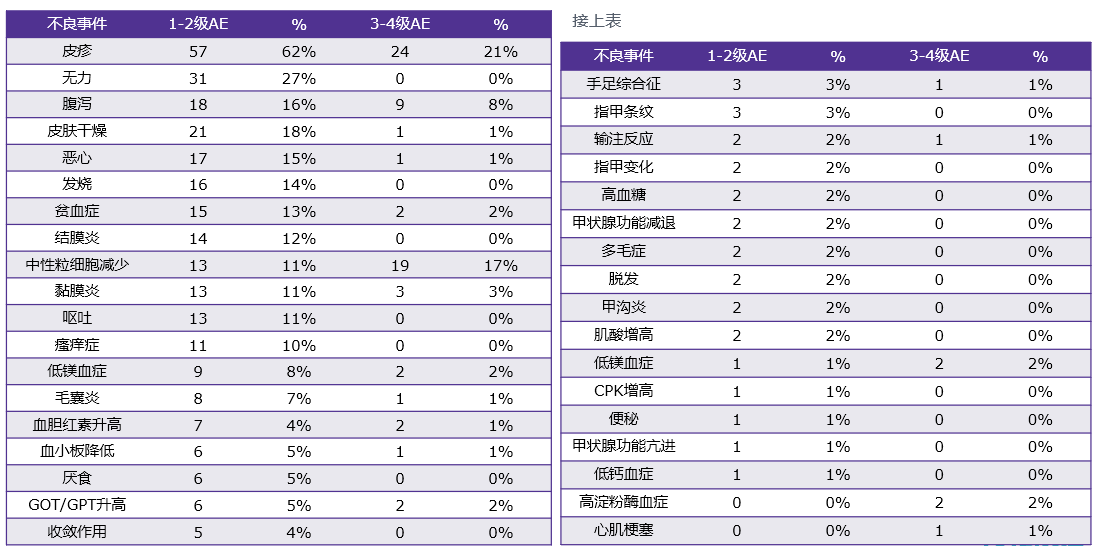
治疗毒性可控,与既往报道一致(表3)。
表3:安全性
IPD汇总分析结果支持抗EGFR单抗用于ctDNA检测为RAS/BRAF WT难治性 mCRC的再挑战治疗。ORR为17.5%,三分之一的患者PFS超过6个月,OS超过18个月;并且在无肝转移患者中观察到更好的生存结局。更多正在进行的研究将进一步确证抗EGFR单抗再挑战的最佳治疗模式以及引入时间。
抗EGFR单抗再挑战治疗理论依据及考虑因素
越来越多的证据表明,RAS WT mCRC患者在既往含抗EGFR单抗治疗获得临床获益后出现疾病进展,接受不含抗EGFR单抗的治疗再次出现疾病进展后,可以选择抗EGFR单抗再挑战治疗。 这种“再挑战”策略的原理是:在基于抗EGFR单抗的一线治疗疾病进展后,中断抗EGFR单抗治疗可导致RAS突变肿瘤细胞克隆衰变,再次恢复肿瘤细胞对抗EGFR单抗的敏感性(图4)[2]。
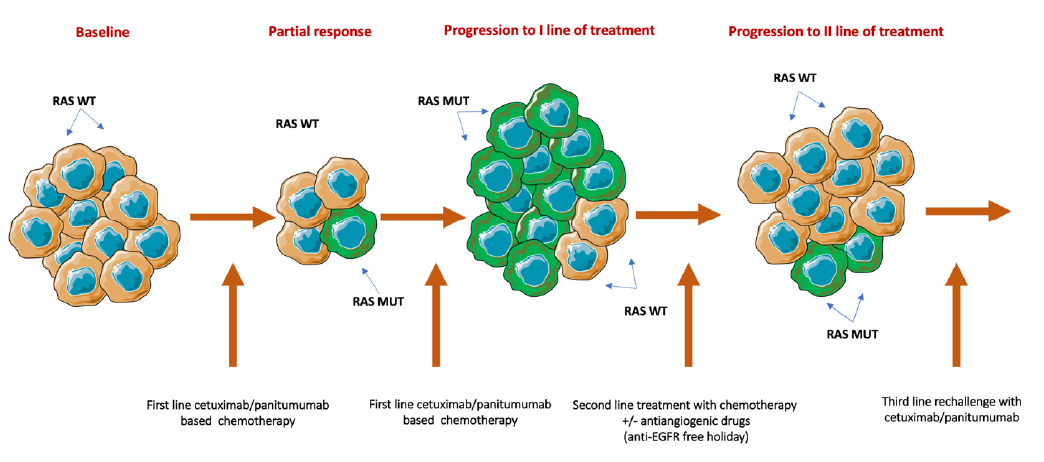
图4:抗EGFR单抗再挑战的生物学原理
自2012年Santini D教授等人[3]首次证实了抗EGFR单抗再挑战的初步价值后,截至目前已有十余项II期研究探索抗EGFR单抗再挑战的疗效[4]。但仍有许多疑问尚待解决,例如再挑战治疗开始时机、最佳治疗方案(如西妥昔单抗/帕尼单抗单药,联合化疗和/或免疫治疗)、患者选择等。
再挑战治疗前的无抗EGFR单抗间期长短仍存在争议,但根据临床前和转化结果,认为至少需要4个月的治疗中断。Parseghian等人[5]表明:停止抗EGFR治疗后,RAS和EGFR突变等位基因频率呈指数衰减,半衰期约4个月。在CAVE和VELO临床试验的汇总分析中[6],抗EGFR药物末次给药后4个月和18个月之间基线血浆ctDNA为RAS/BRAF WT或突变的患者比例没有差异。2020年发表的对接受抗EGFR治疗的86例患者分析数据表明[7],无抗EGFR治疗线数、无抗EGFR时间间隔的长短、原发肿瘤位置、从诊断至再治疗的时间等临床因素与再挑战的缓解率或PFS无关。可见无抗EGFR间期的长度并非患者筛选的充分标准,通过液体活检确认的再挑战前无RAS、BRAF和EGFR突变将更有利于筛选出优势人群。
精准医学依赖于识别肿瘤中的基因组突变,也就是要明确可以提示预后及治疗靶向的生物分子特征。肿瘤组织标本仍是检测肿瘤突变状态的金标准,但在后线治疗的患者中,获得组织活检标本的困难度较高,液体活检无疑是更便捷快速的选择,也因此可作为患者分层和选择的一种有前景的工具。ESMO精准医学工作组和2022 ESMO指南[8-9]指出,在mCRC患者中,当组织检测不可行、需要紧急治疗决策或者考虑抗EGFR单抗再挑战时,可采用液体活检获取基因检测结果。ESMO指南同时指出,在持续RAS WT状态的患者中,抗EGFR单抗再挑战对于特定的患者是一种选择[III,C]。
mCRC中不同抗EGFR单抗再挑战治疗方案的探索
此次2023 ESMO年会披露的IPD分析选取了4项不同再挑战治疗方案的研究,且这4项研究都包含了ctDNA分析。
CRICKET试验[10]是一项II期概念验证研究,旨在研究西妥昔单抗+伊立替康作为三线治疗的再挑战疗效。其主要入选标准的限制性较强,包括:所有RAS/BRAF WT mCRC患者均接受一线抗EGFR单抗+伊立替康为基础的治疗(FOLFIRI或FOLFOXIRI);获得至少PR并且mPFS超过6个月;疾病进展后二线接受含贝伐珠单抗的治疗;接受再挑战治疗前的无抗EGFR单抗间期至少4个月。在意向治疗(ITT)人群中,主要终点ORR 21%,mPFS为3.4个月(95%CI 1.8个月~3.8个月),mOS为9.8个月(95%CI 5.2个月~13.1个月)。在事后分析中,达到确认PR的患者ctDNA中未检测到RAS突变,ctDNA RAS WT患者的PFS显著长于RAS突变型患者,分别为 4.0 vs. 1.9个月(HR: 0.44; 95%CI 0.18~0.98; P=0.03)。基于CRICKET研究结果,2021年CSCO结直肠癌指南[11]三线治疗增加西妥昔单抗±伊立替康(之前接受过西妥昔单抗)[III级推荐,3类]。
CAVE试验[12]在77例难治性mCRC患者中研究抗PD-L1单抗Avelumab联合西妥昔单抗作为再挑战治疗。主要入选标准与CRICKET研究相似。该试验mOS为11.6个月(95%CI:8.4个月~14.8个月),达到了主要终点。mPFS为3.6个月(95%CI,3.2个月~4.1个月)。CAVE试验证实了西妥昔单抗联合免疫药物的可行性,这种联合策略的原理[13-14]在于西妥昔单抗可增强NK细胞介导的抗体依赖性细胞毒性(ADCC),还可富集较多的CD8+的T 淋巴细胞,增加免疫点抑制剂的抗肿瘤活性。
在II期、开放标签、随机对照VELO研究[15-16]中,研究者探索了帕尼单抗联合TAS-102再挑战策略在RAS WT难治性mCRC患者中的应用。研究入组的62例RAS WT难治性mCRC患者曾接受EGFR单抗联合化疗一线治疗且实现PR或CR,并在二线治疗中存在至少4个月的无抗EGFR治疗间隔期。所有患者1:1随机分配接受TAS-102单药治疗或帕尼单抗联合TAS-102治疗。帕尼单抗+TAS-102组的mPFS为4.0个月(95%CI,2.8个月~5.3个月),而TAS-102组为2.5个月(95%CI,1.4个月~3.6个月)[HR: 0.48;95%CI,0.28-0.82;P=0.007],达到了主要终点。TAS-102组的mOS为13.1个月(95%CI 9.5个月~16.7个月),帕尼单抗+TAS-102组为11.6个月(95%CI 6.3个月~17.0个月)[HR: 0.96,95%CI 0.54~1.71,P=0.9]。为了评价后续治疗线数的影响,对TAS-102组疾病进展后接受四线治疗的24例患者进行了亚组分析。17例接受抗EGFR再挑战治疗的患者mPFS为4.1个月(95%CI 1.44个月~6.83个月),7例接受其他治疗的患者为3.0个月(95%CI 1.61个月~4.31个月)(HR: 0.29,95%CI 0.10-0.85,P=0.024)。从四线治疗开始的mOS分别为13.6个月(95%CI 7.2个月~20个月)和5.1个月(95%CI 1.8个月~8.3个月)(HR: 0.30,95%CI 0.11~0.81,P=0.019)。VELO试验最终结果支持抗EGFR再挑战在RAS WT mCRC患者连续治疗中的作用。
CHRONOS试验[17]是首项在液体活检指导下的抗EGFR单抗再挑战的多中心II期研究,共入组27例经ctDNA筛选为RAS、BRAF和EGFR胞外域野生型mCRC患者,给予帕尼单抗单药的再挑战治疗,如果达到30%或以上的缓解率,则认为本研究为阳性。研究达到主要终点,ORR为30%(95%CI 12%~47%),中位缓解时间为17周,mPFS为16周,mOS为55周。研究表明通过ctDNA检测选择合适的mCRC患者是进行帕尼单抗再挑战的有效策略,可最大限度地提高治疗疗效。
对于不同的再挑战治疗策略孰优孰劣,目前尚无定论。在一项对CRICKET和CAVE试验的汇总分析[18]中,西妥昔单抗+伊立替康治疗决定更高的肿瘤缓解(ORR,38.5%);而西妥昔单抗+ avelumab具有更长的生存期(mOS, 18.6个月;21%的患者能活到30个月)。在安全性方面,西妥昔单抗+avelumab时,皮疹更常见,而当西妥昔单抗+伊立替康时,观察到较高的血液学和非血液学毒性发生率。这提示基于不同的临床需求,可选择不同的再挑战治疗方案。
TEC研究[19]旨在探索PD-1抑制剂替雷利珠单抗+西妥昔单抗+伊立替康在经治的RAS WT 中国mCRC患者的疗效和安全性,ORR为36.4%,mPFS为7.3个月,mOS达到17.4个月,并显示出可耐受的安全性。其中87.9%(29/33例)的患者属于抗EGFR单抗再挑战,一定程度上证实了此种联合策略再挑战治疗的可行性。基于TEC研究的良好活性,前瞻性、多中心、随机对照II期TEC2研究(NCT05278351)将进一步在接受过二线系统治疗后的难治性mCRC中,对比替雷利珠单抗+西妥昔单抗+伊立替康与研究者选择的标准三线治疗的疗效差异,目前在进行中。
FIRE-4研究(NCT02934529)则是首项探索西妥昔单抗再挑战的随机III期研究,纳入230例RAS WT mCRC患者,目的是评估伊立替康联合西妥昔单抗对比标准治疗作为RAS WT mCRC患者的三线治疗。患者随机后一线接受FOLFIRI加西妥昔单抗的诱导或持续治疗(获得CR/PR,PFS>6个月),首次进展后进入无抗EGFR药物的二线治疗阶段,待再次进展后进行第二次随机分组,对比伊立替康或FOLFIRI联合西妥昔单抗的再挑战治疗与医生选择的不含抗EGFR药物的治疗方案的疗效。研究主要终点是第二次随机分组后的OS,最终结果是否能再次印证既往再挑战研究的结果让我们拭目以待。
结语
精准医疗时代下,液体活检技术为mCRC患者治疗决策提供了更加客观且坚实的理论依据,在充分的、动态的基因检测指导下,对于每一种药物进行精准合理地排兵布阵,提高治疗的疗效与安全性,进一步丰富患者在三线及后线治疗中的治疗选择尤为重要。期待有更多抗EGFR再挑战研究为结直肠癌患者后线治疗提供更多高水平证据,最终使患者取得更大的生存获益。
[1] Davide Ciardiello , et al. Rechallenge with EGFR inhibitors in ctDNA RAS/BRAF wild-type refractory metastatic colorectal cancer: Individual patients’ data pooled analysis from 4 phase II trials. 2023 ESMO, abstract 559MO.
[2] Ciardiello, D.et al. Biomarker-Guided Anti-Egfr Rechallenge Therapy in Metastatic Colorectal Cancer. Cancers 2021, 13(8), 1941.
[3] Santini D, et al. Cetuximab rechallenge in metastatic colorectal cancer patients: how to come away from acquired resistance? Ann Oncol. 2012 Sep;23(9):2313-2318.
[4] Cremolini C, et al. Rechallenge with anti-EGFR therapy to extend the continuum of care in patients with metastatic colorectal cancer. Front Oncol. 2023 Feb 2;12:946850.
[5] Parseghian, C. et al. Anti-EGFR Resistant Clones Decay Exponentially After Progression: Implications for Anti-EGFR Re-challenge. Ann. Oncol. 2019, 30,243–249.
[6] Ciardiello D, et al. Pretreatment Plasma Circulating Tumor DNA RAS/BRAF Mutational Status in Refractory Metastatic Colorectal Cancer Patients Who Are Candidates for Anti-EGFR Rechallenge Therapy: A Pooled Analysis of the CAVE and VELO Clinical Trials. Cancers (Basel). 2023 Apr 1;15(7):2117.
[7] Rossini D, et al. Retreatment with anti-EGFR antibodies in metastatic colorectal cancer patients: a multiinstitutional analysis. Clin Colorectal Cancer. 2020 Sep;19(3):191-199.e6.
[8] Pascual J, et al. ESMO recommendations on the use of circulating tumour DNA assays for patients with cancer: a report from the ESMO Precision Medicine Working Group. Ann Oncol. 2022 Aug;33(8):750-768.
[9] Cervantes A, et al. ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2023 Jan;34(1):10-32.
[10] Cremolini, C, et al.Rechallenge for Patients with RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan. JAMA Oncol. 2019, 5, 343–350.
[11]《中国临床肿瘤学会(CSCO)结直肠癌诊疗指南》(2021)
[12] Martinelli, E. et al. Cetuximab Rechallenge Plus Avelumab in Pretreated Patients With RAS Wild-type Metastatic Colorectal Cancer: The Phase 2 Single-Arm Clinical CAVE Trial. JAMA Oncol. 2021 Oct 1;7(10):1529-1535.
[13] Ferris RL, et al. Rationale for combination of therapeutic antibodies targeting tumor cells and immune checkpoint receptors: Harnessing innate and adaptive immunity through IgG1 isotype immune effector stimulation. Cancer Treat Rev. 2018 Feb;63:48-60.
[14] Kubach J, et al. IgG1 anti-epidermal growth factor receptor antibodies induce CD8-dependent antitumor activity. Int J Cancer. 2015 Feb 15;136(4):821-30.
[15] Napolitano S, et al. Panitumumab Plus Trifluridine-Tipiracil as Anti-Epidermal Growth Factor Receptor Rechallenge Therapy for Refractory RAS Wild-Type Metastatic Colorectal Cancer: A Phase 2 Randomized Clinical Trial. JAMA Oncol. 2023 Jul 1;9(7):966-970.
[16] Napolitano S, et al. Panitumumab plus trifluridine/tipiracil as anti-EGFR rechallenge therapy in patients with refractory RAS wild-type metastatic colorectal cancer: Overall survival and subgroup analysis of the randomized phase II VELO trial. Int J Cancer. 2023 Oct 15;153(8):1520-1528.
[17] Sartore-Bianchi A, et al. Circulating tumor DNA to guide rechallenge with panitumumab in metastatic colorectal cancer: the phase 2 CHRONOS trial. Nat Med. 2022 Aug;28(8):1612-1618.
[18] Martini G, et al. Cetuximab as third-line rechallenge plus either irinotecan or avelumab is an effective treatment in metastatic colorectal cancer patients with baseline plasma RAS/BRAF wild-type circulating tumor DNA: Individual patient data pooled analysis of CRICKET and CAVE trials. Cancer Med. 2023 Apr;12(8):9392-9400.
[19] Xiaojing Xu, et al. Efficacy and safety of tislelizumab plus cetuximab and irinotecan in patients with previously treated RAS wild-type advanced colorectal cancer: A phase II, single-arm study. 2023 ASCO GI, abstract125.
排版编辑:肿瘤资讯-Hana











 苏公网安备32059002004080号
苏公网安备32059002004080号


