三阴性乳腺癌(TNBC)是一类异质性较高的恶性肿瘤,转移率高、预后较差,长期缺乏有效的精准治疗手段,复发/难治型TNBC治疗手段更是有限,联合化疗带来的不良反应也将极大影响患者的生活质量,临床亟需更有效的治疗手段。近年来,抗体偶联药物(ADC)在乳腺癌中的探索取得了突破性成果,并已经逐渐进入临床应用。不久前落幕的2023年欧洲肿瘤内科学会(ESMO)年会中,多款ADC都已报告了最新研究成果,吸引了领域内的关注。本次,【肿瘤资讯】特邀中山大学孙逸仙纪念医院刘洁琼教授为大家领读、回顾2023 ESMO乳腺癌领域ADC研究进展,以其启迪临床管理。
中山大学孙逸仙纪念医院乳腺外科主任医师
中山大学孙逸仙纪念医院乳腺中心诊断科副主任
第8届“羊城好医生”,广东省杰出青年医学人才
2017年CSCO“35 under 35”最具潜力肿瘤医生
中华医学会肿瘤分会乳腺学组青年委员
CSCO转化医学专委员会委员
中国抗癌协会肿瘤转移专委会委员
中国抗癌协会乳腺癌专业委员会青年学者
中国康复医学会修复重建外科专委会体表肿瘤学组委员
中国女医师协会专委会常务委员
Front Immunol 客座主编
2008-2010哈佛大学麻省总医院联合培养博士
2014-2015年约翰霍普金斯医院乳腺中心博士后
以第一或通讯作者在PNAS、CCR 、JITC、NC等杂志发表SCI论文37篇,主持科研基金12项
戈沙妥珠单抗
射向TNBC的“魔法子弹”,开拓ADC治疗新领域
ADC作为一类新型靶向生物制剂,将具有肿瘤抗原特异性的单克隆抗体与具有细胞毒性的有效载荷通过连接子偶联而成,兼具单克隆抗体的靶向性、特异性与化疗药物的抗肿瘤活性,且由于作用更精准,较传统化疗药物毒性更低,因此被称为肿瘤治疗中的“魔法子弹”。
近年来,靶向TROP2的ADC在TNBC中的探索取得了丰富的成果,其中,戈沙妥珠单抗(SG)已经在晚期TNBC患者的后线治疗中获得临床应用。在一项II期、单臂、篮子试验IMMU-132-01中,总计纳入了 108 例经过多线治疗的晚期或转移性TNBC患者,接受SG治疗,客观缓解率(ORR)达到 33.3%,临床获益率(CBR)为 45.4%,中位缓解持续时间(mDOR)为 7.7 个月,中位无进展生存期(PFS) 为 5.5 个月、中位总生存期(OS)为 13.0 个月[1]。而在2022年ESMO ASIA报告的中国桥接研究EVER-132-001中,观察到与全球人群一致的获益,ORR达到38.8%,中位PFS为5.55个月[2]。
基于该研究结果,SG获FDA加速批准适用于既往接受过至少 2 种系统治疗的不可切除的局部晚期或转移性TNBC患者。后续开展的确证性III期研究ASCENT中,SG再次巩固了其疗效表现[3],在这项国际多中心、随机、对照、Ⅲ 期临床研究中,针对紫杉类经治后进展的晚期TNBC患者,SG对比医生选择方案(TPC)显著显著改善了基线无脑转移人群的中位PFS(5.6个月 vs. 1.7个月,HR 0.39;P<0.001)与中位OS(12.1个月 vs. 6.7个月,HR 0.48;P<0.0001)。
2022 年 6 月,中国国家药品监督管理局基于 EVER-132-001 研究正式批准 SG 在国内的上市申请,用于既往至少接受过 2 种系统治疗(其中至少 1 种治疗针对转移性疾病)的不可切除的局部晚期或转移性TNBC成人患者。
2023 ESMO全面回顾
ADC在乳腺癌领域的深入探索
不久前结束的ESMO大会中,包括SG在内,多种ADC的前沿进展吸引了全球研究者的关注。在乳腺癌领域,SG、T-DXd、Dato-DXd及SKB264都报告了重磅研究成果。
SG
SG在本次ESMO大会更新了III期临床研究TROPiCS-02的事后分析[4]。这项研究纳入了局部复发无法手术或远处转移、早期或晚期接受过内分泌治疗和紫杉类化疗以及CDK4/6抑制剂治疗、晚期接受过2-4种化疗方案的HR+/HER2-乳腺癌患者,探索SG对比TPC的疗效和安全性差异。研究按照既往经治化疗线数(LoT)分层进行了探索。
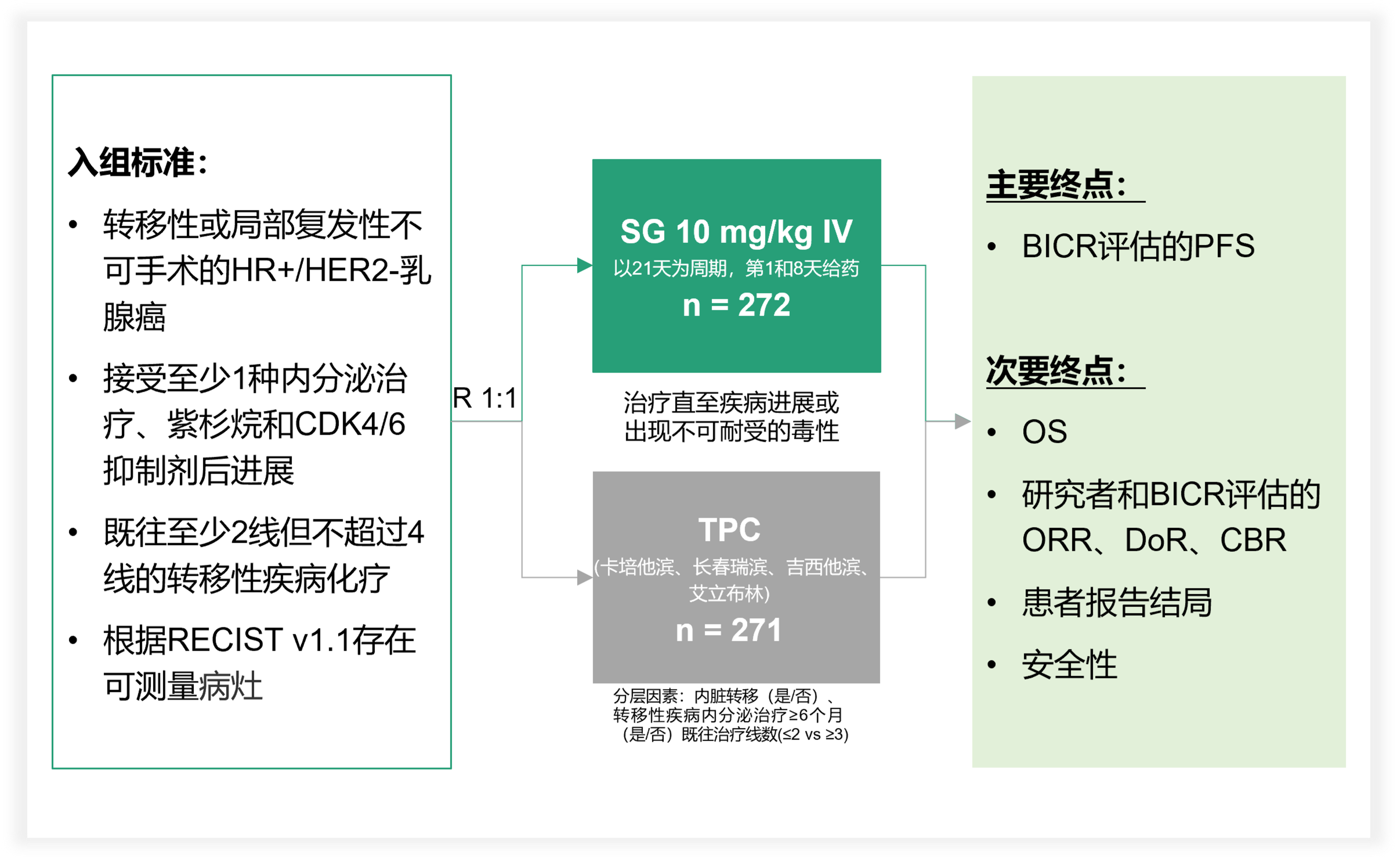
图1. TROPiCS-02研究设计
结果显示,既往LoT≤2的患者中,SG组和TPC组的中位PFS分别为5.7个月和4.2个月(HR 0.62),可降低疾病进展或死亡风险38%,中位OS分别为15.5个月和12.5个月(HR 0.85);既往LoT≥3的患者中,SG组合和TPC组的中位PFS分别为5.3个月和3.7个月(HR 0.70),可降低30%的疾病进展或死亡风险,中位OS分别为13.9个月和10.3个月(HR 0.75)。无论LoT如何,SG相比TPC都改善了PFS和OS。肿瘤缓解方面,在LoT≤2的患者中,SG相较于TPC改善了ORR(30% vs. 18%,OR 2.03),无论LoT如何,SG均相较于TPC改善了临床获益率(CBR)。
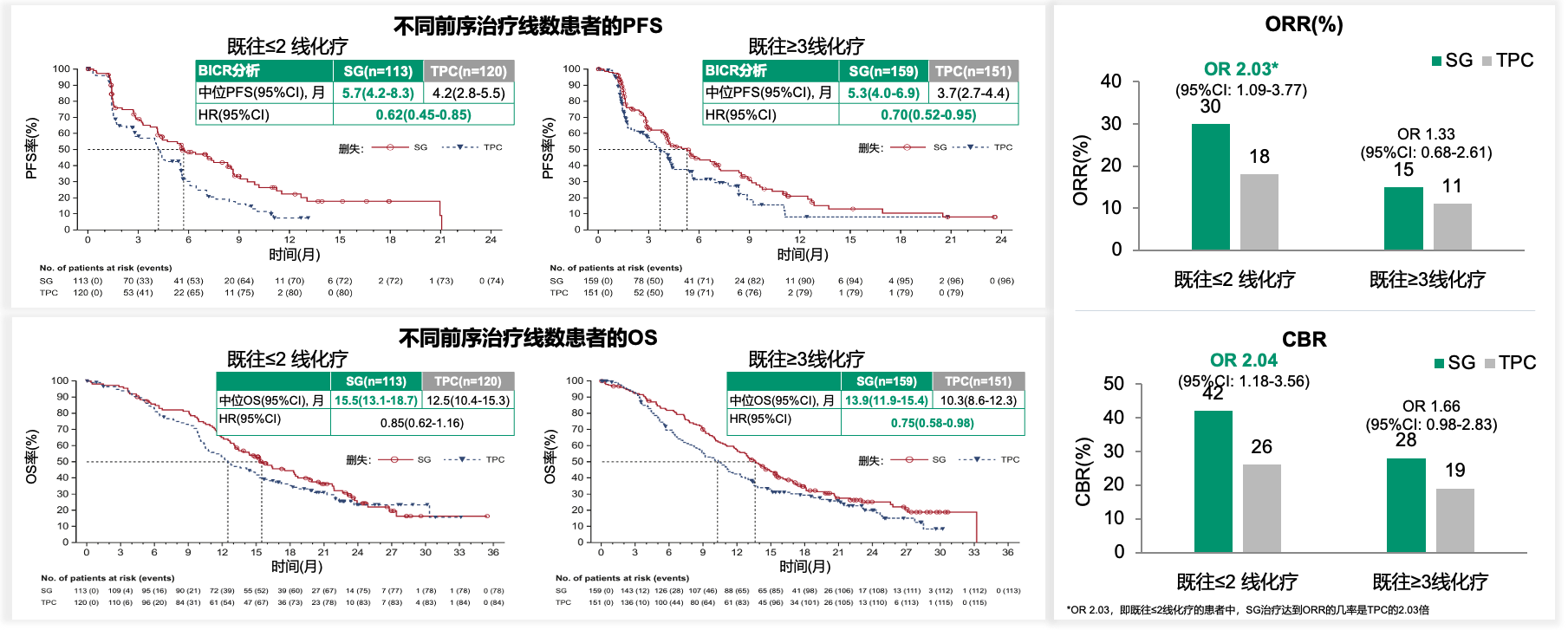
图2. 不同既往经治线数亚组分析中SG与TPC的疗效对比
虽然SG组较TPC组有更高的≥3级治疗期间不良事件(TEAE)发生率,但无论既往LoT如何,均相对可控,中性粒细胞减少和腹泻是最常见的TEAEs。本次亚组分析提示,无论既往经治线数如何,SG在HR+/HER2-晚期乳腺癌患者中疗效均优于TPC,且可控,研究结果与ITT人群一致。
此外,SG还报告了针对TNBC患者的多项真实世界研究数据[5,6]。一项美国回顾性分析纳入了230例接受SG治疗的转移性TNBC患者,其中二线治疗患者的真实世界中位OS达到13.9个月,三线患者则为8.4个月。二线患者和三线患者的12个月OS率分别为51%和35%,24个月OS率分别为32%和20%,中位PFS分别为4.9个月和3.5个月,提示在二线应用SG有望取得较三线使用更好的疗效。
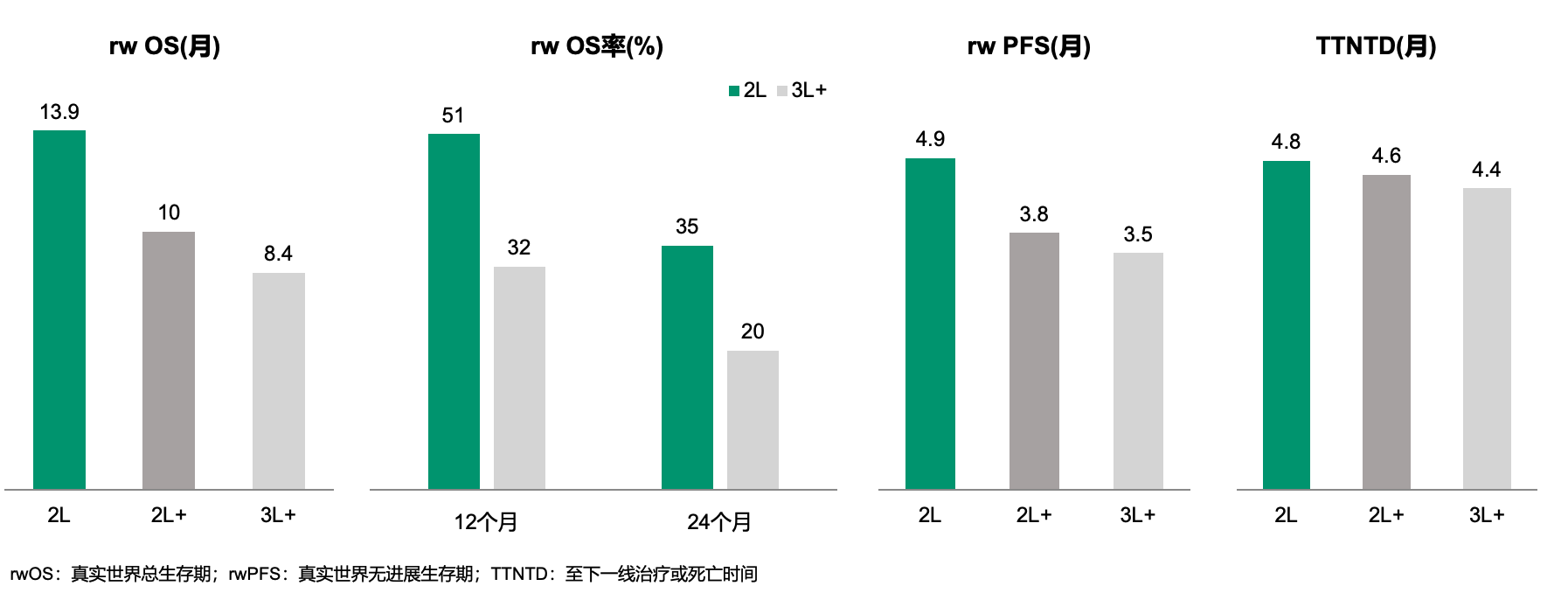
图3. 真实世界中SG二线应用取得较后线使用更好的疗效表现
另一项单中心回顾性分析纳入了126例接受SG治疗的转移性TNBC患者,其中69.8%的患者在治疗前有内脏转移,23%的患者在治疗前有中枢神经系统转移,患者既往接受的中位转移性疾病治疗线数为两线,最高为八线。接受SG治疗后,中位PFS达到了3个月,CBR为59.5%,中位OS达到了21个月。这两项真实世界研究都验证了SG在重度经治的TNBC患者中的疗效。
安全性方面,SG也在本次大会报告了一项安全性meta分析[7]。共纳入了999例患者(SG:526例,化疗:473例),研究中显示,对比化疗,SG导致中性粒细胞减少症、白细胞减少症、贫血等风险显著升高,但治疗中止和发热性中性粒细胞减少等无显著性差异,结合SG的显著生存获益,支持SG作为转移新乳腺癌的重要治疗选择。
Dato-DXd
Dato-DXd的TROPION-Breast01以LBA形式亮相[8]。这项全球、随机、多中心、开放标签Ⅲ期临床研究旨在评估Dato-DXd对比研究者选择的单药化疗(ICC,艾立布林、卡培他滨、长春瑞滨或吉西他滨)在既往内分泌治疗进展或不适合内分泌治疗(必须至少接受过1种系统性治疗方案)的不可手术切除或转移性HR+/HER2-低表达或阴性(IHC 0,1+或IHC 2+/ISH-)晚期乳腺癌患者中的疗效与安全性。本次报告结果显示,研究成功到达双终点之一的PFS终点,Dato-DXd组相比ICC组,显著改善了经BICR评估的中位PFS(6.9个月 vs 4.9个月,HR 0.63;95%CI,0.52-0.76;p<0.0001),取得了更好的ORR表现(36.4% vs. 22.9%)。
安全性方面,Dato-DXd耐受性良好,最常见的治疗相关不良反应(TRAEs)为恶心和口腔炎,多数为1~2级,不过有9例(3%)患者发生了不同级别的间质性肺炎(ILD),其中包括2例≥3级ILD。
Dato-DXd同样在TNBC治疗中进行了探索[9]。BEGONIA研究一项正在进行的多中心、多臂、开放标签的Ⅰb/Ⅱ期临床试验,旨在评估度伐利尤单抗联合包括Dato-DXd在内的多种疗法用于晚期/转移性TNBC的一线治疗。在Dato-DXd的队列7中,共62例患者接受Dato-DXd+度伐利尤单抗治,中位随访时间为11.7个月。Dato-DXd+度伐利尤单抗治疗的ORR达到了79%,中位持续缓解时间(DoR)为15.5个月,中位PFS为13.8个月。安全性方面,最常见的不良事件(AE)是恶心(40%)和口腔炎(40%),35例(57%)患者发生任意3/4级AE,没有与治疗相关AE的死亡病例。未报告新的安全信号。
T-DXd
HER2-ADC T-DXd在本次ESMO大会中更新了DESTINY-Breast04研究的相关数据,及其在多项研究中针对脑转移患者的疗效和安全性[10-12]。DESTINY-Breast04研究是首个针对HER2低表达人群进行的Ⅲ期临床研究,这项开放性、多中心、随机对照、III期临床试验旨在对比T-DXd与TPC治疗既往接受过1-2线化疗的HR+或HR-、HER2低表达的不可切除和(或)转移性乳腺癌患者。本次ESMO大会中,DB-04研究更新了中位随访32个月的生存数据, 在HR+队列人群中,T-DXd组经BICR评估的中位OS达23.9个月,中位PFS为9.6个月,总人群中的中位OS则达到22.9个月,中位PFS达到8.8个月,与此前初步分析报告结果相似,且都取得了较TPC组更优的表现。在HR-患者中,中位OS为17.1个月(初步分析中为18.2个月),中位PFS为6.3个月(初步分析中为8.5个月),仍然优于TPC组。安全性方面,整体与初步分析结果一致,T-DXd组严重治疗期间不良反应(TEAEs)的发生率为29.1%,TPC组为25.6%,导致停药的TEAEs发生率则分别为16.7%和8.1%,其中,T-DXd组导致停药的最常见TEAEs为研究者评估的ILD(10.2%),导致减量的最常见TEAEs为恶心(4.6%)和血小板技术降低(3.0%)。T-DXd组中15例(4.0%)的患者因为TEAEs导致死亡,TPC组为5例(2.9%)。在同时更新的多项脑转移患者的分析中,在DB01、DB02、DB03、DB04研究中,T-DXd显示了对于HER2+及HER2低表达患者的颅内疗效。
SKB264
尚未上市的ADC SKB264报告了其在既往至少接受一线化疗的HR+/HER2-患者中的I/II期单臂、篮子研究的结果[13]。中位随访时间为8.2个月,在38例疗效可评估的患者中,SKB264单药治疗的ORR达到36.8%,DCR为89.5%,中位PFS达到了11.1个月。研究中17.1%的患者因为治疗相关不良事件(TRAE)而导致剂量降低,无TRAE导致停药和死亡。
ADC广泛拓展应用场景
为更多乳腺癌患者带来福音
本次ESMO大会过后,结合临床研究及真实世界数据看来,ADC在乳腺癌领域已经全面铺开,在HR+/HER2-、HER2+及TNBC三大分子分型中,ADC都展示了极具希望的应用前景。目前,SG除已在国内外获批适用于晚期TNBC的后线治疗外,也已经于2023年2月获FDA批准适用于HR+/HER2-患者的后线治疗。未来,相信包括SG在内的ADC在乳腺癌领域将有望获得更多应用,有望为更多患者带来福音。
排版编辑:Yuki
[1] Bardia A, Mayer I A, Vahdat L T, et al. Sacituzumab govitecan-hziy in refractory metastatic triple-negative breast cancer[J]. New England Journal of Medicine, 2019, 380(8): 741-751.
[2] B.Xu, F.Ma, S.Wang, et al. Efficacy and safety of sacituzumab govitecan in Chinese patients with metastatic triple-negative breast cancer (mTNBC) by baseline HER2 expression level: Subgroup analysis from a phase IIb trial.2023 ESMO Asia Congress,22MO.
[3] Bardia A, Tolaney SM, Loirat D, et al. Sacituzumab Govitecan Versus Treatment of Physician's Choice in Patients With Previously Treated Metastatic Triple-Negative Breast Cancer: Final Data From the Phase 3 ASCENT Study. 2022 ASCO. 1071.
[4] Javier Cortés, et al. Efficacy and safety analyses by prior lines of chemotherapy from the phase III TROPiCS-02 study of sacituzumab govitecan (SG) vs treatment of physician’s choice (TPC) in patients (pts) with HR+/HER2- metastatic breast cancer (mBC). 2023 ESMO. 389P.
[5] Kevin Kalinsky, et al. Real-world (RW) use patterns, effectiveness, and tolerability of sacituzumab govitecan (SG) for second-line (2L) and later treatment of metastatic triple-negative breast cancer (mTNBC). 2023 ESMO. 393P.
[6] Elaine M. Walsh, et al. Aspire to ASCENT: Real-world outcomes from patients with metastatic triple-negative breast cancer (mTNBC) treated with Sacituzumab govitecan (Saci) in a single academic institution. 2023 ESMO. 419P.
[7] Alessandro Rizzo, et al. Sacituzumab govitecan versus chemotherapy for metastatic breast cancer: A meta-analysis on safety outcomes. 2023 ESMO. 412P.
[8] Aditya Bardia, et al. Datopotamab deruxtecan (Dato-DXd) vs chemotherapy in previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2–) breast cancer (BC): Primary results from the randomised phase III TROPION-Breast01 trial. 2023 ESMO. LBA11.
[9] Peter Schmid, et al. Datopotamab deruxtecan (Dato-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic triple-negative breast cancer (a/mTNBC): Updated results from BEGONIA, a phase Ib/II study. 2023 ESMO. 379MO.
[10] Shanu Modi, et al. Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice (TPC) in patients (pts) with HER2-low unresectable and/or metastatic breast cancer (mBC): Updated survival results of the randomized, phase III DESTINY-Breast04 study. 2023 ESMO. 376O.
[11] Sara A. Hurvitz, et al. A pooled analysis of trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-positive (HER2+) metastatic breast cancer (mBC) with brain metastases (BMs) from DESTINY-Breast (DB) -01, -02, and -03. 2023 ESMO. 377O.
[12] Junji Tsurutani, et al. Subgroup analysis of patients (pts) with HER2-low metastatic breast cancer (mBC) with brain metastases (BMs) at baseline from DESTINY-Breast04, a randomized phase III study of trastuzumab deruxtecan (T-DXd) vs treatment of physician’s choice (TPC). 2023 ESMO. 388P.
[13] Yongmei Yin, et al. SKB264 (MK-2870) in previously treated hormone receptor-positive (HR+)/ HER2-negative metastatic breast cancer (mBC): Results from a phase I/II, single-arm, basket trial. 2023 ESMO. 380MO.











 苏公网安备32059002004080号
苏公网安备32059002004080号


