*以下内容仅供医学药学专业人士阅读参考,如您非前述专业人士,请离开本页。
2023年欧洲内科学肿瘤学会(ESMO)已于欧洲中部夏令时间10月20日在西班牙马德里拉开序幕。ESMO年会是世界上规模最大、学术水平最高、最具权威性和影响力的国际肿瘤会议之一。本次大会一如既往云集了全球肿瘤学领域最前沿的进展、带来了新的获益希望。BRAF基因是恶性肿瘤的驱动基因之一。BRAF蛋白与KRAS蛋白同为RAS-RAF-MEK活化的细胞外信号调节激酶,调控下游MAPK/ERK信号,在肿瘤的发生、发展中发挥着重要的作用。BRAF基因改变包括BRAF体细胞错义突变(主要)、BRAF胚系突变和BRAF融合。其中BRAF突变是多种实体瘤的重要治疗靶点之一,以BRAF抑制剂为代表的靶向联合疗法已成为多种BRAF突变阳性实体瘤的主要治疗手段之一。【肿瘤资讯】特邀苏州大学附属第一医院陶敏教授梳理了本次ESMO 2023会议更新的BRAF突变实体瘤治疗领域的重磅数据内容与君共享,详情如下。
苏州大学附属第一医院肿瘤科临床首席专家
中国临床肿瘤学会(CSCO)理事
中国医师协会中西结合医师分会肿瘤病学专业委员会常务委员
中国生物医学工程学会肿瘤分子靶向治疗专业委员会常务委员
中国临床肿瘤学会非小细胞肺癌专家委员会常务委员
江苏省医学会肿瘤学分会副主任委员
江苏省中西医学会肿瘤专业委员会副主任委员
江苏省免疫学会肿瘤免疫专业委员会副主任委员
江苏省抗癌协会肿瘤复发与转移专业委员会副主任委员
江苏省医学会肿瘤学分会肺癌学组组长
《中华肿瘤防治杂志》编委
《国际肿瘤学杂志》编委
研究摘要
1. Pan-RAF抑制剂+MEK抑制剂靶向联合治疗在BRAF II/III类突变/融合阳性肿瘤患者中展现持久获益1
2023 ESMO. 摘要号661MO
中文标题:Belvarafenib联合Cobimetinib在晚期携带BRAF融合和BRAFⅡ类/Ⅲ类突变中的抗肿瘤活性
英文标题:Anti-tumor activity of belvarafenib in combination with cobimetinib in patients with metastatic solid tumors harboring BRAF fusions or BRAF class II/III mutation
研究背景:Belvarafenib(Belva)是一种II型选择性RAF二聚体抑制剂,与Cobimetinib(Cobi)联合使用已在NRAS突变黑色素瘤患者中显示出临床活性(ASCO 2021,ESMO 2021)。亚组队列A(SC-A)入组BRAF融合,亚组队列B(SC-B)入组II/III类突变,该研究介绍Belva和Cobi在BRAF变异中的疗效性和安全性。
研究方法:共有23名携带BRAF变异的患者入组并接受Belva 300mg PO BID和Cobi 20mg PO TIW(每周3次)治疗(NCT03284502)。亚队列A(SC-A)招募了BRAF融合患者,亚队列B(SC-B)招募了BRAF II/III类突变患者。安全性结果基于截至2023年1月31日接受Belva和Cobi治疗的133名患者进行分析。
研究结果:在SC-A中,共有15例携带BRAF融合的患者(黑色素瘤(10例),NSCLC(3例),CRC(1例),胰腺癌(1例));在SC-B中,8例BRAFII/III类突变患者(胆道癌(3例),CRC(3例),SCLC(1例),胶质母细胞瘤(1));经研究者评估,SC-A的确认客观缓解率(ORR)为60.0%,中位无进展生存期(mPFS)为13.7个月,中位缓解持续时间为12.0个月(95%CI:7.43至22.34),而SC-B患者表现出疾病稳定的最佳反应;截至截止日期,最常见的治疗相关不良事件是痤疮样皮炎(54.1%),皮疹(28.6%)和血肌酸磷酸激酶升高(24.1%),未发现新的安全信号。
研究结论:Belva与Cobi的组合在BRAF融合患者中显示出较好的抗肿瘤活性以及持久的反应。
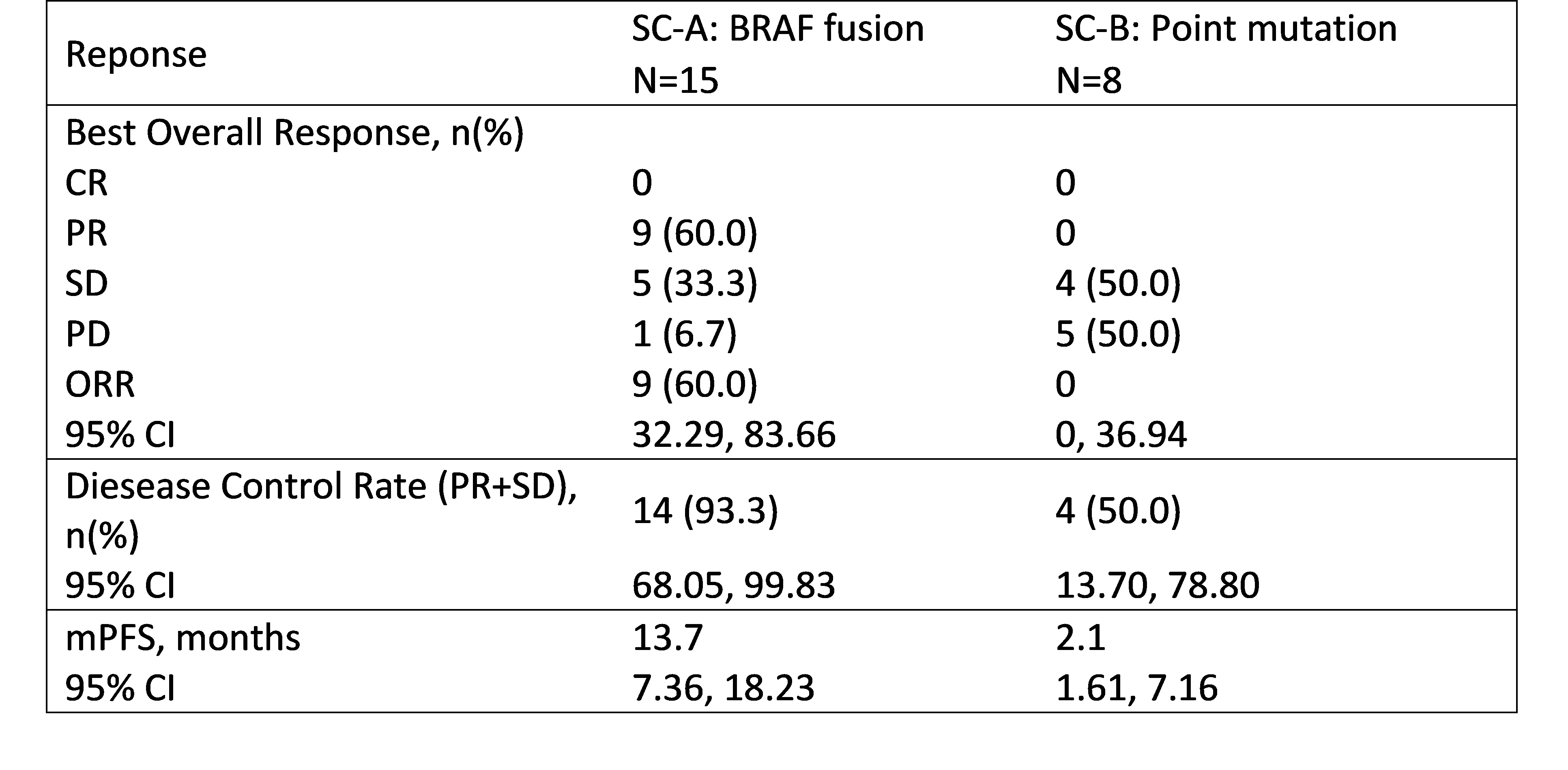
2. 高选择性MEK1 / 2抑制剂tunlametinib(HL-085)联合维莫非尼靶向治疗有望成为BRAF V600突变实体瘤患者治疗选择2
2023 ESMO. 摘要号1378P
中文标题:一期、多中心探讨HL-085联合维莫非尼在BRAF V600突变人群中有效性和安全性探索
研究背景:在BRAF抑制剂联合MEK抑制剂可增强抗肿瘤活性,延迟BRAF V600突变肿瘤中MAPK通路的获得性耐药性。我们评估了tunlametinib(HL-085)联合HL-085联合维莫非尼的安全性和有效性,这是一种新型高选择性MEK1 / 2抑制剂,与维莫非尼联合用于晚期BRAF突变实体瘤患者。
研究方法:在这项I期研究中,招募了患有晚期实体瘤且标准治疗进展或不耐受的患者,并在剂量递增阶段接受了递增剂量的HL-085联合维莫非尼(遵循3 + 3设计)。患者在21天周期内接受剂量水平为0.5,6,9,12和15mg BID的HL085以及维莫非尼960mg BID。在剂量扩展阶段,评估HL085 12mg + 维莫非尼960mg,HL085 12mg + 维莫非尼720mg和HL085 9mg + 维莫非尼720mg剂量组。其中HL085 9mg+维莫非尼720mg被确定为推荐的2期剂量(RP2D)。
研究结果:截至 2022 年 11 月 4 日,共招募了 72 名实体瘤患者。最常见的不良事件是磷酸激酶升高,贫血和皮疹,主要为1/2级。在33 例非小细胞肺癌(NSCLC)患者中,客观缓解率(ORR)为60.6%(95%CI:42.1%,77.1%),中位缓解持续时间(DoR)为11.3个月(95%CI:3.9,NE),中位无进展生存期(PFS)为11.7个月(95%CI:5.6,NE)。在RP2D阶段,ORR为60.0%(95%置信区间:32.3%,83.7%),mPFS为10.4个月(95%置信区间:5.6,NE)。所有剂量的24名转移性结直肠癌(mCRC)中,ORR为25.0%(95%CI:9.8%,46.7%),mDoR为5.5个月(95%CI:2.9,NE),mPFS为6.2个月(95%CI:4.8,7.6)。同样,在甲状腺状癌和胰腺癌中也观察到抗肿瘤活性。
研究结论:HL-085联合维莫非尼在BRAF V600突变实体瘤中显示出较好的抗肿瘤活性和可控的安全性。进一步的研究正在进行中。本研究是国内的新型MEK抑制剂联合BRAF V600E双靶抑制剂在BRAF V600E突变的实体瘤中的探索,入组最多的瘤种为NSCLC,在结直肠癌和甲状腺癌中均有一定抗肿瘤活性。此项研究为一期计量爬坡试验,仍需后续扩大人群研究观察临床疗效及安全性数据。
3. 真实世界研究结果令人鼓舞!一线靶向治疗是晚期NSCLC伴BRAF和MET exon14跳突的首选3
2023 ESMO. 摘要号1394P
中文标题:非小细胞肺癌中携带BRAF和MET exon14跳突的真实世界研究
英文标题:Real-world experience in treatment of patients with non-small cell lung cancer with BRAF and cMET Exon 14 skipping mutations
研究背景:BRAF和MET exon14跳突是NSCLC的少见突变,该研究主要探讨两类患者一线和二线治疗选择。
研究方法:我们为携带BRAF和MET exon14跳突的晚期NSCLC患者(pts)创建了数据库,筛选从2017年1月至2022年6月患者,不包括参加临床试验的患者。收集临床病理和分子数据,并记录治疗模式。使用Kaplan-Meier曲线和Cox回归模型评估根据治疗分配的临床终点。
研究结果:来自5个国家7个中心的58名患者的数据被纳入最终分析,40例患者有cMET外显子14跳跃突变,18例有BRAF V600突变;中位年龄66.7岁(范围:36.0-91.0),女性(48.0%),从不或既往吸烟者(71.0%),体能状态PS=0-1(84.0%),腺癌(86.2%),诊断时IIIC期-IV期(82.2%),骨和脑转移(分别为45.0%和21.0%)。所有中心的突变均通过NGS统一诊断,PD-L1表达为TPS<1%(18%),1%-49%(34%),≥50%(48%);其中52.8%接受一线靶向治疗(TT),53.5%接受二线治疗。TT与其他(IO +/- CT)一线治疗的总缓解率(ORR)和疾病控制率(DCR)分别为55.6%和21.7%(p = 0.0084)和66.7%对39.1%(p = 0.04)。一线治疗类型(TT vs. IO +/- CT)影响治疗停止时间(TTD),11.6 m vs. 4.6 m,p=0.006。总生存为15.4m,TT VS. IO +/- CT(19.2m VS 13.5m,p=0.83)无统计学差异,担但有数字上优势趋势。
研究结论:这项真实世界的回顾性研究表明,由于较高的ORR和DCR,更长的TTD以及几乎一半的患者没有接受二线治疗,因此一线TT是治疗晚期NSCLC伴BRAF和MET exon14跳突的首选。
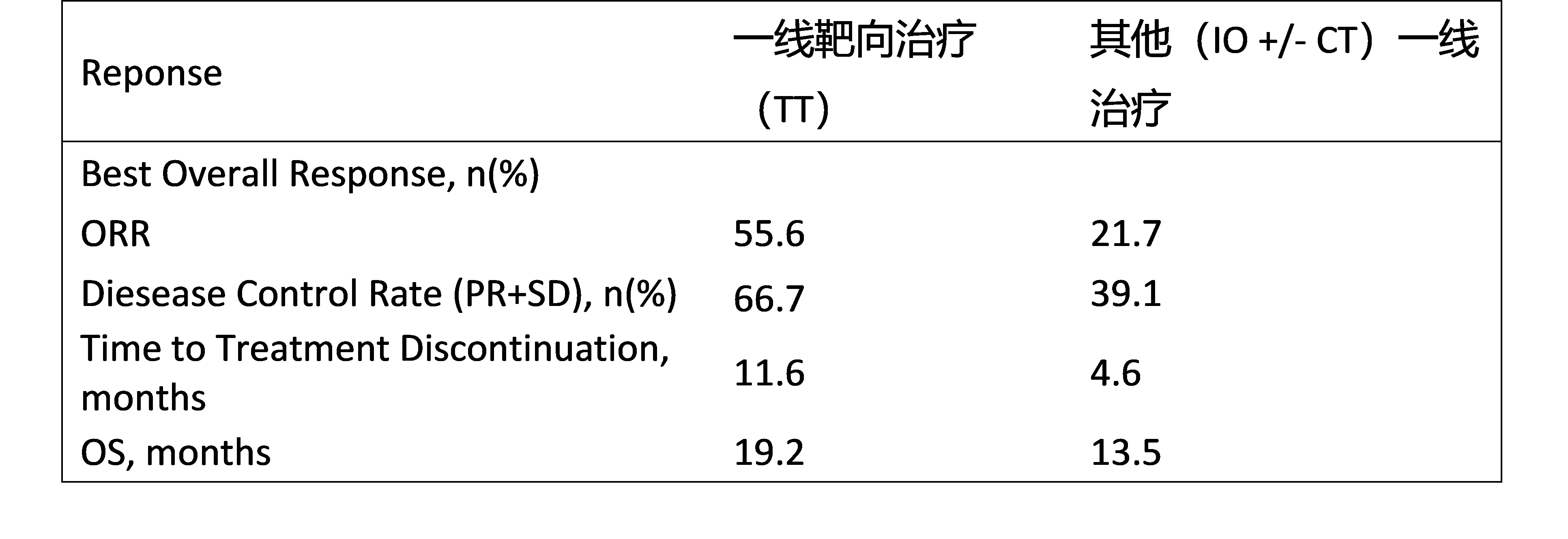
小结
近年来,肿瘤精准诊疗已在临床逐渐深化,高选择性BRAF抑制剂已在BRAFⅠ类(V600)突变实体瘤展现出显著的抗肿瘤活性,尤其是这类BRAF抑制剂联合MEK抑制剂可显著增强抗肿瘤活性,成为了BRAF V600突变的的主要治疗手段,适应症涉及黑色素瘤、甲状腺癌、结肠癌、非小细胞肺癌等。而且,于2022年6月美国FDA批准了这种靶向联合治疗BRAF V600E突变泛瘤种的适应症。1378P研究进一步证实了这类BRAF抑制剂联合MEK抑制剂在BRAF V600突变的实体瘤中的疗效。对于非V600突变(BRAF融合和II/III类突变),上述靶向联合未证实有明确疗效。661MO研究探索了II型泛RAF抑制剂(Belvarafenib)联合MEK抑制剂(Cobimetinib)治疗BRAF融合和II/III类突变患者的疗效性和安全性,结果显示,这种靶向联合对BRAF融合患者的有效率(ORR)达60%,mPFS达到13.8m;对II/III类突变患者也有一定疗效,控制率(SD)达50%。为BRAF融合和II/III类突变患者的治疗带来了曙光。
除KRAS等少数驱动突变以外,驱动基因突变的肺癌患者通常免疫治疗的效果不佳。 2023年ELCC大会上,由中国专家赵军教授发表的一项BRAF V600突变患者一线靶向治疗 VS 免疫治疗VS化疗的真实世界研究结果,结果显示靶向治疗的PFS达到25m优于免疫治疗(11.4m)和化疗(8.4m)4。1394P研究通过真实世界中对比分析BRAF V600突变和MET exon14跳突的晚期NSCLC接受不同方案治疗的疗效,进一步确定靶向治疗效果明显高于其他治疗方案,特别重要的是,在PD-L1高表达近50%患者中得到这一临床数据,更进一步证实BRAF V600突变和MET exon14跳突的肺癌患者靶向治疗应作为一线治疗的优选。
1. T.W. Kim,et al.Anti-tumor activity of belvarafenib in combination withcobimetinib in patients with metastatic solid tumorsharboring BRAF fusions or BRAF class II/III mutation.2023 ESMO.661MO
2.Y-K. Sh,et al.Efficacy and safety of tunlametinib (HL-085) combined with vemurafenib in patients with advanced BRAF V600-mutated solid tumors: A multicenter, phase I study.2023 ESMO.1378P
3. U. Janzic,et al. Real-world experience in treatment of patients with non-small cell lung cancer with BRAF and cMET Exon 14 skipping mutations.2023 ESMO.1394P
4. Jia, B, et al.36P Prevalence, clinical characteristics, and treatment outcomes of patients with BRAF-mutated advanced NSCLC in China: A real-world multi-center study. Journal of Thoracic Oncology, 2023. 18(4, Supplement): p. S61.
审批码TML0011919-36433,有效期至2024-10-31,资料过期,视同作废
排版编辑:Lillian











 苏公网安备32059002004080号
苏公网安备32059002004080号


