
中国研究型医院学会妇产科学专业委员会. 子宫颈癌前哨淋巴结活检临床应用中国专家共识[J]. 中华肿瘤杂志, 2021, 43(10):981-988.
DOI:10.3760/cma.j.cn112152-20210720-00526.
子宫颈癌是妇科常见的恶性肿瘤。大多数早期子宫颈癌患者接受了不必要的系统盆腔淋巴结切除,增加了手术并发症的风险。目前,前哨淋巴结活检在国外已经应用于子宫颈癌的临床实践,但在中国尚处于起步阶段,亟需应用和推广。中国研究型医院学会妇产科学专业委员会邀请中国妇科肿瘤领域专家,基于当前研究现状,对子宫颈癌前哨淋巴结活检的应用价值、患者评估、技术方法、操作要点、病理检测等诸多关键性问题进行探讨,达成子宫颈癌前哨淋巴结活检临床应用中国专家共识,以指导子宫颈癌前哨淋巴结活检在中国的规范化开展。
【关键词】子宫颈肿瘤;前哨淋巴结活检;前哨淋巴结诊断准确性;临床应用;专家共识
子宫颈癌是我国女性生殖系统最常见的恶性肿瘤,每年新发病例约为111000例,每年的死亡病例达34000例。早期子宫颈癌患者中,淋巴结转移是重要的预后预测因子,也是术后选择辅助治疗的依据,系统盆腔淋巴结切除一直是子宫颈癌根治性手术的主要步骤。然而,早期子宫颈癌[国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)ⅠB~ⅡA期]淋巴结转移率不足20%,且系统淋巴结切除会带来诸多手术并发症,严重影响患者术后生活质量。
前哨淋巴结(sentinel lymph node, SLN)是原发肿瘤淋巴引流区域的第一站淋巴结,通过前哨淋巴结活检(sentinel lymph node biopsy, SLNB)检测原发肿瘤最先累及的SLN是否发生转移,即可评估区域淋巴结状态,由此可使淋巴结无转移患者免于接受系统淋巴结切除,达到减少损伤和避免手术并发症的目的。在妇科恶性肿瘤中,由于外阴肿瘤位置表浅,淋巴结引流相对固定,实施SLNB可行性强,目前,国外已将SLNB作为早期外阴癌淋巴结切除的首选术式,替代了传统的腹股沟淋巴结清扫。经过多年的研究和实践,子宫内膜癌SLNB技术在国外也已经应用于临床,减少了手术并发症的发生。
近年来,随着国内外关于子宫颈癌的SLNB研究不断增多,SLNB技术在早期子宫颈癌的临床价值得到越来越多的肯定。特别是国际多中心前瞻性研究结果推动了SLNB在子宫颈癌中的临床应用。2014年美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)子宫颈癌临床实践指南提出,对于早期子宫颈癌患者可考虑行SLNB,并将其归为2B类证据。2017年NCCN子宫颈癌临床实践指南又将SLNB的推荐等级从2B类提高为2A类。但在国内,SLNB技术尚未在子宫颈癌手术中获得实际临床应用,目前正亟待推广。为此,中国研究型医院学会妇产科学专业委员会邀请国内多名妇科肿瘤学专家进行了深入的研讨,在尊重循证医学证据的基础上,参考大量国内外文献,并汇聚专家经验,形成了子宫颈癌前哨淋巴结活检临床应用中国专家共识。文中凝练了专家们对当前子宫颈癌SLNB技术的关键问题(包括应用价值、手术指征、技术要点、病理评估等方面)达成的一致性意见,同时也不回避相关的争议与分歧,以期推动子宫颈癌SLNB技术在国内的临床规范化应用。
SLNB在子宫颈癌治疗中的应用价值
(一)替代系统性淋巴结切除
对于盆腔淋巴结转移风险较低的早期子宫颈癌患者,以创伤较小的SLNB替代系统淋巴结切除,可以避免过度治疗和相关手术并发症。前瞻性研究结果显示,SLNB应用于子宫颈癌具有良好的安全性及可行性。具有代表性的SENTICOL研究显示,SLN的总检出率和双侧检出率分别为97.8%和76.5%,SLN的阴性预测值高达98.2%,而在双侧盆腔均检出SLN的患者中,阴性预测值可达100%,这表明了SLN能够准确预测盆腔淋巴结状态。随着子宫颈癌SLNB研究的深入和技术的发展,SENTIX研究已经采用SLNB替代系统盆腔淋巴结切除,该研究中SLN双侧检出率达90.8%。研究结果证实了子宫颈癌SLNB的安全性、可行性以及预测准确性,凸显出SLNB替代系统淋巴结切除的临床应用价值。
(二)精准评估子宫颈癌淋巴结转移状态
通过SLNB可以精准地评估区域淋巴结的转移状态,发现淋巴结的低体积转移病灶,并避免特殊部位转移淋巴结的漏诊。
1.发现淋巴结的低体积转移病灶:
常规苏木精-伊红(hematoxylin and eosin, HE)染色病理检查可能会遗漏淋巴结中隐匿的低体积转移病灶(指淋巴结肿瘤转移病灶长径≤2 mm,其中转移病灶长径>0.2 mm为微转移,转移病灶长径≤0.2 mm或转移病灶≤200个肿瘤细胞为孤立肿瘤细胞)。病理超分期是发现淋巴结中低体积转移灶的主要检测方法,淋巴结病理超分期是对淋巴结进行连续切片,通过常规HE结合免疫组织化学(免疫组化)染色来发现淋巴结中低体积转移病灶的方法。SLN病理超分期已纳入乳腺癌的临床应用指南,用于检测SLN低体积转移,进而指导预后评估及术后辅助治疗。FIGO 2018子宫颈癌分期中将淋巴结转移患者归为ⅢC期,进一步强调了对淋巴结状态准确判断的重要性。随着SLNB技术的开展,今后可能建立基于超分期的更加精准的淋巴结分期体系。
2.避免特殊部位转移淋巴结的漏诊:
子宫颈癌SLNB相关研究发现宫旁、骶前、腹主动脉旁等一些特殊部位存在SLN,并发生转移,而常规盆腔淋巴结切除并不包括这些部位的淋巴结。SLNB可通过示踪剂的指引,定位并切除这些特殊部位的SLN,从而避免转移漏诊,有特殊的临床应用价值。
专家共识
(1)SLNB技术应用于子宫颈癌已经获得了高级别循证医学证据的支持,并已进入国外的诊治指南。国内应积极推动本技术的临床应用,使我国广大早期子宫颈癌患者获益。
(2)早期子宫颈癌中,SLNB技术的应用价值在于替代常规系统淋巴结切除,减少手术创伤;增加淋巴结低体积转移病灶的检出,避免特殊部位转移淋巴结的遗漏,以准确评估预后及选择术后治疗。
子宫颈癌SLNB的应用指征
有研究显示,SLNB适用于原发肿瘤长径≤4 cm的早期子宫颈癌患者,肿瘤长径>4 cm的子宫颈癌患者SLN检出率明显降低。多数子宫颈癌SLNB前瞻性研究仅将肿瘤长径≤4 cm的患者纳入临床试验。NCCN指南推荐子宫颈癌(FIGO 2018)ⅠA1期伴淋巴脉管浸润、ⅠA2、ⅠB1、ⅠB2以及ⅡA1期患者可考虑行SLNB,同时也强调了尽管SLNB可应用于肿瘤长径达4 cm的患者,但肿瘤长径≤2 cm时实施SLNB的结果更为可靠。关于子宫颈癌SLNB的前瞻性研究及荟萃分析显示,肿瘤长径≤2 cm的患者与肿瘤长径>2 cm的患者比较,SLN检出率显著升高,且能更准确地预测盆腔淋巴结状态。肿瘤体积过大增加了子宫颈注射示踪剂的难度,同时也增加了盆腔淋巴结转移的可能,肿瘤体积过大和盆腔淋巴结转移均影响SLN的检出率及预测盆腔淋巴结转移的准确性。有研究显示,盆腔淋巴结阳性子宫颈癌患者的SLN检出率明显低于淋巴结阴性患者,癌栓会导致淋巴引流堵塞,造成SLN检测失败。SLNB在子宫颈癌保留生育功能手术中具有应用价值。有研究显示,子宫颈癌保留生育功能手术行SLNB的总检出率为91.8%,敏感度和阴性预测值均为100%,3年无进展生存率和总生存率分别为95.2%和97.6%。NCCN指南推荐行子宫颈癌保留生育功能手术时可考虑行SLNB,证据级别达到2A类。
专家共识
关于SLNB适应证,共识专家建议对于子宫颈癌(FIGO 2018分期)ⅠA1期伴淋巴脉管浸润、ⅠA2、ⅠB1、ⅠB2以及ⅡA1期患者可行SLNB,优先考虑局部病灶≤2 cm者。行早期子宫颈癌保留生育功能手术时可行SLNB。炎症、癌栓和压迫等原因导致的淋巴引流堵塞易造成SLN检测失败。
子宫颈癌SLNB技术方法
(一)示踪剂的选择
目前国内外常用的SLN示踪剂有生物活性染料、放射性核素和荧光染料。可以采用两种示踪剂联合应用。
1.生物活性染料:
蓝染剂是最早用于SLNB的示踪剂,国内常使用亚甲蓝(美蓝),其他还有专利蓝和异硫蓝等蓝色染料。肿瘤周围注射蓝染剂后,蓝染剂沿着淋巴引流通路到达SLN并将其染为蓝色,从而达到示踪SLN的效果。单独使用蓝染剂进行子宫颈癌SLN示踪的检出率为73.1%~92.8%。蓝染剂作为SLN示踪剂具有操作方便、不需特殊设备,价格低廉,开腹和腹腔镜手术均适用等优点。但由于蓝染剂颗粒直径小,弥散速度快,短时间内易引流至次级淋巴结,造成SLN定位不准。蓝染剂易弥散至周围组织,影响SLNB操作。蓝染剂也可进入循环系统,有引发过敏反应的风险。
纳米炭是新一代高淋巴系统趋向性的生物染料,是由普通活性炭、助悬剂聚乙烯吡咯烷酮和0.9%氯化钠溶液制成的黑色混悬液染料。使用纳米炭示踪SLN的要点是在局部注射纳米炭后,仔细辨认黑染的淋巴管,追踪至淋巴引流路径上的第一站黑染淋巴结,将其切除。纳米炭应用于早期子宫颈癌的SLN总检出率为91.3%~95.0%,这也证实了纳米炭的应用价值。纳米炭可以沿着淋巴管引流而不易弥散至周围组织,且不进入血液循环,从而减少术野污染和全身不良反应。同时,使用纳米炭示踪SLN操作方便,不需特殊设备,开腹和腹腔镜均适用。但纳米炭不具有穿透性,需要术者仔细解剖染色的淋巴管以发现黑染的SLN。目前纳米炭仅在国内获批应用于SLNB,尚未在国际上广泛应用。
2.放射性核素:
目前,最常用的放射性核素示踪剂为锝99(99mTc),如99mTc硫化锑、99mTc过滤硫胶体和99mTc纳米胶体白蛋白等,常与蓝染剂联合应用,两者联用的SLN检出率为94%~99%。99mTc胶体的粒径相对较大,不易引流至下一站淋巴结,放射性信号具有穿透组织的能力,有助于识别组织深部的SLN。但由于使用放射性核素需要配备专门仪器以及核医学专业人员,且存在放射防护问题,这限制了其在临床中的广泛应用。
3.荧光染料:
吲哚菁绿(indocyanine green, ICG)是目前常用的SLN示踪剂。ICG是一种近红外荧光染料,受近红外光激发后,其发出的荧光信号可通过荧光接收仪成像在设备上。子宫颈局部注射ICG示踪剂后,ICG进入淋巴系统,淋巴管和SLN吸收ICG后被荧光所标记,借助特殊设备即可显像,指引SLNB实施。ICG法为目前早期子宫颈癌SLNB的主要方法之一。FILM国际多中心前瞻性研究显示,在子宫内膜癌和子宫颈癌中,ICG的SLN总检出率和双侧检出率明显高于蓝染剂,ICG法可能会成为SLN示踪的标准方法。子宫颈癌ICG法的SLN检出率达到了95.5%~100%。ICG被激发产生的近红外荧光具有穿透性,可以定位组织深部的SLN,有助于对肥胖患者实施SLNB。ICG可以实时成像,关闭荧光模式后恢复正常术野,不干扰其他手术步骤,且安全无毒。ICG粒径较小,弥散速度快,易引流至下一站淋巴结,且需要依靠特殊的近红外荧光成像设备。
专家共识
生物活性染料(蓝染剂、纳米炭)、放射性核素、ICG均可应用于早期子宫颈癌SLNB。两种示踪剂联合应用可提高SLN检出率。ICG荧光示踪法为当今国际推荐的示踪方法。
(二)示踪剂的注射方法
1.示踪剂的注射时机:
示踪剂注射时机对于SLNB非常重要。对于蓝染剂或ICG荧光示踪剂,德国妇科肿瘤小组、FILM、SENTICOL及SENTICOLⅢ等多项前瞻性研究均要求术前注射,但具体时间点略有不同。有学者主张在麻醉诱导成功后即刻注射,另有学者推荐在手术开始时注射。
专家共识
原则上各示踪剂均在手术开始时注射。根据示踪剂不同,具体注射时机不同。纳米炭注射后观察时间稍长,ICG和蓝染剂注射后观察时间相对较短。
2.示踪剂的注射浓度和剂量:
示踪剂的注射浓度和剂量要根据示踪剂的种类、注射位置和患者的个体差异进行调整。蓝染剂浓度一般为1%(亚甲蓝、异硫蓝)和2.5%(专利蓝),纳米炭原液或稀释1倍使用均可,ICG的浓度一般为1.25~2.50 mg/ml。通常每个注射点注射0.5~1.0 ml示踪剂。
3.示踪剂的注射部位:
NCCN指南中指出,示踪剂可直接注射于子宫颈,通常子宫颈注射部位有两点法和四点法。两点法为子宫颈3、9点处注射,四点法为子宫颈2、4、8、10点或3、6、9、12点注射;也可以在肿瘤边缘0.5 cm的3点、9点处注射(肿瘤较大者可适当改变注射部位)。无论在何处注射,注射点均应避开肿瘤病灶。相关研究中,多数学者采用了子宫颈深间质注射,其中也有研究采用深浅注射相结合的方式。对于子宫颈锥切术后的患者,示踪剂应避开锥切创面组织进行注射。
专家共识
可选择在子宫颈的3、9点附近注射示踪剂,注射深度为3~5 mm,注意避开肿瘤病灶及锥切创面组织,缓慢注射。
(三)手术入路
子宫颈癌SLNB的手术入路包括经腹和腹腔镜(包括机器人辅助腹腔镜)。目前,腹腔镜入路(包括机器人辅助腹腔镜)在子宫颈癌手术中的应用存在争议。但SENTIX国际多中心前瞻性研究显示,早期子宫颈癌患者接受腹腔镜入路(包括机器人辅助腹腔镜)的SLN双侧盆腔检出率达93.2%,明显高于经腹入路(85.9%)。腹腔镜手术(包括机器人辅助腹腔镜)视野清晰、分辨率高,有利于提高SLN检出率。
专家共识
子宫颈癌SLNB的手术入路包括经腹和腹腔镜(包括机器人辅助腹腔镜)。腹腔镜手术(包括机器人辅助腹腔镜)对于早期子宫颈癌SLNB具有一定优势。
(四)SLN术中探测
1.SLN识别及活检:
依据示踪剂不同的生物特性,结合患者个体差异,注射示踪剂后适时识别SLN。应识别淋巴引流通路上第一站示踪剂显像的淋巴结为SLN,记录SLN的位置及显像时间,单独切除送检。若使用生物活性染料示踪剂,由于示踪剂不具有穿透性,术中应仔细解剖染色的淋巴管,追踪寻找第一站显像的淋巴结为SLN。
2.子宫颈癌SLN位置分布:
了解SLN的分布规律,有助于术中识别活检SLN。有研究显示,子宫颈癌SLN最常见的部位为髂外、髂内及闭孔区。纳入12项关于子宫颈癌SLNB研究的荟萃分析显示,84.9%的子宫颈癌患者SLN位于髂外、闭孔及髂内淋巴结区,这些区域是SLN最常见的部位,除此还有部分SLN位于少见区域,如宫旁(4.5%)、髂总(6.1%)、骶前(2.8%)及腹主动脉旁淋巴结区(1.7%)。宫旁、髂总、骶前及腹主动脉旁淋巴结区域并不在常规盆腔淋巴结切除手术范围之内,应注意识别这些特殊部位的SLN,避免漏诊。特别是宫旁部位的SLN距离子宫颈示踪剂注射部位最近,容易被注射点周围示踪剂浓集所掩盖,导致难以识别。应仔细解剖宫旁组织,找寻宫旁SLN,单独切除。有研究显示,即使宫旁无SLN示踪,行侧方宫旁淋巴结单独切除也可提高宫旁部位转移淋巴结检出率。
专家共识
子宫颈注射示踪剂后,适时识别SLN。注意SLN为淋巴引流通路上第一站显像的淋巴结,而非所有显像的淋巴结。应注意在常见部位(髂外血管内侧、侧脐韧带外侧及闭孔窝上部)寻找SLN,但不应忽视少见部位(髂总血管、宫旁、骶前及腹主动脉旁)SLN的识别。
(五)SLNB技术流程
NCCN指南中已推荐了早期子宫颈癌SLNB的技术流程。具体为:切除所有SLN;切除任何肿大、可疑转移的淋巴结(无论是否显像);一侧盆腔没有淋巴结显像时,需系统切除该侧盆腔淋巴结;完整切除肿瘤及宫旁组织。在遵循该流程的前提下,子宫颈癌SLNB的灵敏度和阴性预测值均可提高至100%。
(六)SLNB技术培训
SLNB技术需要学习曲线,SLN的检出数量和检出率与手术医师的经验有关。由于子宫颈癌局部注射示踪剂存在一定特殊性,且子宫颈癌淋巴引流较复杂,因此子宫颈癌SLNB的学习曲线大约为20~30例。当手术者SLNB经验不足时,容易导致SLN识别失败,也容易将第二站及后几站的淋巴结作为SLN切除,致使切除的SLN数量较多,失去了SLNB的意义。掌握SLNB技术也要求手术者具备良好的子宫颈癌根治性手术基础。因此,加强对SLNB的技术要点及流程培训,有助于缩短初学者的学习曲线。
专家共识
子宫颈癌SLN的成功识别及检出需要学习曲线。手术者必须经过培训,积累一定的手术例数和经验,才能规范开展子宫颈癌SLNB。
子宫颈癌SLN病理检测
子宫颈癌SLN术中冰冻病理对检查宏转移具有一定的临床应用价值,在保留生育功能手术中尤为重要,有条件的医院可行子宫颈癌SLN术中冰冻病理检查,根据检查结果按照相应指南制定下一步治疗计划。
常规病理检查无转移病灶的SLN,需进一步行病理超分期检查。目前子宫颈癌SLN病理超分期方案尚未统一,不同之处主要在于淋巴结取材方式(垂直于长轴或平行于长轴)、连续切片的间距、切片厚度、切片数目以及免疫组化数量的不一致。有研究显示,适当减少SLN的切片及免疫组化数量不会影响淋巴结转移检出率。
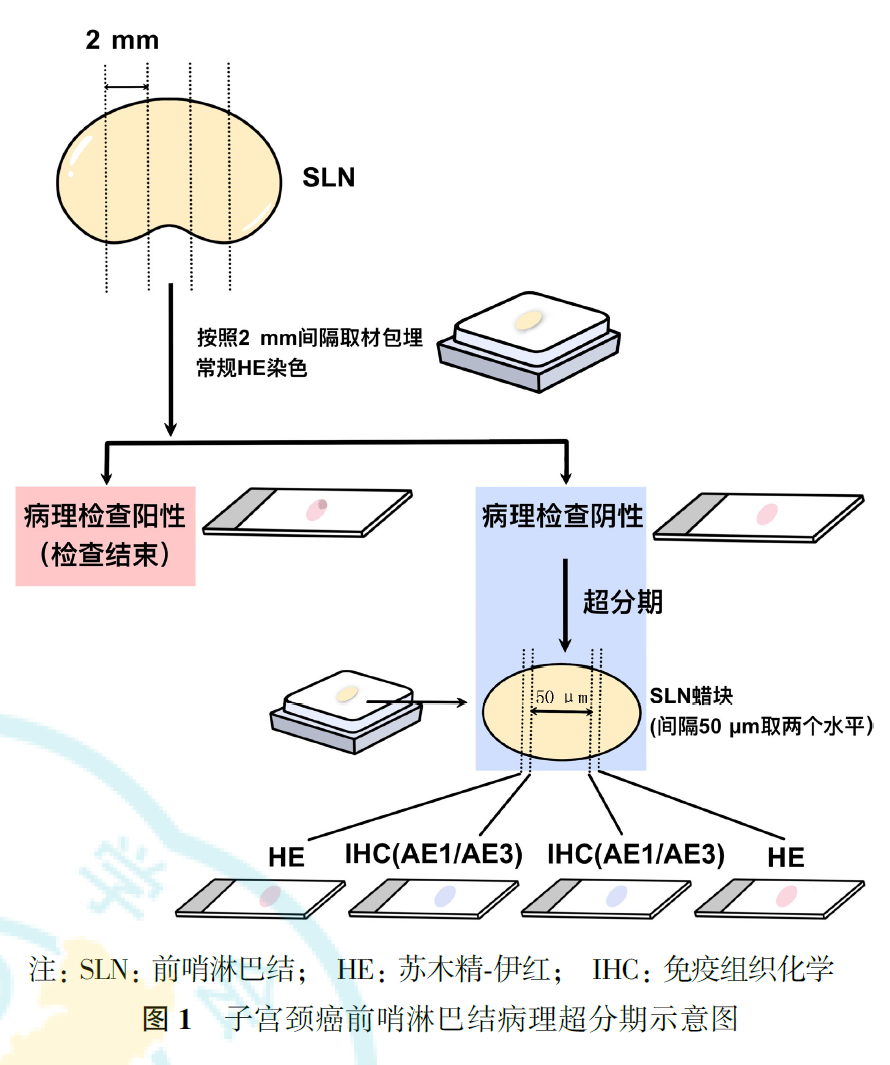
美国病理学家协会推荐的子宫颈癌SLN病理超分期检查方案为:SLN按照2 mm的间隔取材包埋,若初始HE检测为阴性,则将每个组织块分为间隔50 μm的两个水平,每个水平均连续切2张切片,分别行HE及抗细胞角蛋白抗体免疫组化染色,每个蜡块检测4张切片(图1)。此方法为美国病理学家协会推荐,国内可根据实际情况将切片间隔调整为50~250 μm。不同的单位可根据推荐的病理超分期方法,结合本单位实际情况和要求,进行SLN检查。可将多个SLN取材组织块包埋在同一个蜡块内,以减少切片及免疫组化数量;或增加切面行HE染色,但适当减少免疫组化数目,以利于子宫颈癌SLN病理超分期在临床实践中开展。
子宫颈癌SLN病理超分期可以降低SLNB的假阴性率,提高阴性预测值,但SLN低体积转移对预后的影响仍有争议。有研究显示,子宫颈癌SLN微转移(淋巴结肿瘤转移病灶直径为0.2~2 mm)会显著降低子宫颈癌患者的总生存率和无疾病生存率。但也有研究显示,SLN低体积转移不是子宫颈癌不良预后的独立影响因素。子宫颈癌SLN低体积转移的预后及处理原则目前尚无定论,倡导开展多中心合作,完善技术流程,不断推进相关研究。
有学者通过逆转录聚合酶链反应等分子生物学检测方法,检测子宫颈癌SLN中细胞角蛋白、鳞状细胞癌抗原、人乳头瘤病毒等特异性分子标志物的表达情况,协助判断SLN是否存在微转移病灶。子宫颈癌SLN分子检测虽然灵敏度较高,但特异度不强,其临床应用价值有待进一步探究。
专家共识
建议有条件的医院行SLNB的同时行SLN病理超分期检查。目前国际上关于子宫颈癌SLN病理超分期方案尚无统一标准,规范化的方法需要进一步建立。
总结
参与编写本共识的专家一致认为子宫颈癌SLNB技术可行,且具有重要的临床应用和推广价值。专家们对SLNB技术的多个关键性问题达成共识,以指导本技术的开展。今后需进一步开展多中心合作,完善临床操作规范,并制定标准的病理超分期方案,为建立适合我国的子宫颈癌SLNB临床应用指南奠定基础。

免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


