

张力, 杨云鹏, 中国抗癌协会肿瘤康复与姑息治疗专业委员会, 等. 恩沙替尼治疗间变性淋巴瘤激酶阳性非小细胞肺癌专家共识[J]. 中华肿瘤杂志, 2022, 44(4):297-306.
DOI: 10.3760/cma.j.cn112152-20220113-00033.
非小细胞肺癌患者间变性淋巴瘤激酶(ALK)突变率为3%~7%。与表皮生长因子受体阳性非小细胞肺癌患者比较,ALK突变非小细胞肺癌患者更易获得长期生存,因此,ALK突变被称为钻石突变。目前,在全球范围内,ALK-酪氨酸激酶抑制剂(TKI)药物已经有三代药物。中国已获批的ALK-TKI第一代药物为克唑替尼,第二代药物为阿来替尼、塞瑞替尼和恩沙替尼。恩沙替尼为中国自主原研的ALK-TKI,其疗效与阿来替尼相似,耐受性表现为一过性皮疹,从患者长期生存的角度而言,顺应性更好。恩沙替尼引起的皮疹表现与其他ALK-TKI药物不同,为了便于临床应用和为患者提供更多的治疗选择,在中国抗癌协会肿瘤康复与姑息治疗专业委员会的指导下,专家收集汇总了恩沙替尼常见的不良反应,并结合临床实践制定了明确的不良分级及具体处理方案,以期为临床医师提供相应的参考依据。
【关键词】肺肿瘤;间变性淋巴瘤激酶阳性;间变性淋巴瘤激酶-酪氨酸激酶抑制剂;不良反应;专家共识
世界卫生组织数据显示,肺癌为恶性肿瘤死亡的主要原因。2020年,全球肺癌死亡病例数为180万例,占所有恶性肿瘤相关死亡的18%。全球新发肺癌病例数占全部新发恶性肿瘤的11.4%,2020年中国新发肺癌病例数为82万例,占中国新发恶性肿瘤的17.9%,肺癌死亡病例数为71万例,占恶性肿瘤死亡总数的23.8%。根据组织学分类,肺癌分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer, NSCLC),其中NSCLC主要包括腺癌、鳞癌与大细胞癌,NSCLC占肺癌的80%~85%。
间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)是一种跨膜受体酪氨酸激酶,1994年学者首次在间变性大细胞淋巴瘤中发现NPM1-ALK的融合,其是肿瘤的致癌驱动基因。有研究显示,ALK融合在不同分期NSCLC患者中的发生率存在差异,在早期患者中ALK融合发生率为2.4%~8.6%,在晚期患者中为8.7%~9.0%。ALK基因融合在不吸烟或有轻度吸烟史的年轻人群以及黏液腺癌患者中发生率较高。ALK融合患者常合并中枢神经系统(central nervous system, CNS)转移,基线存在CNS转移是ALK阳性患者的不良预后因素。克唑替尼是首个获批的ALK抑制剂,与化疗比较,显著改善了ALK阳性晚期NSCLC患者的治疗效果。近年来,新一代ALK抑制剂如塞瑞替尼、阿来替尼、布加替尼、恩沙替尼以及劳拉替尼陆续获批上市。与克唑替尼比较,新一代ALK抑制剂的全身及CNS疗效均显著改善,成为ALK阳性晚期NSCLC患者的重要治疗手段。
盐酸恩沙替尼(商品名:贝美纳)是首个也是目前唯一获批上市的国产新一代ALK抑制剂,能作为小分子腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)类似物进入细胞内,竞争性抑制ALK与ATP的结合,阻断酪氨酸激酶的磷酸化过程,从而抑制癌细胞生长、增殖、生存等信号通路的传导,最终诱导癌细胞凋亡。由于盐酸恩沙替尼在接受克唑替尼治疗后进展或对克唑替尼不耐受的ALK阳性局部晚期或转移性NSCLC患者的治疗中显示出良好的疗效及安全性,2020年11月17日中国国家药品监督管理局(National Medical Products Administration, NMPA)批准盐酸恩沙替尼上市。为了更好地指导临床合理有效地使用盐酸恩沙替尼,为肺癌患者服务,中国抗癌协会肿瘤康复与姑息治疗专业委员会组织专家共同编写了本共识,以供同道借鉴参考。本共识将随盐酸恩沙替尼新研究成果的发布适时更新。
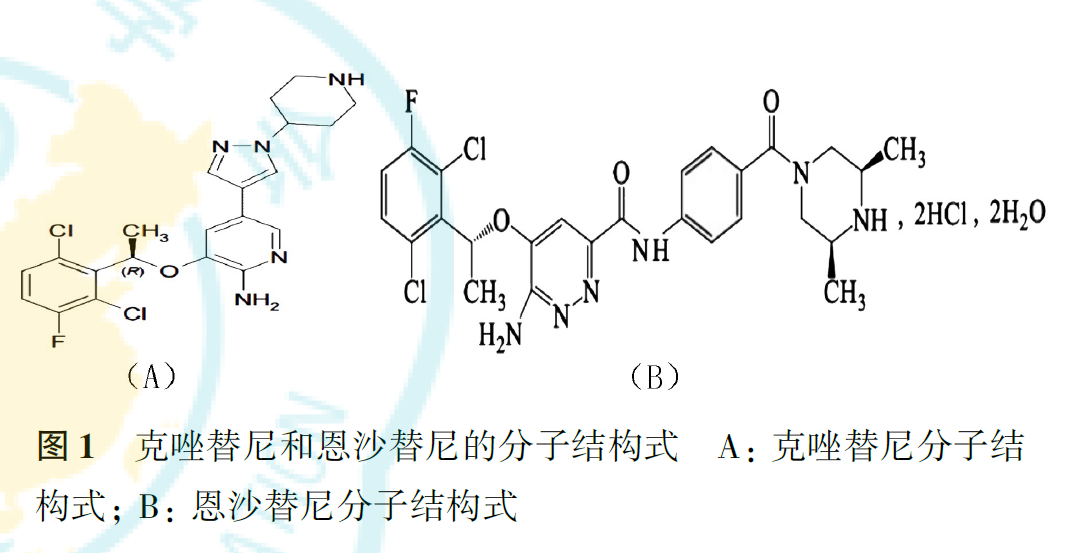
恩沙替尼的结构
恩沙替尼是在克唑替尼的基础上改造的,与克唑替尼比较,恩沙替尼保留了苄氧基,并创新性地以氨基哒嗪为药效基团,取代了克唑替尼的氨基吡啶(图1)。氨基哒嗪能够与ALK形成2个氢键,并且在氨基哒嗪和苯基之间加入的酰胺键可与ALK形成1个新的氢键,共形成3个氢键,多于克唑替尼形成的2个氢键,这使恩沙替尼对ALK的结合力强于克唑替尼,从而且具有更好的选择性。与克唑替尼比较,恩沙替尼增加了1个苯环和2个甲基,进一步增加了其脂溶性和亲和力,为恩沙替尼具有更好的血脑屏障穿透能力提供了结构基础。
恩沙替尼的临床前数据
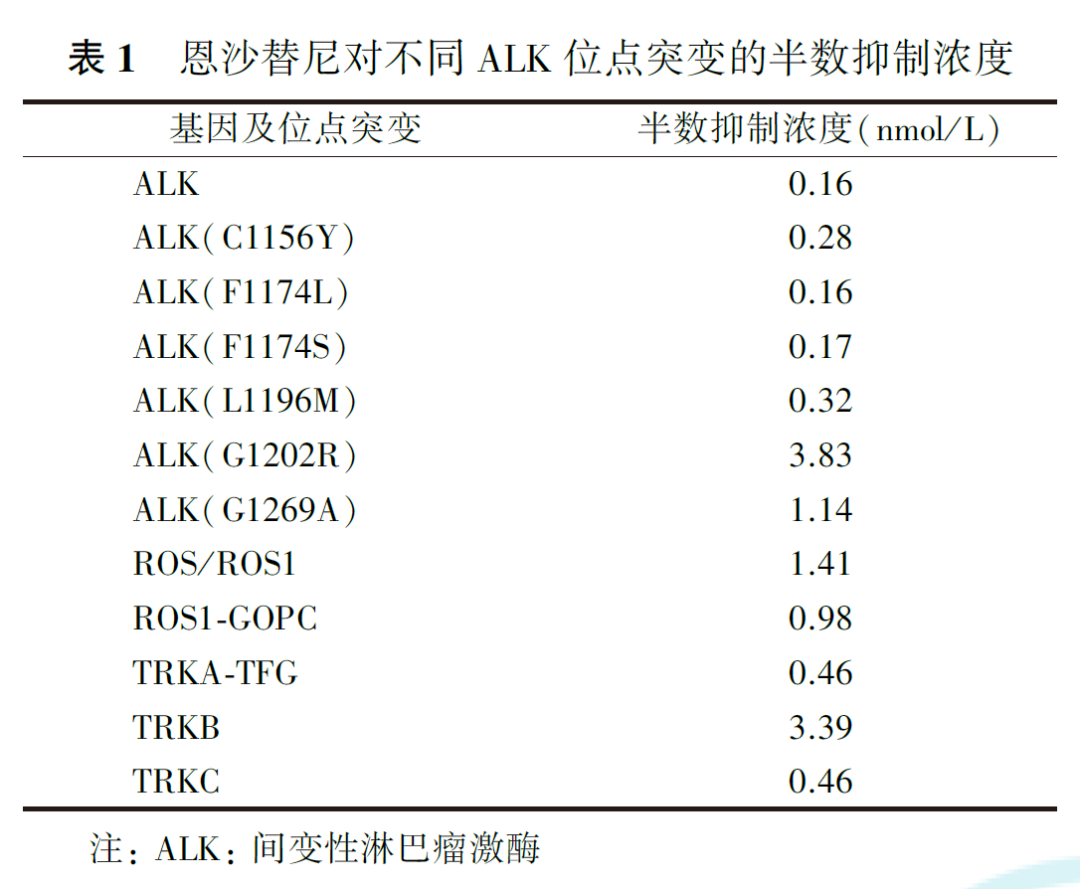
1.恩沙替尼在分子水平对ALK酪氨酸激酶的抑制活性:
一项ALK抑制剂的研究综述显示,克唑替尼对ALK活性的半数抑制浓度(half maximal inhibitory concentration, IC50)值为4.5 nmol/L,而恩沙替尼对ALK活性的IC50值<0.4 nmol/L,显示出更强的抑制作用。美国Ⅰ~Ⅱ期研究(eXalt2)显示,恩沙替尼对伴有特定突变位点的ALK酪氨酸激酶也有很强的抑制作用,ALK突变位点包括F1174、C1156Y等,其IC50值均<0.4 nmol/L(表1)。除ALK之外,恩沙替尼还对ROS1、TRK、MET等靶点具有较强的抑制能力(表1),如恩沙替尼、克唑替尼对MET酪氨酸激酶的IC50值分别为0.74 nmol/L和0.51 nmol/L。
2.恩沙替尼在肺癌细胞株中对ALK的抑制能力:
在H3122肺癌细胞株中,恩沙替尼和克唑替尼的IC50值分别为0.015和0.180 μmol/L,恩沙替尼的抑制作用是克唑替尼的10倍以上。
在细胞株水平,不同ALK抑制剂对于ALK融合原型激酶和伴有不同位点突变ALK激酶的抑制作用各不相同(图2)。有研究显示,在Ba/F3肺癌细胞株中,恩沙替尼对特定ALK二次突变仍具有抑制作用,特别是针对I1171、F1174、V1180L和C1156Y耐药突变,这些基因突变为塞瑞替尼或阿来替尼治疗后的耐药机制之一。因此,对于既往接受塞瑞替尼或阿来替尼治疗的患者,如果耐药时的基因检测出现以上位点突变,恩沙替尼可作为一种克服耐药的治疗选择。G1269A、E1210K和G1202R是恩沙替尼潜在的主要耐药位点,其中最主要的耐药位点G1269A是其他第二代ALK-酪氨酸激酶抑制剂(ALK-tyrosine kinase inhibitor, ALK-TKI)的敏感位点。因此,一线接受恩沙替尼治疗的患者耐药后如出现G1269A突变,序贯其他第二代ALK-TKI(如塞瑞替尼、阿来替尼、布加替尼)治疗可为患者带来更长的生存获益。由于不同ALK-TKI对于携带不同突变位点ALK激酶的抑制作用存在差异(图2),在ALK患者的全程管理中,一种ALK-TKI耐药后再次行基因检测,其检测结果可以更好地指导患者的精准治疗,规划患者的全程管理,使患者获得更好的生存获益。

3.恩沙替尼的药效动力学:
SH-SY5Y小鼠颅内肿瘤实验结果表明,恩沙替尼的颅内药物浓度为65 nmol/L,是抑制EML4-ALK融合突变肿瘤生长所需浓度的5倍以上。克唑替尼的颅内药物浓度(28.6 ng/L)仅为恩沙替尼的44%,提示恩沙替尼比克唑替尼可以更好地渗透入脑抑制肿瘤。
恩沙替尼用药方式和不同用药剂量的初步疗效和安全性
1.美国Ⅰ~Ⅱ期临床数据:
在剂量递增阶段,恩沙替尼药物剂量范围为25~250 mg。Ⅱ期研究推荐剂量为225 mg,28 d为1个周期,连续用药28 d。在225 mg剂量组,半衰期(t1/2)为33.2~37.7 h,达峰时间(Tmax)为3.1~3.6 h,提示可以1次/d给药。美国Ⅰ~Ⅱ期研究显示,空腹患者(n=10)的达峰浓度(Cmax)为318 ng/ml,Tmax为3.1 h,曲线下面积(area under curve, AUC)为5530 ng/(h·ml),t1/2为33.2 h;随餐患者(n=8)的Cmax为311 ng/ml,Tmax为3.6 h, AUC为5330 ng/(h·ml),t1/2为37.7 h。
Horn等的研究在剂量扩展阶段纳入22例(23%)既往接受过克唑替尼治疗的患者,疗效评估显示,恩沙替尼在克唑替尼经治患者中的中位无进展生存时间(progression-free survival, PFS)为9.0个月,ALK-TKI初治的患者的中位PFS为26.2个月。
安全性分析显示,86%(83/97)的患者出现了治疗相关不良反应(treatment related adverse events, TRAE)。最常见的不良反应为皮疹(56%)、恶心(36%)、瘙痒(28%)、呕吐(26%)和疲劳(22%),其中大多数不良反应为1~2级。97例患者中有22例出现治疗相关的3~4级不良反应,14例患者(14%,14/97)需降低药物剂量,15例患者(15%,15/97)由于恩沙替尼相关的不良反应中断治疗。
食物对恩沙替尼的吸收无显著影响。根据药代动力学数据,空腹或与食物同服对恩沙替尼药物吸收无影响。ASCEND-8研究也显示,塞瑞替尼450 mg随餐和600 mg随餐与750 mg空腹比较疗效一致,而且胃肠道不良反应显著降低,降低药物剂量的比例也更低。因此,在临床实践中建议包括恩沙替尼在内的靶向药物随餐服用,既不影响疗效,又可在一定程度上降低胃肠道不良反应。
2.中国Ⅰ期临床数据:
中国受试者连续给药恩沙替尼28 d后,约第8~15天到达稳态趋势。150、200、225 mg剂量组Tmax中位值为2.67~3.10 h,各剂量组消除相t1/2平均值为28.0~36.4 h,提示可以1次/d给药(QD);250 mg QD剂量组2例发生了剂量限制不良反应,均为3级皮疹,故最大耐受剂量确定为225 mg。
中国患者服用恩沙替尼(200 mg)的Cmax和AUC0~t高于欧美人群(225 mg),美国Ⅰ~Ⅱ期研究中,空腹患者(n=10)的Cmax为318 ng/ml, AUC为5530 ng/(h·ml),随餐患者(n=8)的Cmax为311 ng/ml,AUC为5330 ng/(h·ml),提示中国人群服用200 mg恩沙替尼患者与欧美服用225 mg患者的疗效可能相当(表2)。

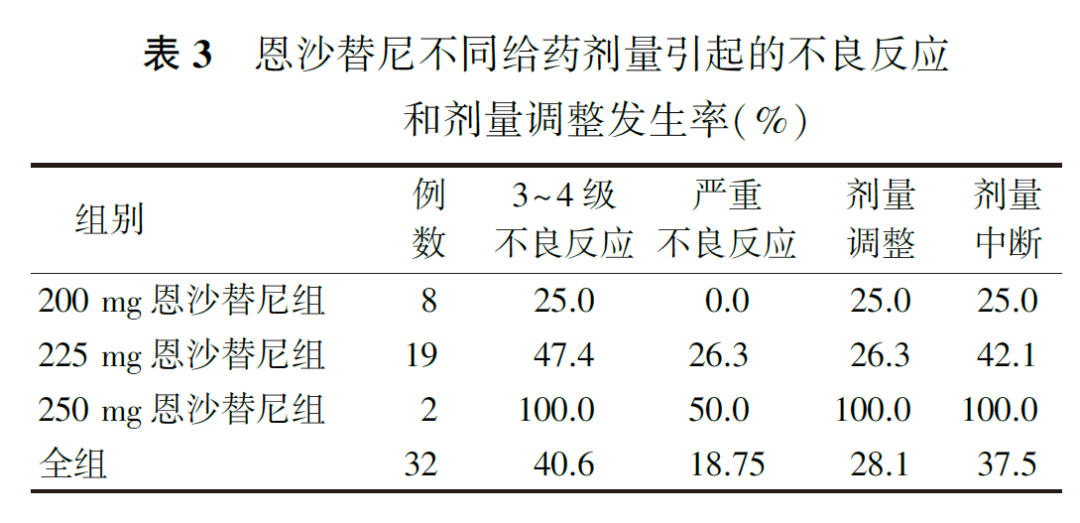
安全性方面,恩沙替尼患者≥3级TRAE发生率为40.6%,最常见TRAE为皮疹(21.9%),其次为谷氨酸氨基转移酶(alanine aminotransferase, ALT)升高(15.6%)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)升高(9.4%);200 mg组在严重不良反应(serious adverse events, SAE)、3~4级不良反应及剂量中断的发生率低于225 mg组(表3)。
225、200、150 mg恩沙替尼组患者的客观缓解率(objective response rate,ORR)分别为78.5%、75.5%和66.7%,提示可能在中国患者中使用恩沙替尼200 mg的疗效与美国人群使用225 mg的疗效相当,此结论还需在更广泛的人群中进行更多数据的验证。全组患者使用恩沙替尼的ORR为79%,一线治疗时,恩沙替尼的ORR(100%)优于二线治疗(60%),同时对于既往接受过塞瑞替尼或者阿来替尼的患者,使用恩沙替尼的ORR为50%。
恩沙替尼中国Ⅱ期和全球Ⅲ期临床数据
(一)恩沙替尼治疗ALK阳性克唑替尼经治的NSCLC患者
研究者在中国开展了一项恩沙替尼单臂、多中心Ⅱ期临床研究,该研究纳入160例ALK阳性克唑替尼经治(无论既往是否接受过化疗)的NSCLC患者,按照225 mg 1次/d的剂量服用恩沙替尼,观察患者的疗效与安全性,主要研究终点是独立委员会(independent review committee, IRC)根据实体瘤疗效评价标准1.1评估的ORR。
1.总体疗效:
口服恩沙替尼225 mg,1次/d,能够带给患者优异获益。该研究全分析集(full analysis set, FAS)包括156例患者,IRC评估数据显示,FAS患者的ORR为52%(95%CI:43%~60%),疾病控制率(disease control rate, DCR)为93%(95%CI:88%~97%),中位PFS为11.2个月(95%CI:7.6~11.9个月),中位缓解持续时间为10.4个月(95%CI:7.6~12.5个月)。
2.安全性:
在入组的160例患者中,有145例(91%)患者发生过至少1次TRAE。恩沙替尼最常见的TRAE是皮疹(89例,56%)、ALT升高(74例,46%)、AST升高(65例,41%)、肌酐升高(30例,19%)、便秘(29例,18%)、瘙痒(28例,18%)和面部水肿(25例,16%);36例(23%)患者发生3级TRAE,未发生4级TRAE。41例(26%)患者发生严重不良反应,包括12例(8%)治疗相关严重不良反应;19例(12%)患者降低恩沙替尼的剂量服用,24例(15%)患者中断了恩沙替尼的治疗,8例(5%)患者因不可耐受的不良反应而停止使用恩沙替尼,4例(3%)患者因恩沙替尼相关的不良反应(肝功能异常2例、脓疱疹1例和胸腔积液1例)而停用恩沙替尼。研究中有4例(3%)患者发生5级不良反应,但均与研究治疗无关,无间质性肺病或QTc间期延长的报道。
3.克唑替尼经治且脑转移患者从恩沙替尼的治疗中获益显著:
FAS中有97例(62%)患者基线伴有脑转移,其中40例患者脑部病灶可测量。恩沙替尼能够显著控制颅内病灶,IRC评估的颅内ORR为70%(95%CI:53%~83%),颅内DCR为98% (95%CI:87%~100%),中位缓解持续时间为8.6 (95%CI:6.4~未达到),脑转移患者发生首次应答的中位时间为1.3个月(95%CI:1.2~1.4)。
恩沙替尼治疗ALK阳性克唑替尼经治的NSCLC患者,在总体疗效和伴有脑转移患者的疗效方面与其他第二代ALK-TKI相似,甚至数值上更优(表4)。恩沙替尼治疗引起的不良反应与早期的临床研究结果一致,主要不良反应为皮疹,但以1~2级为主,总体≥3级不良反应、因不良反应导致的剂量中断和停药比例和其他第二代ALK-TKI比较发生率更低,整体耐受性较好(表5)。因此,推荐恩沙替尼作为ALK阳性克唑替尼经治NSCLC患者的治疗新选择。


(二)恩沙替尼一线治疗ALK阳性NSCLC患者
一项国际多中心、随机、开放标签以克唑替尼为对照的临床研究(eXalt3)显示,与克唑替尼比较,恩沙替尼一线治疗ALK阳性未经TKI治疗NSCLC患者的中位PFS明显延长。截至2020年12月8日,设盲的独立疗效评审委员会(blinded independ review committee,BIRC)评估意向治疗分析(intention to treat analysis, ITT)人群恩沙替尼组患者的中位PFS为31.3个月,克唑替尼组为12.7个月(HR=0.50,P<0.0001),BIRC评估修正后意向治疗分析(modified-intention to treat analysis, mITT)人群恩沙替尼组与克唑替尼组的中位PFS分别为未达到和12.7个月(HR=0.45,P<0.0001),第36个月时恩沙替尼组的PFS率仍高达50.5%,克唑替尼组为16.6%;研究者评估mITT人群恩沙替尼组与克唑替尼组的中位PFS分别为33.2和12.9个月(HR=0.45,P<0.0001)。
1.脑转移病灶控制:
约有20%~30%的ALK阳性NSCLC患者在确诊时就已出现脑转移。既往研究显示,第一代ALK-TKI克唑替尼入脑能力较差,对脑部病灶的控制能力有限,第二代TKI恩沙替尼与克唑替尼比较,具有更优的穿透血脑屏障能力,在eXalt3研究中显示了优异的控制脑部病灶疗效。截至2020年7月1日,与克唑替尼比较,恩沙替尼能够提高3倍颅内ORR(分别为64%和21%),同时能够延长脑转移患者的中位PFS(分别为11.8和7.5个月,HR=0.55,P=0.048)。
2.延迟脑转移:
脑转移影响患者日常生活且患者预后较差。eXalt3研究显示,截至2020年7月1日,对于基线无脑转移的患者,与克唑替尼比较,恩沙替尼能够显著延缓脑转移。治疗第12个月时,恩沙替尼组与克唑替尼组患者脑转移的发生率分别为4.2%和23.9%(HR=0.31,P=0.0011),两组患者的中位PFS分别为未达到和16.6个月(HR=0.46,P=0.003),治疗第36个月时两组患者的PFS率分别为61%和25%。
3.安全性:
研究结果显示,最常(≥10%)发生的TRAE是皮疹(67.8%,97/143)、ALT升高(48.3%,69/143)、AST升高(37.8%,54/143)、瘙痒(26.6%,38/143)、恶心(22.4%,32/143)、便秘(20.3%,29/143)、水肿(21.0%,30/143)、贫血(14.0%,20/143)、呕吐(11.9%,17/143)、血碱性磷酸酶升高(13.3%,19/143)、血肌酐升高(14.0%,20/143)、γ-谷氨酰转移酶升高(13.3%,19/143)、食欲下降(11.2%,16/143),其中大部分为≤2级不良反应。以上结果表明,恩沙替尼一线治疗ALK阳性NSCLC患者在总体疗效和伴有脑转移患者的疗效方面与其他第二代ALK-TKI相当,耐受性有所差异(表6、表7)。ALK-TKI的不良反应谱特征各不相同,恩沙替尼最常见的不良反应为皮肤相关不良反应,与既往研究结果一致。另外,恩沙替尼基于eXalt 3的研究结果于2022年3月16日被NMPA批准单药用于ALK阳性局部晚期转移性NSCLC患者的治疗。


(三)恩沙替尼的动态基因检测和耐药机制分析
在恩沙替尼的中国注册临床研究中,研究者收集了患者基线、第3周期用药第1天、疾病进展(progressive disease, PD)时的血液样本进行循环肿瘤DNA(circulating tumour DNA, ctDNA)检测,168例患者共收集到440个样本,结果表明,基线TP53共突变的患者(20.2%)与较低的PFS相关,TP53共突变患者与无TP53突变患者的中位PFS分别为4.2和11.7个月(P<0.0001);对于基线携带不同耐药突变位点的患者,恩沙替尼同样有不同的ORR,其中F1174突变患者ORR为71%,C1156Y突变患者ORR为71%,T1151突变患者ORR为67%,I1171突变患者ORR为50%,ALK扩增患者ORR为56%;F1174、C1156Y和I1171突变的疗效与临床前细胞株水平恩沙替尼对基因位点抑制作用的敏感性一致。
与基线比较,患者PD时常出现的ALK继发突变包括G1269A(20.0%)、G1202R(16.5%)、E1210K(10.4%)。恩沙替尼治疗后最常出现的耐药突变为G1269A突变,这与临床前细胞活性实验结论一致。细胞活性实验表明,其他第二代ALK-TKIs可以挽救G1269A耐药突变。这也为恩沙替尼一线治疗后出现因G1269A突变产生的耐药而选择其他ALK-TKI提供临床前和临床方面的理论依据支持。
恩沙替尼治疗相关不良反应
恩沙替尼的安全性数据来自5项恩沙替尼临床研究的安全性汇总,共506例晚期NSCLC患者接受恩沙替尼治疗,其中460例患者的药物剂量为225 mg(1次/d),治疗过程中需要特别关注的不良反应主要为皮肤相关不良反应、转氨酶升高、胃肠道不良反应等。
1.皮肤相关不良反应管理:
关于恩沙替尼引起皮疹等皮肤不良反应的相关机制尚未明确。有研究显示,ALK在正常皮肤表皮中表达,且ALK-TKI在体外可抑制正常人表皮角质形成细胞的生长。啮齿类动物研究表明,单次给药12 h后,皮肤中恩沙替尼的浓度比血浆中的浓度高9.0倍,而阿来替尼在皮肤中的含量比血浆高5.7倍。恩沙替尼更容易出现皮疹,可能与此相关。
225 mg剂量组患者中有74.35%的患者发生了包括皮疹、瘙痒等至少1项在内的皮肤不良反应,但3级不良反应仅占13.04%,未出现4级不良反应,大多数皮肤相关不良反应为1~2级,患者耐受性较好,病程通常为自限性,给予相应对症治疗后皮肤相关不良反应会逐渐消退。皮肤不良反应的中位发生时间为9 d,中位持续时间为21.5 d。皮疹类型主要为斑丘疹、斑状皮疹、丘疹样皮疹,好发部位为颜面部、躯干和四肢,可伴有皮肤剥脱、瘙痒、水肿、发热等情况出现。恩沙替尼皮肤不良反应分级管理原则见表8。临床处理不良反应按照分级原则进行,美国国立卫生研究院癌症研究所制定的常见不良反应术语评定标准(Common Terminology Criteria Adverse Events, CTCAE)5.0对不良反应的术语和严重程度进行了分级,然而使用CTCAE分级不良反应存在一定的局限性,有时会低估或高估不良反应出现的概率和严重程度。参照《CSCO免疫检查点抑制剂相关的毒性管理指南(2021)》将不良反应分为:1级(轻度不良反应)、2级(中度不良反应)、3级(重度不良反应)、4级(危及生命的不良反应)和5级(与不良反应相关的死亡),基本对应于CTCAE 5.0的不良反应分级。

2.肝不良反应管理:
接受恩沙替尼治疗患者可发生药物诱导的肝不良反应。有研究显示,接受恩沙替尼治疗的506例患者中,分别有35.65%和30.22%的患者发生ALT和AST升高,其中3~4级发生率分别为2.6%和1.5%;7.6%的患者发生γ-谷氨酰转移酶升高,高胆红素血症的发生率为6.5%,其中3~4级发生率为1.5%;肝相关不良反应中位发生时间为37 d。肝不良反应的诊疗分级可参考CTCAE 5.0标准。
患者开始治疗前应进行肝功能检测(包括ALT、AST和总胆红素检测),之后根据临床情况每1~3个月定期检测。已出现转氨酶升高的患者应根据临床指征密切监测肝功能,并给予稳定肝细胞膜及促进肝细胞代谢的药物,常用的有还原型谷胱甘肽、异甘草酸二钠、多烯磷脂酰胆碱胶囊、双环醇片等药物。(1) 1~2级肝功能异常:无需进行剂量调整,建议密切监测肝功指标。(2) 3级肝功能异常:基于药物不良反应的严重程度,按剂量调整原则(表9)暂停给药并以下调后的剂量重新开始服用恩沙替尼或永久终止恩沙替尼。

3.消化道不良反应管理:
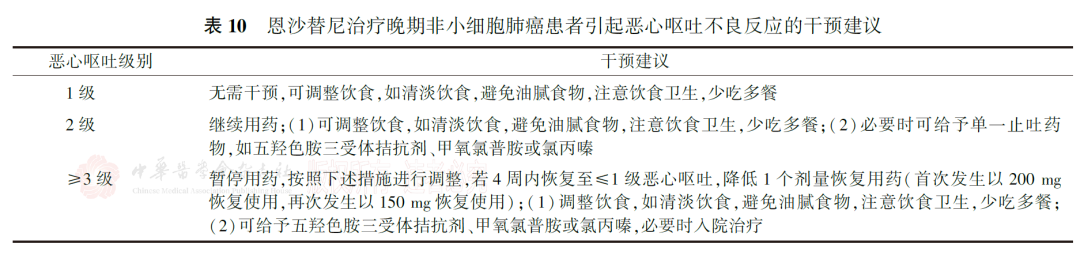
恩沙替尼虽然属于低致吐风险药物,接受恩沙替尼治疗的患者仍可能会发生恶心、呕吐和腹痛腹泻等消化道不良反应,中位发生时间为7 d。225 mg剂量组患者中,197例(42.8%)发生了消化道不良反应,绝大部分消化道不良反应为1~2级,包括恶心(83例,18.0%)、呕吐(62例,13.5%)、腹痛腹胀(24例,5.2%)和腹泻(19例,4.1%)等。建议所有患者药物服用方式为随餐服用,可以降低胃肠道不良反应的发生。消化道不良反应干预建议见表10。
4.其他不良反应管理:
其他不良反应包括心脏不良反应、呼吸系统不良反应、肾不良反应,具体发生情况见表11。如发生3级及以上不良反应,暂停恩沙替尼治疗,如4周内未缓解至≤1级不良反应,则永久停用恩沙替尼;如4周内缓解至≤1级不良反应,首次发生以200 mg恢复使用恩沙替尼,再次发生以150 mg恢复使用恩沙替尼,如对150 mg仍不耐受(出现≥3级不良反应),则建议永久停用恩沙替尼。如发生危及生命的、需要紧急治疗的不良反应,永久停用恩沙替尼。

结语
中国抗肿瘤药物进入高速发展的快车道,恩沙替尼作为第一个中国自主原研的新药具有突破外资企业治疗领域垄断的重要意义。针对新药的独特之处给予临床医师科学合理的指导建议,有助于临床医师为患者提供全面的治疗方案提供充分的依据,有助于在精准医学的大时代下更好地为患者提供个体化诊疗。

免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate












 苏公网安备32059002004080号
苏公网安备32059002004080号


