在2025年第48届圣安东尼奥乳腺癌研讨会(SABCS)上,HR+晚期乳腺癌的治疗进展尤为瞩目,核心议题围绕着如何克服内分泌耐药,特别是破解CDK4/6抑制剂治疗失败后的困局。
研究呈现出三大突破方向。首先,新一代口服内分泌药物成为研发焦点。多项研究展示了新型口服SERD(如Imlunestrant, Giredestrant, Camizestrant)联合靶向药物的潜力,旨在有效对抗ESR1突变等耐药机制(GS3-08, GS3-09, RF7-03)。其次,针对PI3K/AKT/mTOR等关键耐药通路的探索也更加深入,Gedatolisib和卡匹色替等新药的联合方案为后线治疗带来了重要选择(RF7-04, RF7-05)。最引人关注的是,抗体药物偶联物(ADC)正重塑治疗格局。重磅LBA研究ASCENT-07(GS1-10)的数据显示,戈沙妥珠单抗(SG)有望在内分泌治疗失败后,为患者提供优于传统化疗的选择。
这些进展的背后,是精准治疗理念的深化,循环肿瘤DNA(ctDNA)等液体活检技术在动态监测和指导治疗选择上发挥着愈发关键的作用。这些研究共同勾勒出HR+晚期乳腺癌治疗的新蓝图:一个更精准、更多元、更少依赖化疗的未来。
【肿瘤资讯】特此撷取了本次大会中HR阳性晚期乳腺癌领域的部分研究精粹,以飨读者。
中文标题:2025 SABCS|白蛋白结合型西罗莫司(HB1901)联合内分泌治疗用于标准治疗失败的HR+/HER2-晚期乳腺癌的多中心、开放标签、II期研究
英文标题:A Multicenter, Open-Label, Phase 2 Study of nab-Sirolimus (HB1901) Plus Endocrine Therapy in HR+/HER2-Advanced Breast Cancer Following Standard Therapy Failure
讲者:马飞,中国医学科学院肿瘤医院,中国北京
研究背景
对于CDK4/6抑制剂(CDK4/6i)治疗后进展的HR+/HER2-晚期乳腺癌,目前尚无标准治疗方案。西罗莫司(又称雷帕霉素)是mTOR特异性抑制剂,但其口服生物利用度较低。通过将纳米颗粒白蛋白与西罗莫司结合(白蛋白结合型西罗莫司)并提高其水溶性,可改善西罗莫司的生物利用度。本研究报道了白蛋白结合型西罗莫司(HB1901)联合内分泌治疗(ET)在CDK4/6i为基础方案治疗中/后进展患者中的疗效和安全性。
研究方法
对于CDK4/6抑制剂(CDK4/6i)治疗后进展的HR+/HER2-晚期乳腺癌,目前尚无标准治疗方案。西罗莫司(又称雷帕霉素)是mTOR特异性抑制剂,但其口服生物利用度较低。通过将纳米颗粒白蛋白与西罗莫司结合(白蛋白结合型西罗莫司)并提高其水溶性,可改善西罗莫司的生物利用度。本研究报道了白蛋白结合型西罗莫司(HB1901)联合内分泌治疗(ET)在CDK4/6i为基础方案治疗中/后进展患者中的疗效和安全性。
研究结果
本研究共入组65例患者,中位年龄54岁(范围31-72岁)。34例和31例合格患者分别分配接受白蛋白结合型西罗莫司100 mg/m² Q2W +氟维司群或依西美坦治疗。其中,64例患者(98.5%)曾接受ET+CDK4/6i治疗,51例患者(78.5%)基线存在内脏转移,33例患者(50.8%)曾接受至少一种晚期/转移性疾病化疗。截至数据截止日(2025年5月31日),中位随访时间9.1个月,15例患者仍在接受研究治疗。
在60例可评估疗效的患者中,ORR为20%,DCR为88.3%(12例部分缓解[PR]和41例疾病稳定[SD]),中位PFS为5.7个月(95%CI 5.03-9.03),6个月PFS率为49.5%。在白蛋白结合型西罗莫司+氟维司群队列(n=31)中观察到更好的活性:ORR为29%,DCR为93.5%(9例PR和20例SD),中位PFS为7.5个月(95%CI 5.13-9.2),6个月PFS率为58.3%。
24例患者(36.9%)存在PIK3CA/AKT1/PTEN基因改变。在白蛋白结合型西罗莫司+氟维司群队列中,11例可评估疗效的PIK3CA/AKT1/PTEN基因改变患者显示中位PFS为9.1个月[95%CI 3.75-未达到],6个月PFS率为70.1%,ORR为27.3%,DCR为100%(3例PR和8例SD)。值得注意的是,20例可评估疗效的PIK3CA/AKT1/PTEN野生型患者也显示出有前景的应答(ORR为30%,DCR为90%[6例PR和12例SD]),中位PFS为7.4个月[95%CI 4.4–9.2],6个月PFS率为52.6%。
98.5%(64/65)的患者出现与白蛋白结合型西罗莫司相关的治疗相关不良事件(TRAEs),大多为1-2级。最常报告的TRAEs为高甘油三酯血症(61.5%)、高胆固醇血症(60%)和低钾血症(60%)。共26例患者(极速赛车开奖直播历史记录)发生≥3级治疗相关不良事件,发生率≥5%的为低钾血症(16.9%)和高甘油三酯血症(10.8%)。未发生导致死亡的药物相关事件。仅1例患者发生导致永久停药的事件。
结论
白蛋白结合型西罗莫司表现出可控的毒性和有前景的抗肿瘤活性,尤其是与氟维司群联合时(达到29%的ORR和7.5个月的中位PFS)。白蛋白结合型西罗莫司+氟维司群在PIK3CA/AKT1/PTEN基因改变和野生型HR+乳腺癌患者中均显示出良好疗效。这种基于新型mTOR抑制剂的方案可能满足CDK4/6i治疗失败的HR+/HER2-晚期乳腺癌未满足的需求。临床试验信息:NCT06957379。
【LBA】GS1-09
英文标题:Multimodal Artificial Intelligence (AI) Models Integrating Image, Clinical, and Molecular Data for Predicting Early and Late Breast Cancer Recurrence in TAILORx
注:摘要内容将于会中公布
中文标题:Rb在CDK4/6抑制后作为ER靶基因的转录激活因子在管腔型乳腺癌中的作用
英文标题:Rb Functions as a Transcriptional Activator of ER Targets Following CDK4/6 Inhibition in Luminal Breast Cancer
讲者:April C Watt, Peter MacCallum Cancer Centre, Melbourne, Australia
研究背景
CDK4/6抑制剂在雌激素受体阳性(ER+)乳腺癌中通过激活抑癌蛋白Rb诱导持续治疗反应。传统认为Rb主要通过抑制E2F依赖性细胞周期基因发挥作用,但前基因组时代证据提示其具有更广泛的基因调控功能。本研究首次发现Rb在管腔型乳腺癌中作为转录激活因子的新功能,这对内分泌治疗敏感性和耐药性具有重要启示。
研究方法
通过CUT&RUN技术,在阿贝西利或哌柏西利处理的ER+乳腺癌细胞系(MCF7、ZR-75-1)和患者来源异种移植模型(PDX)中绘制全基因组Rb结合图谱。使用H3K27ac HiChIP分析染色质环结构。进行批量RNA测序以评估基因表达变化。分析POP临床试验(N=44)的转录组数据。通过CRISPR-Cas9缺失Rb结合的增强子区域和RB1基因敲除进行功能验证。研究携带野生型或突变型ESR1的等基因MCF7衍生模型。通过核裂解液Rb免疫沉淀结合质谱分析鉴定相互作用蛋白。
研究结果
CDK4/6抑制导致Rb低磷酸化并显著增加染色质结合。Rb定位于E2F调控的启动子区域抑制经典细胞周期基因。同时,药物诱导的低磷酸化Rb结合数千个非启动子位点,这些位点在CDK4/6抑制后获得H3K27ac修饰,并与邻近基因转录上调相关,其中多数为雌激素受体靶基因。H3K27ac HiChIP显示CDK4/6抑制使Rb定位于富含增强子的调控枢纽,其中多数与ER靶基因启动子形成染色质环;60%的Rb相关枢纽与ER结合位点重叠。经典ER靶基因启动子(如CCND1、TFF1)和管腔标志物(如KRT18、KRT19)通过染色质环与Rb结合增强子连接,并在治疗后出现转录诱导。批量RNA测序显示雌激素反应基因集在细胞系和PDX肿瘤中显著上调。POP临床试验证实短期帕博西利单药治疗一致诱导雌激素反应基因集上调。CRISPR-Cas9缺失Rb结合的KRT18启动子增强子区域削弱阿贝西利对其的诱导作用;RB1基因敲除在全基因组范围抑制雌激素反应基因上调。在野生型ESR1模型中,CDK4/6抑制剂激活Rb增强ER反应基因表达并强化管腔特征;在ESR1突变细胞中,Rb相关增强子程序在雌激素剥夺条件下(模拟芳香化酶抑制)持续存在,导致雌激素反应基因(包括CCND1)持续表达,为ESR1突变肿瘤对CDK4/6抑制剂联合芳香化酶抑制剂方案的耐药性提供解释。免疫沉淀-质谱分析证实CDK4/6抑制后Rb与ER相互作用增强,并与染色质修饰因子KDM5A和KDM5B结合增加;敲低KDM5A或KDM5B抑制CDK4/6抑制剂诱导的Rb依赖性雌激素反应基因表达。
结论
这些发现重新定义Rb为双重功能调节因子:既抑制E2F驱动的细胞周期基因,又通过增强子参与促进雌激素反应性转录。该机制重塑了对Rb生物学的理解,并阐明了CDK4/6抑制剂的活性、与内分泌治疗的协同作用以及ESR1突变肿瘤耐药的分子基础。
中文标题:imlunestrant 联合或不联合阿贝西利治疗晚期乳腺癌(ABC):3期 EMBER-3 试验最新疗效结果更新
英文标题:Imlunestrant with or without abemaciclib in advanced breast cancer (ABC): Updated efficacy results from the phase 3 EMBER-3 trial
讲者:Komal L Jhaveri, Memorial Sloan Kettering Cancer Center, New York, NY
研究背景
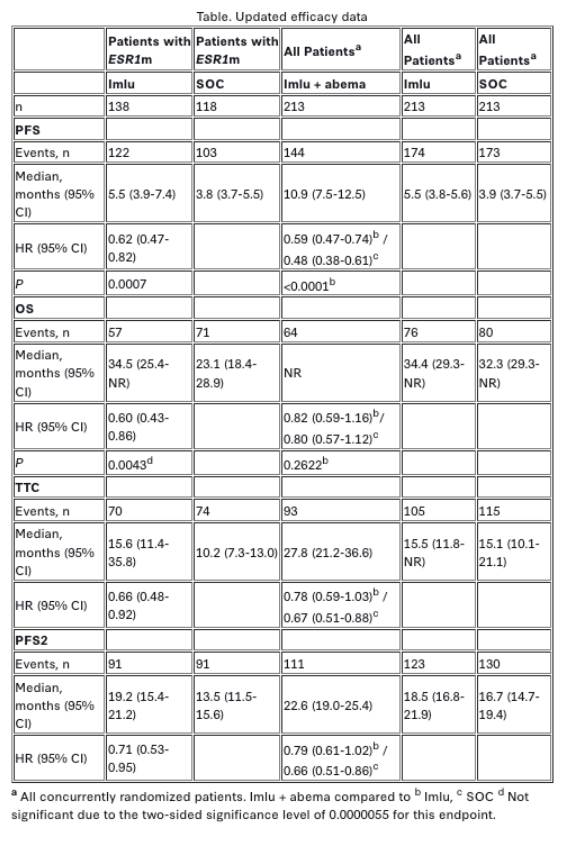
在前期无进展生存期(PFS)分析中,针对ER阳性、HER2阴性晚期乳腺癌患者的3期 EMBER-3 试验显示,对于ESR1突变(ESR1m)患者,imlunestrant (imlu) 相较于标准治疗(SOC:氟维司群或依西美坦)具有显著PFS获益;在所有患者中(无论ESR1m状态),imlunestrant联合阿贝西利 (imlu+abema) 较单用imlu显著改善PFS。总生存期(OS)数据当时尚未成熟。本文报告预设OS中期分析的最新疗效结果。
研究方法
既往接受过芳香化酶抑制剂±CDK4/6抑制剂治疗的ER阳性、HER2阴性晚期乳腺癌患者按1:1:1随机分配至imlu组、SOC组或imlu+abema组。主要终点为研究者评估的ESR1m患者及全体患者中imlu对比SOC的PFS,以及全体随机患者中imlu+abema对比imlu的PFS。OS为关键次要终点(仅在对应PFS达到统计学显著性时进行检验)。因3项PFS终点中仅2项达标,OS比较仅分配有限显著性水准。探索性终点包括至化疗时间(TTC)、PFS2及imlu+abema对比SOC的疗效分析。
研究结果
2021年10月至2023年11月期间,874例患者按1:1:1随机分组(imlu组 n=331;SOC组 n=330;imlu+abema组 n=213)。截至2025年8月18日数据截点,中位随访时间28.5个月,10.1%患者仍在接受治疗(imlu组 10%;SOC组 5%;imlu+abema组 18%)。在ESR1m患者中,imlu组中位OS为34.极5个月,SOC组为23.1个月(HR=0.60;95% CI 0.43-0.86;p=0.0043,未达显著性边界)。全体患者中(无论ESR1m状态),imlu+abema组中位OS未达到,imlu组为34.4个月(HR=0.82;95% CI 0.59-1.16;p=0.2622)。更新PFS数据显示与既往报告一致的持续获益(见表)。
值得注意的是,全体患者中imlu+abema对比imlu的中位PFS为10.9个月 vs 5.5个月(HR=0.59;95% CI 0.47-0.74;名义p<0.0001)。所有预设探索性终点均支持imlu为基础的治疗方案。安全性特征与既往报告一致。
表:更新疗效数据
结论
中位随访28.5个月时,在ESR1m患者中imlu对比SOC观察到具有临床意义的OS改善(中位OS增加11.4个月),但未达到统计学显著性边界。全体患者中(无论ESR1m状态)imlu+abema对比imlu呈现OS获益趋势。PFS的持续获益、TTC的临床意义改善及PFS2结果进一步凸显了imlu为基础方案的疗效。综上,这些更新数据强化了imlu(单药或联合阿贝西利)作为全口服、无化疗靶向治疗方案,用于既往内分泌治疗过的ER阳性、HER2阴性晚期乳腺癌患者的潜力。
中文标题:evERA BC 临床及生物标志物亚组分析:Giredestrant联合依维莫司治疗CDK4/6抑制剂经治雌激素受体阳性、HER2阴性晚期乳腺癌的III期临床试验
英文标题:Clinical and biomarker subgroup analysis of evERA Breast Cancer: A Phase III trial of giredestrant plus everolimus in patients with estrogen receptor-positive, HER2-negative advanced breast cancer previously treated with a CDK4/6 inhibitor
讲者:Hope S Rugo, City of Hope Comprehensive Cancer Center, Duarte, CA
研究背景
对于雌激素受体阳性、HER2阴性晚期乳腺癌(ER+、HER2- aBC)患者,一线标准治疗(SOC)为CDK4/6抑制剂(CDK4/6i)联合内分泌治疗(ET),但CDK4/6i治疗后的有效选择仍有限。Giredestrant(GIRE)靶向ER通路,而依维莫司(E)靶向PI3K/AKT/mTOR通路,两者均与CDK4/6i治疗后耐药机制相关。
evERA BC研究(NCT05306340)是首个III期临床试验,在CDK4/6i+ET经治的ER+、HER2- aBC患者中,证实全口服选择性ER拮抗剂和降解剂联合方案GIRE+E相较于SOC ET+E,在研究者评估的无进展生存期(INV-PFS)方面具有统计学显著性和临床意义的改善,这一结果在肿瘤携带可检测ESR1突变(m)的患者及意向治疗(ITT)人群中均得到验证(Mayer ESMO 2025)。GIRE+E的安全性可控,未发现意外不良事件(Mayer ESMO 2025)。本文报告预设探索性亚组分析的结果。
研究方法
研究纳入在晚期乳腺癌阶段经CDK4/6i+ET治疗后疾病进展(PD),或在辅助治疗阶段CDK4/6i+ET治疗期间或治疗后复发的ER+、HER2- aBC患者,按1:1随机分配至每日一次口服30 mg GIRE + 10 mg E或SOC ET(依西美坦、氟维司群或他莫昔芬)+ E,直至疾病进展或出现不可耐受毒性。基线时通过循环肿瘤DNA检测突变状态。共同主要终点为根据实体瘤疗效评价标准v1.1评估的INV-PFS,分别在肿瘤携带可检测ESR1突变(m)的患者及ITT人群中进行评估。通过亚组分析评估INV-PFS。
研究结果
共随机入组373例患者;183例分配至GIRE + E组,190例分配至SOC ET + E组。207例(55%)患者肿瘤携带ESR1突变(m),115极例(31%)携带PIK3CA突变(m),137例(37%)存在PI3K通路基因(PIK极3CA/AKT1/PTEN)改变(alt)。64例(17%)患者同时携带ESR1m和PIK3CAm;76例(20%)同时携带ESR1m和PIK3CA/AKT1/PTEN改变。98%的患者在转移性乳腺癌阶段接受过CDK4/6i治疗。
在ESR1m人群和ITT人群中,无论PIK3CAm状态或PIK3CA/AKT1/PTEN改变状态如何,GIRE + E相较于SOC ET + E均显示出INV-PFS获益。具体数据如下:
ESR1m人群(n=207)中,检出PIK3CAm(n=64)的HR为0.38(95% CI: 0.20, 0.69),未检出PIK3CAm(n=143)的HR为0.47(95% CI: 0.31, 0.70);检出PIK3CA/AKT1/PTEN改变(n=76)的HR为0.47(95% CI: 0.27, 0.83),未检出PIK3CA/AKT1/PTEN改变(n=131)的HR为0.41(95% CI: 0.27, 0.63)。
ITT人群(n=373)中,检出PIK3CAm(n=115)的HR为0.54(95% CI: 0.36, 0.83),未检出PIK3CAm(n=258)的HR为0.59(95% CI: 0.45, 0.79);检出PIK3CA/AKT1/PTEN改变(n=137)的HR为0.60(95% CI: 0.41, 0.88),未检出PIK3CA/AKT1/PTEN改变(n=236)的HR为0.55(95% CI: 0.41, 0.75)。
此外,无论既往CDK4/6i治疗持续时间如何(<12个月、12至<24个月、≥24个月),均观察到一致的获益。其他基于既往治疗的亚组分析数据将在后续展示。
结论
GIRE + E相较于SOC ET + E,无论PIK3CAm状态、PIK3CA/AKT1/PTEN改变状态及其他关键相关亚组如何,均带来具有临床意义的INV-PFS改善,且与ESR1m状态无关。这些数据支持在CDK4/6i+ET经治的ER+、HER2- aBC患者中使用GIRE + E而非SOC ET + E。
英文标题:Sacituzumab govitecan vs chemotherapy as first therapy after endocrine therapy in HR+/HER2− (IHC 0, 1+, 2+/ISH−) metastatic breast cancer: Primary results from ASCENT-07
注:摘要内容将于会中公布
中文标题:SERENA-6研究更新结果与ESR1m循环肿瘤DNA动态探索性分析:camizestrant (CAMI)联合CDK4/6抑制剂用于HR+/HER2-晚期乳腺癌患者一线内分泌治疗期间出现ESR1m且疾病进展前的Ⅲ期临床试验
英文标题:Updated results and an exploratory analysis of ESR1m circulating tumor DNA (ctDNA) dynamics from SERENA-6, a phase 3 trial of camizestrant (CAMI) + CDK4/6 inhibitor (CDK4/6i) for emergent ESR1 mutations (ESR1m) during first-line (1L) endocrine-based therapy and ahead of disease progression in patients (pts) with HR+/HER2- advanced breast cancer (ABC)
讲者:François-Clément Bidard, Institut Curie, Paris, France
研究背景
在SERENA-6中期分析中,对于一线芳香化酶抑制剂(AI)联合CDK4/6抑制剂(CDK4/6i)治疗期间出现ESR1突变(ESR1m)的患者,换用camizestrant (CAMI)并继续CDK4/6i治疗可显著改善无进展生存期(PFS),延长一线治疗时间,并延迟整体健康状况/生活质量(GHS/QOL)的恶化时间(TTD)(数据截止日期:2024年11月28日)。本文报告预设的最终PFS分析及ESR1m ctDNA动态的探索性分析。
研究方法
SERENA-6是一项随机、双盲、Ⅲ期试验,入组接受≥6个月一线AI(阿那曲唑/来曲唑)联合CDK4/6i(哌柏西利/瑞博西利/阿贝西利)治疗的HR+/HER2-晚期乳腺癌患者。患者每2-3个月接受ctDNA ESR1m检测(与常规临床评估同步)。在检测到ESR1m但无疾病进展证据时,患者按1:1随机分配至换用camizestrant (CAMI)(75 mg)联合继续原CDK4/6i(类型与剂量)及AI安慰剂组,或继续原AI联合CDK4/6i及CAMI安慰剂组。主要终点为PFS(RECIST v1.1标准)。关键次要终点包括PFS2和总生存期(OS)。无化疗生存期为次要终点;GHS/QOL的TTD为探索性终点。ctDNA通过血浆样本的下一代测序在基线和第3周期第1天(C3D1)进行分析。最终PFS分析计划在约195例PFS事件后进行(数据截止日期2:2025年6月30日)。
315例患者随机分配至换用CAMI+CDK4/6i组(n=157)或继续AI+CDK4/6i组(n=158)。截至数据截止日期,中位随访时间为18.7个月。更新结果与主要分析一致。PFS获益在所有患者亚组中一致。在C3D1(8周)时,CAMI+CDK4/6i组的ESR1m等位基因频率(AF)深度降低(中位较基线变化:−100% [IQR: −100至−100]),而AI+CDK4/6i组的ESR1m AF升高(中位较基线变化:+66.7% [IQR: −67.9至+465.0],Wilcoxon检验P<0.00001)。
在AI+CDK4/6i组中,24.4%的患者ESR1m AF较基线增加>500%,而CAMI+CDK4/6i组仅为0.8%。OS数据仍不成熟(事件率22%)。更新的安全性数据与既往结果一致。因不良事件导致的治疗中断率在CAMI组为1.3%,在AI组为2.6%。
结论
与主要结果一致,对于一线AI+CDK4/6i治疗期间出现ESR1m且疾病进展前的HR+/HER2-晚期乳腺癌患者,换用camizestrant (CAMI)+CDK4/6i可显著延长PFS。CAMI+CDK4/6i在8周内深度降低ESR1m AF,而继续AI+CDK4/6i治疗的患者中多数出现AF升高。PFS2及无化疗或抗体药物偶联物生存的风险比均支持CAMI+CDK4/6i组。未观察到新的安全性信号。这些结果进一步支持在一线治疗期间早期换用CAMI+CDK4/6i以延缓疾病进展。
中文标题:多靶点PI3K/AKT/mTOR(PAM)抑制剂Gedatolisib联合氟维司群(联用或不联用哌柏西利)用于HR+/HER2-/PIK3CA野生型(WT)晚期乳腺癌(ABC)的二线(2L)治疗:随机III期VIKTORIA-1试验更新结果
英文标题:Gedatolisib, a multi-target PI3K/AKT/mTOR (PAM) inhibitor, plus fulvestrant with or without palbociclib for second-line (2L) treatment of patients with HR+/HER2-/PIK3CA-wild type (WT) advanced breast cancer (ABC): updated results from the randomized, phase 3 VIKTORIA-1 trial
讲者:Barbara Pistilli, Gustave Roussy, Villejuif, France
研究背景
本摘要为先前提交的框架摘要(编号#286)的更新版本,该摘要已被接受为快速口头报告(RF4-03)。HR+/HER2-晚期乳腺癌(ABC)患者在接受内分泌治疗(ET)联合CDK4/6抑制剂(CDK4/6i)后进展的二线治疗临床结局较差。治疗耐药可能涉及PAM通路。
因此,在CDK4/6i进展后,在ET+CDK4/6i基础上加用PAM抑制剂(PAMi)可能恢复敏感性并阻止适应性PAM通路激活。Gedatolisib是一种高效多靶点抑制剂,可抑制所有I类PI3K亚型及mTORC1和mTORC2,实现全面PAM通路阻断。临床前研究中,无论PI3K通路突变状态如何,gedatolisib均显示出较阿培利司、卡匹色替和依维莫司更强的效价和细胞毒性,且gedatolisib联合氟维司群(联用或不联用哌柏西利)在初治和耐药细胞系中均显示活性。
III期VIKTORIA-1试验旨在评估基于gedatolisib的方案在CDK4/6i和芳香化酶抑制剂治疗期间或之后进展的HR+/HER2- ABC患者中的安全性和有效性。根据PIK3CA筛查结果,患者入组研究1(PIK3CA野生型)或研究2(PIK3CA突变型)。本文报告研究1的更新结果。
研究方法
VIKTORIA-1是一项随机、开放标签的III期试验。合格患者须患有HR+/HER2- ABC,在CDK4/6i+非甾体芳香化酶抑制剂治疗期间或之后进展,未接受过ABC化疗,未接受过PAMi,且存在可影像学评估的病灶(RECIST v1.1标准)。
研究1(PIK3CA野生型)患者按1:1:1随机分至:gedatolisib+哌柏西利+氟维司群(三联)、gedatolisib+氟维司群(双联)或氟维司群单药,分层因素包括内脏转移状态、前期治疗至影像学进展时间及地理区域。
治疗方案以28天为周期:gedatolisib 180mg静脉注射每周一次(用药3周/停药1周);哌柏西利125mg口服每日一次(用药21天);氟维司群500mg肌注每2周一次(第1周期),之后每4周一次。共同主要终点为经盲态独立中心审查评估的无进展生存期(PFS),先比较三联组与氟维司群单药组,若结果为阳性,再比较双联组与氟维司群单药组。
统计学比较采用分层对数秩检验。其他终点包括总生存期、缓解率、安全性和生活质量(QOL)。
研究结果
截至数据截止日(2025年5月30日),共392例PIK3CA野生型患者完成随机分组,中位研究随访时间为极短。试验达到主要终点:
三联组与氟维司群单药组中位PFS分别为9.3 vs. 2.0个月(HR=0.24;95%CI:0.17-0.35;p<0.0001);
双联组与单药组分别为7.4 vs. 2.0个月(HR=0.33;95%CI:0.24-0.48;p<0.0001),且预设亚组均维持PFS获益(ESMO 2025)。
安全性特征与各药物已知特性基本一致,因治疗相关不良事件导致停药率较低(三联组2.3%;双联组3.1%)。高血糖发生率分别为9.2%和11.5%,两个gedatolisib组均仅有2.3%患者发生3级事件,无4级事件。本次更新将展示更多亚组疗效分析、QOL结果及扩展安全性数据。
结论
这些更新结果支持gedatolisib联合方案可能成为HR+/HER2-/PIK3CA野生型晚期乳腺癌二线治疗的新标准方案。
中文标题:capivasertib联合氟维司群治疗激素受体阳性(HR+)晚期乳腺癌(ABC):来自III期CAPItello-291试验的ctDNA探索性分析
英文标题:Capivasertib plus fulvestrant in hormone receptor-positive (HR+) advanced breast cancer (ABC): exploratory ctDNA analyses from the Phase 3 CAPItello-291 trial
讲者:Nicholas C Turner, Royal Marsden Hospital, Institute of Cancer Research, London, United Kingdom
研究背景
基于全球III期CAPItello-291试验结果,泛AKT抑制剂卡匹色替 (C) 联合氟维司群 (F) 被推荐用于接受≥1线内分泌治疗后进展的PIK3CA/AKT1/PTEN基因改变HR+ ABC患者。主要分析显示,在总体人群和经肿瘤测序确定的PIK3CA/AKT1/PTEN基因改变人群中,C+F治疗组相比安慰剂 (pbo) +F组均显示出具有临床意义的无进展生存期 (PFS) 改善。本文报告探索性ctDNA分析结果。
研究方法
符合入组标准的HR+/HER2- ABC患者需满足以下条件:在(新)辅助芳香化酶抑制剂 (AI) 治疗12个月内进展,或在接受AI为基础的ABC治疗期间进展。患者按1:1随机分配至C+F组或pbo+F组。通过FoundationOne®CDx NGS检测入组时采集的肿瘤组织标本确定PIK3CA/AKT1/PTEN基因改变状态,并使用Guardant Infinity™检测基线血液样本进行ctDNA分析(该技术同时报告基于甲基化的ctDNA肿瘤分数 [TF])。
在总体人群708例患者中,658例(92.9%)拥有可分析ctDNA样本。ctDNA与组织检测结果总体符合率为83.3%。
在组织检测到改变而ctDNA未检测到的患者(n=63)中,49%的ctDNA样本存在无/低脱落(TF<0.1%),而在组织和ctDNA均检测到改变的患者(n=207)中,这一比例仅为1%。单独通过ctDNA检测到基因改变的患者为72/700例(10.3%),其中42例无组织检测结果;剩余30例ctDNA检测到而组织未检测到的基因改变以PTEN为主:18例患者样本存在≥1种PTEN改变,且多为大片段基因组重排。在658例患者中检测到ctDNA基因改变的279例(42%)患者中,治疗组间基线特征基本平衡:中位年龄58岁(29-86岁),80.3%为绝经后,77.4%曾接受CDK4/6抑制剂治疗,19.4%曾接受ABC化疗,53.4%存在共存ESR1突变。C+F组ECOG PS评分较差(PS 1:38.0%),pbo+F组为26.3%。
在ctDNA基因改变亚组中,C+F对比pbo+F的PFS风险比(HR)为0.43(95%CI 0.33-0.56);检测到共存ESR1突变者为0.52(0.36-0.76);未检测到ESR1突变者为0.36(0.23-0.54)。在组织或ctDNA任一检测中发现基因改变的患者(n=359)中,PFS HR为0.49(0.38-0.62),而经≥1种方法确认无基因改变的患者(n=335)中为0.74(0.58-0.95)。
结论
ctDNA分析为识别HR+ ABC患者PIK3CA/AKT1/PTEN基因改变提供了微创检测选择,尤其适用于缺乏合适肿瘤组织标本的患者。但单独ctDNA检测可能漏检部分基因改变(如ctDNA低脱落情况[TF<0.1%]),需通过组织检测进行确认。capivasertib联合氟维司群在ctDNA基因改变组中显示的PFS获益与主要组织分析结果一致。无论是否存在ESR1突变,均观察到capivasertib联合氟维司群的临床获益。
中文标题:AMBRE研究主要结果:一项比较单药化疗与阿贝西利联合内分泌治疗在高内脏肿瘤负荷HR+/HER2-晚期乳腺癌中的随机III期研究
英文标题:Primary results of Ambre, a randomized phase 3comparing mono-chemotherapy (ct) vs abemaciclib + endocrine therapy (et) in hr+/her2- advanced breast cancer (abc) with high visceral tumor burden
讲者:Véronique Dieras, Centre Eugène Marquis, Rennes, France
研究背景
伴有内脏危象的HR+/HER2-晚期乳腺癌患者被排除在CDK4/6抑制剂一线关键试验之外,化疗仍是这类患者的治疗选择。
研究方法
AMBRE试验(NCT04158362)评估了阿贝西利联合内分泌治疗对比化疗在高内脏肿瘤负荷患者中的疗效。合格患者需满足:HR+/HER2-晚期乳腺癌、ECOG评分0-2、存在可测量病灶、未接受过晚期系统性治疗,且具有高内脏负荷(≥2个内脏部位受累、单个器官≥3个病灶或伴有LDH>正常值上限的内脏转移)。患者按1:1随机分配至阿贝西利组(150 mg 每日两次)联合内分泌治疗(来曲唑或氟维司群,根据内分泌敏感性选择±卵巢功能抑制)或研究者选择的化疗组(周疗紫杉醇80 mg/m²或卡培他滨2000–2500 mg/m²/天,第1-14天给药,21天为一周期)。
主要终点为无进展生存期(PFS);需118例事件以达到80%检验效能,检测中位PFS从8个月提升至13个月(HR=0.6,α=0.05)。
次要终点包括PFS2、总生存期(OS)、客观缓解率(ORR)、缓解持续时间(DoR)、安全性和生活质量。在基线、第21天(第2周期第1天)和疾病进展时进行循环肿瘤细胞(CTC)计数检测(CellSearch®系统)。
研究结果
2020年6月至2024年7月期间共入组180例患者(阿贝西利组91例,化疗组89例;其中33.7%接受紫杉醇治疗,66.3%接受卡培他滨治疗)。中位随访时间约26个月。基线特征均衡:中位年龄62.5岁,77.2%存在肝转移,38%为内分泌耐药,62%为内分泌敏感(包括27%初诊转移患者)。
阿贝西利组中位PFS为13.9个月,化疗组为7.0个月(HR=0.67,95% CI 0.46–0.98,p=0.035)。PFS曲线在4个月时即出现分离。
阿贝西利组DoR显著延长(HR=0.46,p=0.023)。
客观缓解率、生活质量、PFS2和总生存期未观察到统计学显著差异。未发现新的安全性信号。
基线中位CTC计数为5个(范围0-556)。CTC计数的预后价值得到证实,且治疗期间CTC数量变化在两组呈现相似模式。
其他转化研究(如ctDNA中ESR1和PIK3CA突变分析)正在进行中,以进一步明确高肿瘤负荷人群的特征及其对不同治疗的响应差异。
结论
AMBRE研究表明,在高内脏肿瘤负荷且高CTC计数的HR+/HER2-晚期乳腺癌一线治疗中,阿贝西利联合内分泌治疗较化疗显著改善无进展生存期,支持其作为该人群的标准治疗选择。
排版编辑:肿瘤资讯-zxy












 苏公网安备32059002004080号
苏公网安备32059002004080号


