2025年第48届圣安东尼奥乳腺癌研讨会(SABCS)汇聚了全球顶尖的乳腺癌研究成果。HR+早期乳腺癌领域的研究聚焦于通过前沿技术实现更精准的风险评估与个体化治疗,旨在最大程度预防复发。
其中,多模态人工智能(AI)模型的应用成为一大亮点(【LBA】GS1-09),通过整合图像、临床与分子数据,为预测远期复发风险提供了全新视角。同时,液体活检技术也展现出巨大潜力。PALLAS试验的分析(RF3-04)表明,利用循环肿瘤DNA(ctDNA)评估分子残留病(MRD),不仅有助于预后判断,还能预测患者能否从辅助CDK4/6抑制剂治疗中获益,推动了辅助治疗的精准化。
此外,研究者们也在不断优化传统治疗策略,例如通过新检测方法筛选能从延长内分泌治疗中获益的患者群体(GS3-05),并对大型辅助试验的长期生存数据进行深度分析(RF7-07),为临床实践提供了宝贵的循证依据。
【肿瘤资讯】特此整理了本次大会中四项HR阳性早期乳腺癌领域的研究进展,以飨读者。
英文标题:Multimodal Artificial Intelligence (AI) Models Integrating Image, Clinical, and Molecular Data for Predicting Early and Late Breast Cancer Recurrence in TAILORx
注:摘要内容将于会中公布
GS3-05
中文标题:评估内分泌治疗敏感性(SETER/PR)检测在NRG/NSABP B-42试验中预测延长内分泌治疗获益的价值
英文标题:Evaluation of the Sensitivity to Endocrine Therapy (SETER/PR) assay to predict benefit from extended endocrine therapy in the NRG/NSABP B-42 trial
讲者:Eleftherios P Mamounas, AdventHealth Cancer Institute, Orlando, FL
研究背景
SETER/PR内分泌治疗敏感性指数通过测量石蜡包埋组织的内分泌受体相关转录活性,在实验室内及实验室间均具有高度可重复性。该指数与受体配体结合活性相关,可预测姑息治疗和辅助治疗背景下内分泌治疗的早期药效学反应及生存结局。本研究在NSABP B-42试验中评估SETER/PR指数能否预测延长来曲唑治疗(ELT)的获益。该试验针对已完成5年辅助内分泌治疗(芳香化酶抑制剂[AI]或他莫昔芬序贯AI)的HR阳性绝经后乳腺癌患者,比较ELT与安慰剂的疗效。
研究方法
使用QuantiGene Plex微球杂交检测技术(ThermoFisher),对B-42试验中HER2阴性样本的两张未染色切片和一张H&E染色切片进行SETER/PR指数检测。分析截断值基于参考队列样本的四分位范围(1.10 ≤ SETER/PR指数 ≤ 2.10)和平均SETER/PR指数(1.50)预先设定,该参考队列符合B-42试验入组标准。主要终点为无乳腺癌间期(BCFI)。采用分层Cox比例风险模型计算风险比及95%置信区间(HR, 95%CI),显著性设定为p<0.05。
研究结果
从1,556例符合条件且HER2阴性的患者中获取含肿瘤组织的乳腺癌组织块,其中1,489例(96%)通过质量控制并纳入研究队列。研究队列与其他HER2阴性B-42患者的基线特征无统计学显著差异。在研究队列中,ELT使10年无乳腺癌间期事件发生率降低4.2%(HR 0.69,95%CI 0.51-0.94,p=0.016)。在1,489例患者中,59%的SETER/PR指数处于1.10-2.10范围,42% ≥1.50。按主要四分位范围截断值(1.10 ≤ SETER/PR指数 ≤ 2.10 vs 其他)分组未观察到ELT疗效差异。SETER/PR指数 ≥1.50的患者从ELT中获益显著(HR 0.53,95%CI 0.32-0.88,p=0.014),而指数 <1.50者未显示显著获益(HR 0.82,95%CI 0.56-1.20,p=0.31),治疗与SETER/PR指数交互作用不显著(p=0.14)。SETER/PR指数 ≥1.50患者的10年无乳腺癌间期绝对获益为7.1%(安慰剂组:14.9%,来曲唑组:7.8%),指数 <1.50者为2.1%(安慰剂组:14.5%,来曲唑组:12.4%)。按淋巴结状态分层分析:淋巴结阳性且SETER/PR指数 ≥1.50的患者10年无乳腺癌间期事件绝对减少10.5%(安慰剂组:19.2%,来曲唑组:8.7%;HR 0.52,95%CI 0.26-1.06),而指数 <1.50者减少3%(安慰剂组:20.1%,来曲唑组:17.1%;HR 0.84,95%CI 0.50-1.40)。淋巴结阴性且指数 ≥1.50患者减少5.2%(安慰剂组:12.4%,来曲唑组:7.2%;HR 0.55,95%CI 0.27-1.11),指数 <1.50者减少1.9%(安慰剂组:10.8%,来曲唑组:8.9%;HR 0.80,95%CI 0.44-1.43)。将SETER/PR指数作为连续变量分析时,其数值增加与ELT相对获益提升相关(治疗与SETER/PR指数[每单位增加]交互作用HR 0.71,95%CI 0.43-1.18)。
结论
SETER/PR指数 ≥1.50的患者亚组从ELT中获益更显著,支持“内分泌治疗敏感性较高的癌症患者可能从延长内分泌治疗中获益更多”的假设。临床试验编号:NCT00382070;资助信息:NCI UH3CA276603、U10 CA180868、-180822、UG1CA189867、U24CA196067;韩国健康技术研发项目。
中文标题:基于肿瘤信息的循环肿瘤DNA分析评估分子残留病灶在PALLAS试验中对哌柏西利预后和疗效预测的价值
英文标题:Tumor-informed circulating tumor DNA analysis to assess molecular residual disease for prognosis and prediction of benefit from palbociclib in the PALLAS trial
讲者:Heather A Parsons, Fred Hutchinson Cancer Center, Seattle, WA
研究背景
PALLAS(哌柏西利辅助治疗协作研究,NCT02513394)是一项随机III期临床试验,旨在比较CDK4/6抑制剂哌柏西利联合医生选择的辅助内分泌治疗与单用内分泌治疗对II-III期激素受体阳性/HER2阴性(HR+/HER2-)乳腺癌患者的疗效。分子残留病灶(MRD)的循环肿瘤DNA(ctDNA)检测是一项预设的生物标志物分析,用于识别高复发风险患者。
研究方法
从总体研究人群中随机选择具备可用肿瘤组织块、至少一份基线(治疗前)血浆样本以及全血或血沉棕黄层的PALLAS试验参与者。收集第1周期第1天(C1D1)、第6周期第1天(C6D1)及治疗结束(EOT)时的血浆样本,并进行处理与保存。从原发肿瘤组织提取核酸;若原发组织不足,则采用新辅助治疗后肿瘤组织(需满足样本量充足、组织面积>25 mm²且肿瘤细胞核比例≥20%的条件)。利用肿瘤组织及匹配正常DNA的下一代测序数据构建个体化Signatera™检测(Natera公司),用于外周血MRD评估。ctDNA结果以平均肿瘤分子数/毫升血浆(MTM/mL)报告。主要终点为基于ctDNA状态的远处无复发生存期(DRFI)。采用Cox比例风险模型评估预后及预测性交互作用。为减少偏倚,生物样本库及实验室团队对受试者信息设盲。
研究结果
本研究共随机纳入1280名参与者进行预设的ctDNA亚组分析。目前正在进行肿瘤组织的全外显子组测序(WES)和全基因组测序(WGS),Signatera检测结果即将生成。将基于该队列中位随访7年的数据,报告MRD状态(阳性/阴性)及MTM/mL与DRFI的相关性结果。
结论
本项预设分析正在进行中,该研究将首次提供HR+/HER2-乳腺癌辅助治疗随机III期试验中按治疗组别报告的MRD状态数据。
中文标题:PALLAS试验中ER+乳腺癌的辅助哌柏西利治疗(ABCSG-42/AFT-05/PrE0109/BIG-14-13):复发后治疗与总生存期分析
英文标题:Adjuvant Palbociclib for ER+ Breast Cancer in the PALLAS Trial (ABCSG-42/AFT-05/PrE0109/BIG-14-13): Post-Recurrence Treatment and Overall Survival
讲者:Angela DeMichele, University of Pennsylvania, Philadelphia, PA
研究背景
CDK4/6抑制剂(CDK4/6i)联合内分泌治疗(ET)已成为晚期及高风险早期激素受体阳性(HR+)、HER2阴性(HER2-)乳腺癌的标准治疗方案。PALLAS试验评估了在II-III期HR+/HER2-乳腺癌患者中,在辅助内分泌治疗基础上联合2年哌柏西利(ET/P)对比单用内分泌治疗(ET)的疗效。现报告7年总生存期(OS)结果及复发后治疗的影响。
研究方法
这项全球III期试验将患者随机分配至至少5年内分泌治疗联合或不联合2年哌柏西利组。主要终点为无侵袭性疾病生存期(iDFS);无远处复发生存期(DRFS)和总生存期(OS)为预设终点。采用Kaplan-Meier估计值和Cox及Fine & Gray模型计算风险比(HR)。复发后OS定义为自首次远处复发(DR)至死亡的时间。复发后OS模型同时校正临床/病理因素(包括无DR年数、DR部位)和时间依赖性DR后治疗(化疗、CDK4/6i)。
研究结果
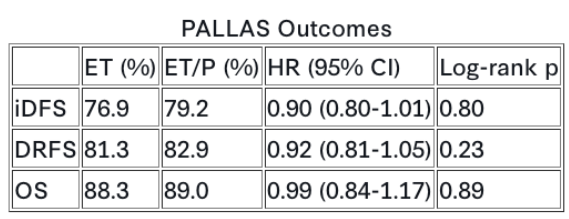
全球21个国家406个中心在3年内共入组5,796例患者。在意向治疗(ITT)人群中,中位随访82.7个月时,iDFS、DRFS和OS的7年结果见下表。
 共781例患者发生远处复发(DR)(ET/P组377例,单用ET组404例),两组患者及疾病特征均衡。与单用ET组相比,ET/P组内脏转移比例更高(46% vs. 36%),非内脏转移比例更低(61% vs. 68%)(p=0.03)。未校正的复发后OS在ET/P组显著差于单用ET组(中位22.6 vs. 27.9个月,HR 1.21,95%CI 1.01-1.46,p=0.04)。但单用ET组接受任何复发后CDK4/6i治疗的比例显著高于ET/P组(66% vs. 41%),且疾病进展后启动CDK4/6i治疗的时间显著更短(校正地区、骨/内脏转移类型、无DR时间和年龄后,HR 0.50,95%CI 0.41-0.61,p<0.001)。
共781例患者发生远处复发(DR)(ET/P组377例,单用ET组404例),两组患者及疾病特征均衡。与单用ET组相比,ET/P组内脏转移比例更高(46% vs. 36%),非内脏转移比例更低(61% vs. 68%)(p=0.03)。未校正的复发后OS在ET/P组显著差于单用ET组(中位22.6 vs. 27.9个月,HR 1.21,95%CI 1.01-1.46,p=0.04)。但单用ET组接受任何复发后CDK4/6i治疗的比例显著高于ET/P组(66% vs. 41%),且疾病进展后启动CDK4/6i治疗的时间显著更短(校正地区、骨/内脏转移类型、无DR时间和年龄后,HR 0.50,95%CI 0.41-0.61,p<0.001)。
相反,单用ET组启动进展后化疗的时间显著长于ET/P组(HR 1.31,95%CI 1.07-1.61,p=0.01)。经临床因素和DR后治疗校正后,OS差异不再显著(HR 1.05,95%CI 0.85-1.28,p=0.65)。3个月界标分析显示,校正DR后3个月内启动CDK4/6i治疗后,对OS的影响相似(未校正HR 1.24,p=0.03 vs. 校正后HR 1.15,p=0.22)。 指标 单用ET (%) ET/P (%) HR (95% CI) Log-rank p值 iDFS 76.9 79.2 0.90 (0.80-1.01) 0.80 DRFS 81.3 82.9 0.92 (0.81-1.05) 0.23 OS 88.3 89.0 0.99 (0.84-1.17) 0.89
结论
PALLAS试验揭示了DR后治疗模式的显著差异对OS的影响。辅助哌柏西利治疗后转移性CDK4/6i使用减少/延迟与OS显著较差相关,提示辅助CDK4/6i治疗后复发患者仍可能从转移性CDK4/6i治疗中获益。这对辅助CDK4/6i治疗后复发患者的最佳治疗策略具有重要启示,需进一步研究确定这是治疗特异性现象还是总体生物学效应。
排版编辑:肿瘤资讯-zxy












 苏公网安备32059002004080号
苏公网安备32059002004080号


