骨骼是晚期肿瘤患者最常见的转移部位之一,尤其在乳腺癌、前列腺癌和肺癌中最为常见。肿瘤细胞转移至骨骼后,通过与骨微环境相互作用,形成肿瘤细胞与骨细胞之间的“恶性循环”过程,导致骨相关事件(SREs)的发生影响患者的生活质量和生存。以地舒单抗为代表的RANKL抑制剂已被证实可显著降低SREs风险。
最新研究发现,RANKL-RANK信号通路不仅参与骨破坏,也在肿瘤免疫微环境的调节方面起重要作用。RANKL抑制剂可能通过抑制破骨细胞生成,减少骨桥蛋白(OPN)表达进而增强免疫检查点阻断(ICB)效果,另外RANKL抑制剂可能通过调节肿瘤免疫微环境延缓CDK4/6抑制剂的耐药,实现“骨保护+免疫重塑”的双重获益,为骨转移患者带来延长生存的新策略。
本期特邀专家——李 俏 教授
中国医学科学院肿瘤医院内科 主任医师 、硕导
中国研究型医院学会乳腺专业委员会青委副主委
北京乳腺病防治学会健康管理专委会秘书长
北京健康促进会乳腺癌防治专家委员会主任委员
北京乳腺病防治学会青年学术委员会副主委
北京中西医慢病防治促进会乳腺癌整合防治专委会常委兼青委主委
JCO中文版、CANCER中文版、《中华乳腺病杂志(电子版)》、《临床与病理杂志》、《中国医学前沿杂志》编委
经典研究回顾:RANKL抑制剂显著降低SREs发生风险,提高患者生活质量
地舒单抗三项关键临床试验分别纳入乳腺癌骨转移患者(N=2046)、转移性去势抵抗性前列腺癌(N=1901)和其他实体肿瘤骨转移及多发性骨髓瘤患者(N=1776),与唑来膦酸组进行头对头非劣效研究对比,研究结果显示地舒单抗在预防SREs方面优于唑来膦酸[1-3],且较唑来膦酸在延迟患者疼痛加重时间、减少阿片类药物使用、改善生活质量等方面更优 [4,5]。
Allan等人[6]对上述三项临床试验进行汇总分析,结果显示地舒单抗组和唑来膦酸组患者首次出现SRE的中位时间分别为27.66个月和19.45个月,地舒单抗组相较于唑来膦酸组进一步延迟SREs发生8.21个月,降低首次SRE风险17%(HR=0.83,95%CI:0.76-0.90, P<0.001),降低累积SREs发生风险18%(RR=0.82,95%CI:0.75-0.89,P<0.001)。
对三项Ⅲ期研究中的实体瘤骨转移患者进行汇总分析(乳腺癌骨转移患者N=2046、转移性去势抵抗性前列腺癌N=1901和其他实体肿瘤患者N=1597),比较地舒单抗和唑来膦酸在减轻疼痛、镇痛药使用以及生活质量改善等方面的差异,结果显示基线没有/轻度疼痛的患者,地舒单抗较唑来膦酸可进一步延迟中重度疼痛出现的时间(中位时间6.5个月 vs 4.7个月;HR=0.83;95%CI:0.76-0.92;P<0.001),延迟具有临床意义的疼痛干预时间(中位时间10.3个月 vs 7.7个月;HR=0.83;95%CI:0.75-0.92;P<0.001),延迟强阿片类药物使用以及改善生活质量方面地舒单抗也显示出更好的效果[7]。
RANKL抑制剂再探索:调节肿瘤微环境,协同增强抗肿瘤效果
RANKL抑制剂抑制破骨细胞生成骨桥蛋白(OPN),增加免疫治疗效果
免疫检查点抑制剂(ICI)是治疗多种实体肿瘤患者的基石,增强或者维持其免疫效应对实体肿瘤患者的抗肿瘤治疗效果尤为重要。有研究[8]显示骨转移患者相较于无骨转移患者,ICB治疗后客观缓解率更低(ORR 18.4% vs.29.2%),疾病进展和死亡风险更高(图1),其机制可能与骨转移瘤通过破骨细胞产生OPN减少CD8+T细胞浸润进而抑制骨外病灶对ICI的应答有关(图2)。
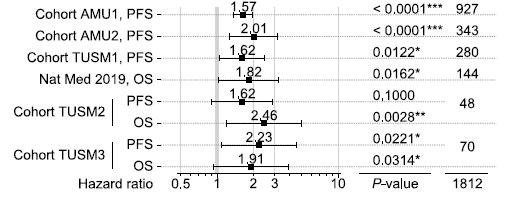 图1 接受ICB治疗的实体肿瘤患者根据是否骨转移进行分层的无进展生存期(PFS)和总生存期(OS)森林图
图1 接受ICB治疗的实体肿瘤患者根据是否骨转移进行分层的无进展生存期(PFS)和总生存期(OS)森林图
AMU1和AMU2为实体肿瘤队列;TUSM1、TUSM2和TUSM3为NSCLC队列;Nat Med 2019为黑色素瘤队列
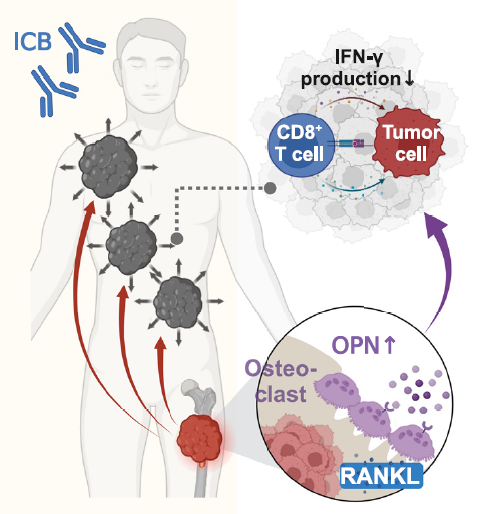 图2 骨转移灶通过破骨细胞上调OPN表达抑制骨外病灶对ICB的应答示意图
图2 骨转移灶通过破骨细胞上调OPN表达抑制骨外病灶对ICB的应答示意图
基础研究显示RANKL抑制剂可通过阻断破骨细胞的生成改善骨外病灶对免疫检查点抑制剂的应答、减少肺结节形成并降低血清中OPN水平(图3);临床研究结果也显示RANKL抑制剂地舒单抗联合ICI相较于双膦酸盐联合ICI可改善骨转移患者骨外肿瘤对ICI治疗的响应,并延长患者的无进展生存期(PFS)(图4)。
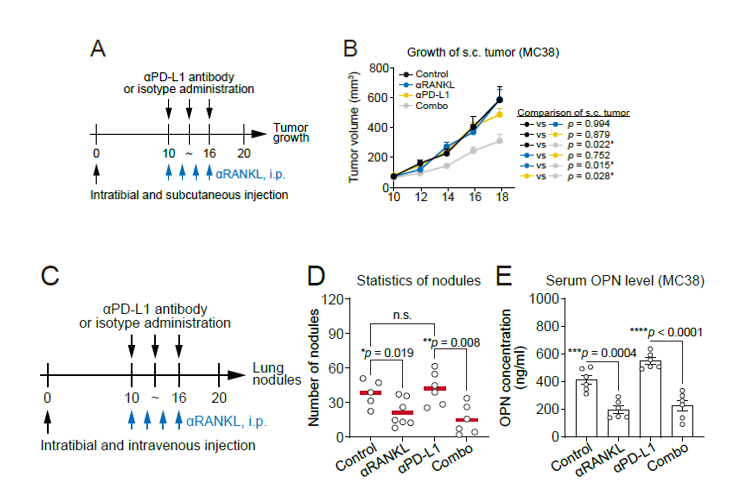 图3 RANKL抑制剂联合ICI治疗胫骨转移小鼠效果
图3 RANKL抑制剂联合ICI治疗胫骨转移小鼠效果
A RANKL抑制剂联合PD-L1抑制剂治疗胫骨转移小鼠(SC+IT模型)肿瘤生长评估
B RANKL抑制剂联合PD-L1抑制剂治疗胫骨转移小鼠后骨外病灶肿瘤生长曲线
C RANKL抑制剂联合PD-L1抑制剂治疗胫骨转移小鼠(SC+IT模型)肺结节评估
D RANKL抑制剂联合PD-L1抑制剂治疗后胫骨转移小鼠后肺结节数量变化
E RANKL抑制剂联合PD-L1抑制剂治疗胫骨转移小鼠后血清中OPN变化
备注:SC+IT模型小鼠,通过皮下注射(s.c.)肿瘤细胞模拟原发肿瘤并通过胫骨注射(i.t.)肿瘤细胞模拟骨转移病灶,制备肿瘤骨转移模型小鼠。
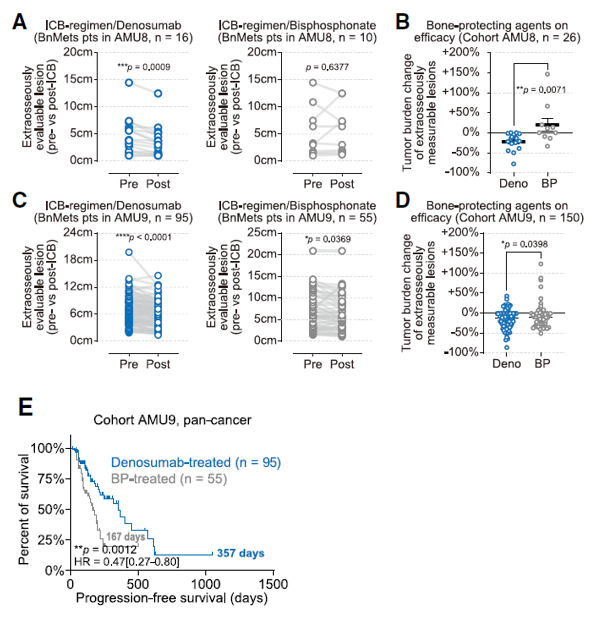 图4 ICI联合地舒单抗或双膦酸盐对患者肿瘤负荷和PFS的影响
图4 ICI联合地舒单抗或双膦酸盐对患者肿瘤负荷和PFS的影响
(B和D)在队列AMU8(B)和AMU9(D)中,骨转移患者接受地舒单抗或双膦酸盐(BP)治疗的骨外肿瘤负荷变化
(E)队列AMU9骨转移患者接受地舒单抗或双膦酸盐联合ICI治疗的PFS
RANKL抑制剂促进抗肿瘤免疫微环境形成,减少CDK4/6抑制剂耐药发生
内分泌治疗是HR+乳腺癌患者主要的全身抗肿瘤治疗手段,CDK4/6抑制剂的上市改变了HR+复发转移乳腺癌的治疗格局,CDK4/6抑制剂联合内分泌治疗成为治疗HR+乳腺癌患者的首选标准治疗方案,但CDK4/6抑制剂耐药仍是不可避免的难题。基础研究[9]显示RANK信号通路可能通过干扰素反应和替代细胞周期介质参与对CDK4/6抑制剂的耐药过程,肿瘤细胞可能利用RANK通路作为逃避免疫监视的机制。通过制备Luminal型乳腺肿瘤小鼠模型,分别给予安慰剂、RANKL抑制剂、CDK4/6抑制剂哌柏西利以及RANKL抑制剂+哌柏西利进行治疗,治疗后(第11-14天)对肿瘤切片进行RNA测序和免疫组化处理,结果显示RANKL抑制剂联合哌柏西利相较于单药组可抑制肿瘤的生长,降低Ki67的表达(图5);且有助于促进抗肿瘤免疫微环境的形成(图6)。
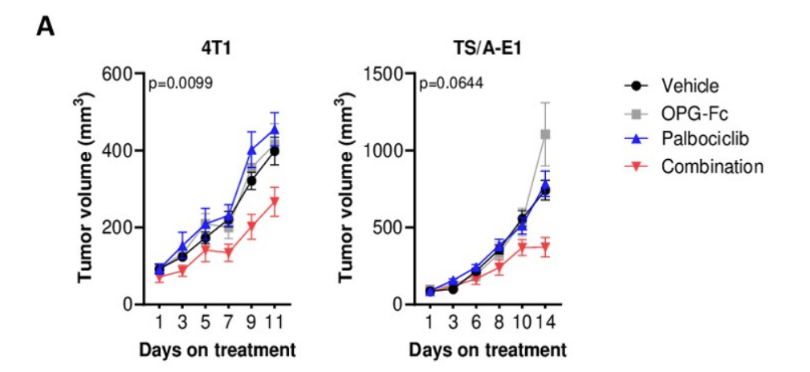
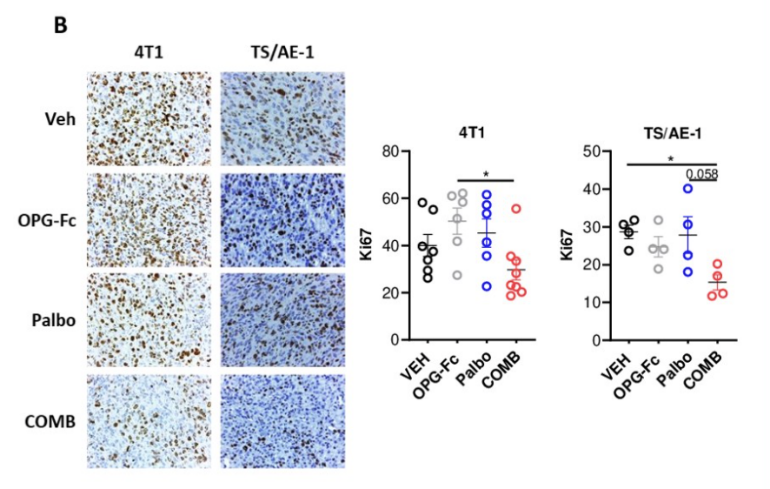 图5 A完成治疗的动物肿瘤生长曲线
图5 A完成治疗的动物肿瘤生长曲线
B完成治疗的动物肿瘤中Ki67的免疫组化(IHC)分析
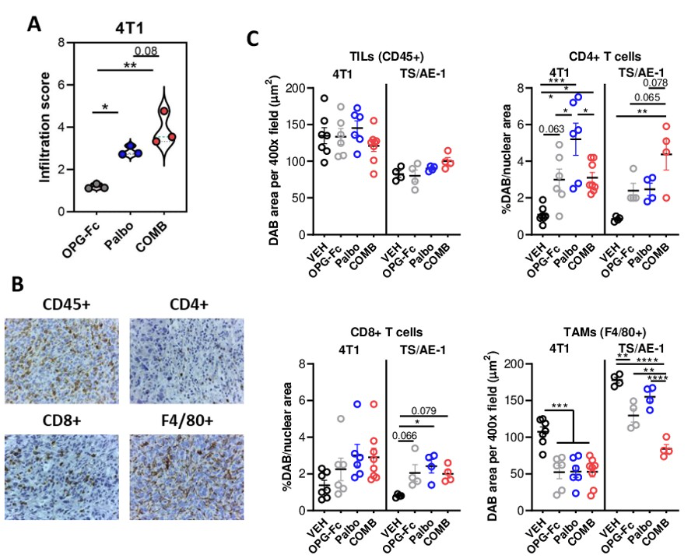
B 非坏死肿瘤实组织中细胞免疫组化分析
C 非坏死肿瘤组织中免疫细胞定量分析
土耳其一项回顾性研究[10]纳入158例HR+/HER2-接受CDK4/6抑制剂联合骨改良药物治疗(地舒单抗或唑来膦酸)的晚期骨转移患者,主要终点和次要终点分别为OS和PFS。研究结果显示对于总人群,CDK4/6抑制剂联合地舒单抗组PFS和OS改善更明显(图7)。亚组分析则显示对于<60岁患者(HR=0.33,P<0.01)、HER2 1+的患者(HR=0.09,P=0.01)以及内分泌耐药患者(HR=0.42,P=0.02),CDK4/6抑制剂联合地舒单抗较联合唑来膦酸可显著改善预后。
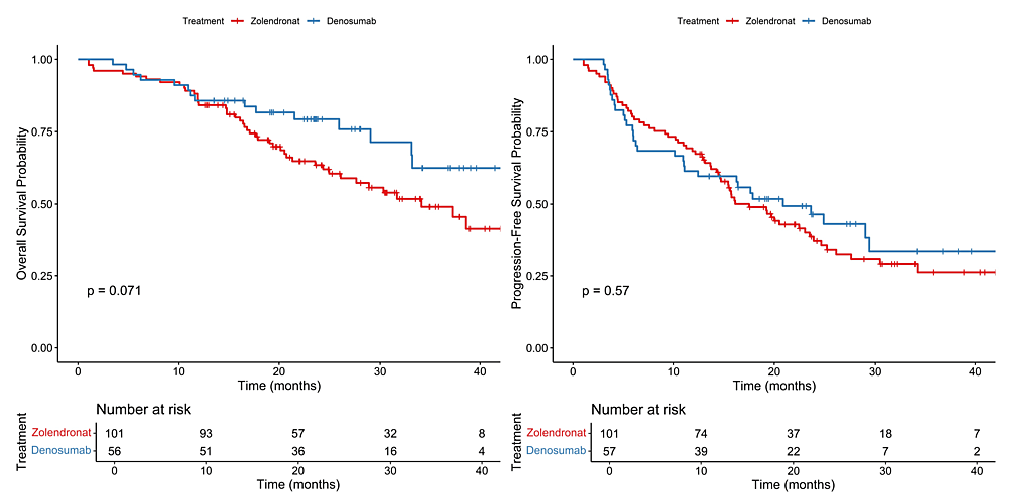 图7 CDK4/6抑制剂联合地舒单抗或唑来膦酸的KM生存曲线
图7 CDK4/6抑制剂联合地舒单抗或唑来膦酸的KM生存曲线
专家点评
实体瘤一旦累及骨骼,破骨细胞过度活化会导致骨破坏、疼痛,甚至出现病理性骨折、脊髓压迫等一系列骨相关事件(SREs),降低患者生活质量并增加治疗成本。自RANKL抑制剂地舒单抗在国内上市后,晚期肿瘤骨转移患者皆获益明显。地舒单抗通过高亲和力中和RANKL,直接阻断RANKL-RANK信号通路,抑制破骨细胞生成、分化和功能,从影像上可以观察到骨转移病灶持续修复和密度增加,且患者SREs的发生明显减少;此外,其皮下给药便利、无需监测肾功能,也避免了双膦酸盐相关的急性期反应或肾毒性。
更值得关注的是,RANKL/RANK信号通路不仅是骨破坏的“开关”,也可能是肿瘤免疫微环境(TIME)的“调节器”。RANKL/RANK在肿瘤免疫微环境的多种细胞表明存在分布,可能通过多种途径抑制肿瘤免疫应答,降低免疫治疗效果或导致耐药。从目前发表的基础和临床研究中可以看到RANKL抑制剂可能通过调节肿瘤免疫微环境对抗肿瘤治疗起到协同作用:1)通过抑制破骨细胞的生成减少OPN的表达以增强骨转移患者对免疫治疗的应答。期待未来可以进一步探索RANKL/RANK信号通路影响免疫应答的其他机制以及RANKL抑制剂联合不同抗肿瘤方案对骨转移患者的免疫应答效果;2)或减少因RANK信号通路参与的干扰素反应和替代细胞周期介质导致的患者对CDK4/6抑制剂耐药。
因此,对于合并骨转移的实体肿瘤患者,临床常规在抗肿瘤治疗基础上尽早联合RANKL抑制剂地舒单抗,把“骨保护”作为全程管理的一部分。未来可能通过“骨保护+免疫重塑”双路径改善患者生活质量并延长患者生存,实现真正意义上的“骨-瘤共治”。
[1]Stopeck AT, Lipton A, et al.Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J Clin Oncol. 2010 Dec 10;28(35):5132-9.
[2] Fizazi K, Carducci M, Smith M, et al. Denosumab versus zole-dronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet. 2011;377:813-822.
[3] Henry DH, Costa L, Goldwasser F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer (excluding breast and prostate cancer) or multiple myeloma. J Clin Oncol. 2011;29:1125-1132.
[4] Cleeland CS, et al. Pain outcomes in patients with advanced breast cancer and bone metastases: results from a randomized, double-blind study of denosumab and zoledronic acid. Cancer. 2013 Feb 15;119(4):832-8. doi: 10.1002/cncr.27789.
[5] Martin M, Bell R, et al. Bone-related complications and quality of life in advanced breast cancer: results from a randomized phase III trial of denosumab versus zoledronic acid. Clin Cancer Res. 2012 Sep 1;18(17):4841-9. doi: 10.1158/1078-0432.CCR-11-3310.
[6]Lipton A, Fizazi K, Stopeck AT, et al. Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials. Eur J Cancer. 2012 Nov;48(16):3082-3092.
[7]Brown-Glaberman U, Stopeck AT. Role of denosumab in the management of skeletal complications in patients with bone metastases from solid tumors. Biologics 2012;6:89–99.
[8] Cheng JN, et al. Bone metastase diminish extraosseous response to checkpoint blockade immunotherapy through osteopontin-producing osteoclasts. Cancer Cell. 2025 Jun 9;43(6):1093-1107.e9.
[9] 2024 SABCS P1- 02 -29
[10]Akdag G, et al.Exploring the Clinical Impact of RANK Pathway Inhibition in Advanced Breast Cancer: Insights From a Retrospective Study on CDK4/6 Inhibitors and Antiresorptive Therapy. Cureus. 2024 Jun 28;16(6):e63362.
排版编辑:肿瘤资讯-zly











 苏公网安备32059002004080号
苏公网安备32059002004080号


