

三阴性乳腺癌(TNBC)因缺乏明确的生物标志物,现有全身治疗手段仍以化疗为主。在 TNBC患者中,老年群体占比达10%~21%[1-3]。这类患者多伴随心、脑、肾疾病等诸多慢性合并症,对化疗耐受性差,是临床诊疗实践的一大难题。本期分享一例78岁高龄晚期TNBC患者的治疗经历。患者在2020年因左乳浸润性导管癌行改良根治术,术后病理提示 ER (-)、PR (-)、HER2 (2+)(FISH 检测阴性),Ki-67 (+,60%),术后接受FAC方案辅助化疗6周期。2022年8月发现纵膈淋巴结多发转移,一线采用TCb方案及紫杉醇单药化疗,疗效达部分缓解(PR)后改为卡培他滨维持治疗。2023年5月出现锁骨上淋巴结转移,二线采用口服长春瑞滨联合贝伐珠单抗治疗,至2025年5月共治疗33个周期,疗效评价达完全缓解(CR),目前无进展生存期(PFS)尚未达到,已超过24个月,治疗期间不良反应可控,患者生活质量良好。
特邀嘉宾
病例分享专家
苏州大学附属第二医院
肿瘤内科,乳腺肿瘤MDT成员
中国核学会核应急医学分会理事会理事
江苏省预防医学会放射医学与防护专业委员会委员
2007年毕业于苏大医学院本科工作至今
2015年肿瘤学硕士毕业,发表多篇学术论文
2017年赴法国核安全与防护研究所进修
2018年参加癌痛规范化治疗大赛全国三等奖
2019年乳腺癌内分泌治疗辩论赛晚期组全国亚军
病例点评专家
江南大学附属医院
肿瘤内科副主任
中国抗癌协会第二届CMUP专业委员会委员
江苏省抗癌协会淋巴瘤学组副主任委员
江苏省老年医学学会肿瘤学分会副主任委员
江苏省老年学会健康教育与促进专委会副主任委员
江苏省社会办医疗机构协会甲乳专业委员会副主任委员
江苏省医学会肿瘤化疗与生物治疗分会乳腺肿瘤学组成员
无锡市抗癌协会乳腺癌专业委员会主任委员
病例介绍
患者:女,年龄78岁。
主诉:左乳癌术后2年余,发现淋巴结肿大1周。
现病史:患者因左乳浸润性癌于2020年11月18日在外院行左乳癌改良根治术,术后常规病理(2020-11-25,本院)示:(左乳)浸润性导管癌,Ⅱ级。免疫组化结果:ER(-),PR(-),HER-2(2+),ki-67(+,60%),(左乳)浸润性导管癌,HER-2(2+);HER-2基因FISH检测阴性。术后行FAC方案化疗。2022年8月于外院行PET-CT检查提示纵膈淋巴结多发转移,遂至我科就诊,综合评估病情考虑复发转移,8月15日予行输液港置入,予TCb方案化疗3程,因患者第3程用药后有活动后胸闷,第4-6程调整方案为白蛋白结合型紫杉醇单药100mg d1、d8静脉化疗。复查PET-CT评估病情稳定,2023年2月起行卡培他滨单药口服化疗至今,患者1周前复查彩超提示双侧锁骨上淋巴结增大,淋巴门消失,现为进一步治疗入院。
既往史:既往高血压病数年,服用阿司匹林1粒qd、厄贝沙坦1粒qd,自诉血压控制可;自诉有冠心病病史,自行口服血栓心宁片2粒bid;既往糖尿病数年,自行控制饮食,未服用药物,自诉血糖控制可。
吸烟史:无
肿瘤家族史:无
其他家族性遗传性疾病史:无
体格检查:左侧乳房缺如,左侧胸壁可见一陈旧性手术疤痕,约18cm长。双侧锁骨上皮肤肿胀,可及数个粟粒大小淋巴结,活动度可,质韧,无明显压痛。
手术病理:浸润性导管癌,Ⅱ级,脉管见癌侵犯,未见肯定的神经侵犯,皮肤、乳头、基底切缘均未见癌累及,腋窝淋巴结(12/12)见癌转移。
免疫组化结果:ER(-),PR(-),HER-2(2+),ki-67(+,60%), FISH检测阴性。
入院诊断:乳腺恶性肿瘤术后,浸润性导管癌Ⅱ级,三阴性 rT2N3M1 IV期;淋巴结继发恶性肿瘤;2型糖尿病;高血压;冠心病。
治疗历程
手术及术后辅助治疗
2020年11月18日,行左乳癌改良根治术。术后病理结果:(左乳)浸润性导管癌,Ⅱ级,脉管见癌侵犯,未见肯定的神经侵犯,皮肤、乳头、基底切缘均未见癌累及,腋窝淋巴结(12/12)见癌转移。肿块大小3*2.5*1.5cm。
2021年1月至2021年4月,予 FAC(氟尿嘧啶0.75g,环磷酰胺0.6g,多柔比星40mg)*6辅助治疗。
疗效评价:CR。评价依据:经CT评估全身无复发转移。
晚期一线治疗
2022年8月,外院PET提示纵膈淋巴结多发转移。予“紫杉醇(白蛋白结合型)100mg d1、8+卡铂 0.2g d1 q3w”6周期一线治疗。
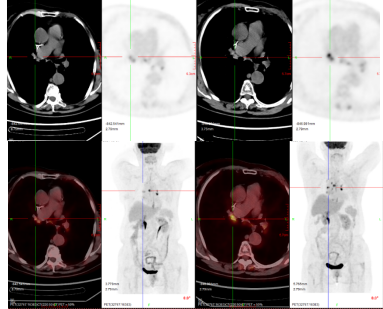
2023年2月,PET/CT检查示纵膈内4、7区及两侧肺门可见稍大淋巴结,较大一处位于右侧肺门,短径约8mm,SUVmax15.47,余全身无明显转移病灶。疗效评估为PR,改为卡培他滨维持治疗。
2023年5月,彩超检查提示:双侧锁骨上见数处低回声,较大一处为:右6×3 mm,左6×3mm,形态规则,呈椭球形,内部回声均匀,部分未见淋巴门回声。余颈部未见明显异常肿大淋巴结回声。
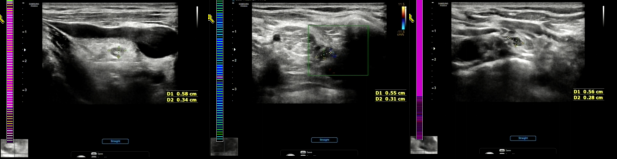
PFS1:9月。
晚期二线治疗
2023年5月,予“长春瑞滨40mg Biw口服化疗+贝伐珠单抗400mg q3w”二线治疗。至2025年5月26日共治疗33个周期。
疗效评价:CR。评价依据:PET-CT(2023-07、2023-10、2024-01全身增强CT均未见肿瘤病灶,定期行PET-CT评估)。治疗期间患者肿瘤指标正常,未出现骨髓抑制及肾功能损害,营养状况良好,耐受性好,轻度肝功能不全,保肝治疗后可控制。
PFS2:24月。
专家点评
随着人口老龄化的加剧,老年乳腺癌的发病率逐年攀升。高龄是晚期癌症相关死亡(诊断后1个月内)的独立风险因素,这使得老年TNBC患者的临床诊疗面临多重挑战:一方面,其肿瘤对靶向治疗敏感性较低,化疗仍是当前主要的系统治疗方案,但此类患者对化疗耐受性较差[4-6],疗效往往受限;另一方面,因常伴随多种基础疾病、身体耐受性不佳,这类患者难以完全参照常规指南治疗,易出现治疗过度或不足。因此,如何更好地平衡药物疗效和安全性,实现生存获益最大化,是当前老年TNBC患者亟待满足的核心治疗需求。本例TNBC患者已是78岁高龄,且伴有多种合并症,一般情况较差,其晚期治疗更需综合肿瘤与老年问题及身体耐受性,选择合适的化疗方案并调整剂量强度,从而使患者获益最大化。
长春瑞滨作为一种长春花碱类抗肿瘤药物,可通过抑制微管蛋白来阻止肿瘤细胞的有丝分裂并使其走向凋亡。其具有广谱抗肿瘤活性,且药代动力学不受饮食、年龄、人种等因素的影响,不会引起体内药物蓄积,且毒性较低[7]。而抗血管生成药物(如贝伐珠单抗)主要靶向VEGF/VEGFR通路,可通过抑制新生血管形成并促进肿瘤血管正常化,有利于其联合的化疗药物到达肿瘤部位发挥作用[8]。两者联合的有效性已得到临床研究数据支持,其中一项回顾性研究[9]显示,在接受长春瑞滨联合铂类方案治疗基础上加入贝伐珠单抗,可使HER2-晚期乳腺癌患者的中位PFS从2.3个月提升至4.1个月,客观缓解率(ORR)和疾病控制率(DCR)分别从11.1%和27.7%提高到25%和83.3%。
除疗效与安全性外,生活质量是晚期肿瘤患者化疗时的另一关键考量。长春瑞滨作为临床常用化疗药物,其静脉与口服两种剂型在疗效与安全性上已被证实具有一致性[10],而口服软胶囊剂型凭借独特优势,为提升患者生活质量带来了显著价值——它不仅减少了静脉穿刺的痛苦与反复就医的奔波,更便于患者自主管理治疗,保证正常的生活节奏,维持治疗的连续性。同时,多项研究显示长春瑞滨口服剂型的3-4级治疗相关不良反应发生率低,周围神经病变、脱发罕见,手足综合症发生率极低[11-13],这为既往蒽环类和紫杉类治疗失败的患者提供了兼具疗效与生活质量的新选择。
本例患者在二线治疗中选用口服长春瑞滨+贝伐珠单抗方案,不仅实现了长达2年余的PFS,且在治疗期间肿瘤指标正常,未出现骨髓抑制及肾功能损害,仅出现轻度肝功能不全,且在保肝治疗后即得到控制,不良反应整体可控,生活质量维持在较高水平。
[1] Hwang SY, Park S, Kwon Y. Recent therapeutic trends and promising targets in triple negative breast cancer. Pharmacol Ther. 2019 Jul;199:30-57.
[2] Bauer KR, Brown M, Cress RD, et al. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype: a population-based study from the California cancer Registry. Cancer. 2007 May 1;109(9):1721-8.
[3] Shachar SS, Jolly TA, Jones E, et al. Management of Triple-Negative Breast Cancer in Older Patients: How Is It Different? Oncology (Williston Park). 2018 Feb 15;32(2):58-63.
[4] Giordano SH, Duan Z, Kuo YF, et al. Use and outcomes of adjuvant chemotherapy in older women with breast cancer. J Clin Oncol. 2006 Jun 20;24(18):2750-6.
[5] Yancik R, Wesley MN, Ries LA, et al. Effect of age and comorbidity in postmenopausal breast cancer patients aged 55 years and older. JAMA. 2001 Feb 21;285(7):885-92.
[6] Aapro M, Wildiers H. Triple-negative breast cancer in the older population. Ann Oncol. 2012 Aug;23 Suppl 6:vi52-5.
[7] 王亚秋,王留兴,樊青霞,等.长春瑞滨为主的联合方案治疗晚期乳腺癌临床疗效观察[J].实用肿瘤杂志,2010,25(03):337-341.
[8] Sui X, et al. Immune Checkpoint inhibitors in Triple-negative Breast. CancerNat Cell Sci 2023 Dec;1(2):73–79.
[9] Ho IW, Tseng YR, Liu CY, et al. Addition of Bevacizumab to Vinorelbine-Platinum combination is efficacious in Heavily Pretreated HER2-Negative Metastatic Breast Cancer. J Cancer. 2025 Feb 11;16(5):1726-1735.
[10] Jassem J, Ramlau R, Karnicka-Mtodkowska H, et al. A multicenter randomized phase ll study of oral vs. intravenous vinorelbine in advanced non-small-cell lung cancer patients. Ann Oncol.2001;12(10):1375-1381.
[11] Aapro M, et al. Randomized phase II study evaluating weekly oral vinorelbine versus weekly paclitaxel in estrogen receptor-positive, HER2-negative patients with advanced breast cancer (NorBreast-231 trial)[J]. Breast. 2019;45:7-14.
[12] Briasoulis E, Aravantinos G, Kouvatseas G,et al.Dose selection trial of metronomic oral vinorelbine monotherapy in patients with metastatic cancer: a hellenic cooperative oncology group clinical translational study[J].Bmc Cancer, 2013, 13(1):263-263.
[13] Campone M, Dobrovolskaya N, Tjulandin S,et al.A three-arm randomized phase II study of oral vinorelbine plus capecitabine versus oral vinorelbine and capecitabine in sequence versus docetaxel plus capecitabine in patients with metastatic breast cancer previously treated with anthracyclines.[J].Breast Journal, 2013, 19:240-249.
排版编辑:肿瘤资讯-老猫











 苏公网安备32059002004080号
苏公网安备32059002004080号


