近日,南京鼓楼医院杜娟教授和刘宝瑞教授担任通讯作者在Frontiers in Immunology(2022年IF=7.3)在线发表“Efficacy and safety of second-line therapy by S-1 combined with sintilimab and anlotinib in pancreatic cancer patients with liver metastasis: a single-arm, phase II clinical trial”研究论文,研究结果显示安罗替尼联合信迪利单抗和替吉奥二线治疗胰腺癌肝转移患者,客观缓解率(ORR)为10.5%,中位无进展生存期(mPFS)为3.53个月,中位总生存期(mOS)为8.53个月;3级治疗相关不良事件(TRAEs)的发生率为26.1%,无4级及以上TRAEs发生。安罗替尼联合信迪利单抗和替吉奥二线治疗胰腺癌肝转移患者显示出较好的疗效和安全性,为临床实践提供了新的选择。

研究背景
胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)是最严重的消化道恶性肿瘤之一,平均5年生存率不到9%[1, 2]。目前,晚期胰腺癌二线治疗方案非常有限,NAPOLI-1的III期研究结果表明,联合化疗组( nal-IRI+5-FU/LV)在晚期胰腺癌患者的二线治疗中显示出较好的疗效[3],但3/4级不良反应发生率较高,二线治疗的晚期胰腺癌患者身体状况差,可能无法耐受联合化疗方案;既往研究显示,替吉奥单药治疗吉西他滨难治性转移性胰腺癌显示出一定疗效, ORR为15%, mOS为4.5个月,不良反应可耐受[4]。
抗血管生成药物的抗肿瘤作用在多种实体肿瘤的治疗中取得了较好的疗效。然而,在胰腺癌一线治疗中化疗联合抗血管生成药物对比单独化疗未改善患者的OS[5, 6],这可能与胰腺癌严重的免疫抑制型肿瘤微环境相关[7, 8]。已有研究表明,抗血管生成药物和免疫治疗相结合的策略有可能在原发性肝癌的治疗中重塑肿瘤微环境,提高治疗反应[9, 10]。而且,化疗联合抗血管生成药物和免疫治疗在多种癌症中取得了显著的效果[2, 11, 12]。因此这种联合治疗方案可能为胰腺癌肝转移患者带来新的希望。
综上所述,本研究旨在探索安罗替尼联合信迪利单抗和替吉奥二线治疗胰腺癌伴肝转移患者的有效性和安全性,为转移性胰腺癌患者二线治疗寻求一种有效且可耐受的方法。
研究方法
这是一项前瞻性研究,纳入标准如下:(1)组织学或细胞学确诊为胰腺癌伴肝转移且有可测量病灶;(2)ECOG体能状态评分(PS)≤2分;(3)接受至少2个周期的联合治疗并有基线后计算机断层扫描;(4)充分的骨髓功能、肝功能和肾功能。排除标准如下:既往或并发其他恶性肿瘤和/或对研究药物过敏;80岁以上或伴随任何重度疾病的患者包括自身免疫性疾病。患者筛选的流程图见图1A。
入组研究的所有患者均接受安罗替尼联合信迪利单抗和替吉奥治疗。安罗替尼(12 mg,po,qd,d1~14,q3w),替吉奥(25 mg/m2 ,po,bid,d1~14,q3w ),信迪利单抗(200 mg,IV,d1,q3w)。每21天为一个治疗周期,直至疾病进展。每3个周期通过CT或MRI进行疗效评估。研究的给药方案见图1B。
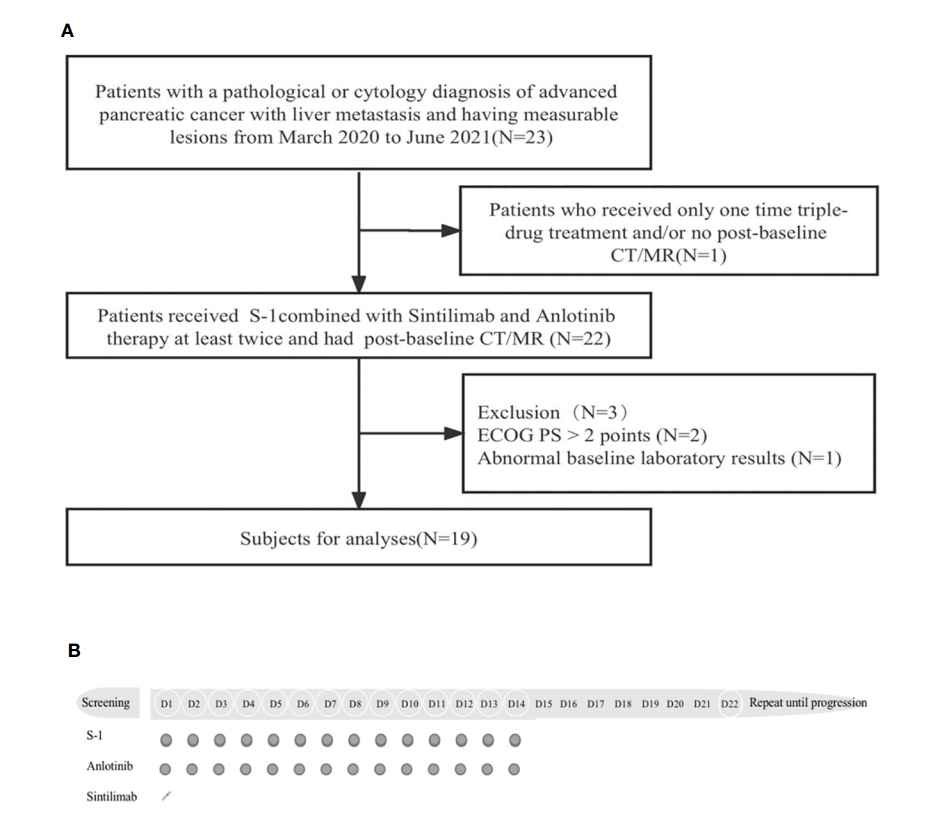
图1A. 患者筛选流程图;1B. 给药方案
研究结果
从2020年3月至2021年6月,本研究在南京鼓楼医院综合肿瘤中心共入组了23例患者,其中4例患者被排除(1例未接受基线后计算机断层扫描;2例ECOG PS > 2分,1例基线实验室检查结果异常),其余19例疗效可评估。所有可评估患者的ECOG体能状态为1-2分,均接受过白蛋白结合型紫杉醇和吉西他滨一线化疗方案。4例(17.4%)既往接受过胰腺放疗。所有患者均有肝转移,其中5例(21.7%)有两个以上器官转移,肺转移和腹膜转移最常见。
在疗效评估方面, 19例患者接受了2个周期以上的治疗,并且疗效可评估。在可评估人群中,按照RECIST v1.1评估标准,有2例(10.5%)确认部分缓解(PR),8例(42.1%)确认疾病稳定(SD),没有患者达到完全缓解(CR)。ORR为10.5%(95%CI: 0.4%–25.7%),DCR为52.6% (95% CI: 27.9%–77.4%)(图2 A, B)。中位PFS和OS分别为3.53个月(95%CI: 2.50-7.50)和8.53个月 (95%CI: 4.97-14.20)(图2 C, D)。
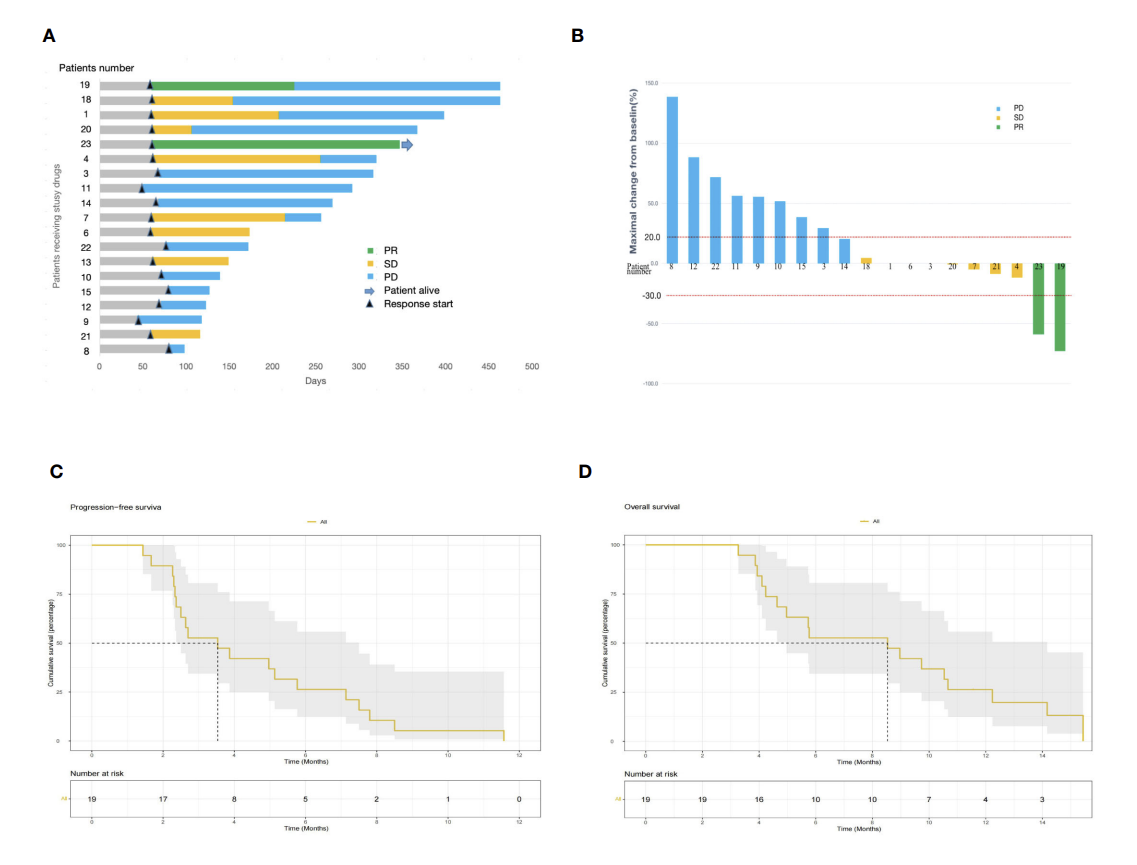
图2 A. 可评价患者泳图;B. 最佳疗效瀑布图;C. PFS生存曲线;D. OS生存曲线
在安全性方面,研究中大多数不良事件为1-2级。最常见的血液学毒性包括白细胞减少(47.8%)和血小板减少(47.8%)。最常见的非血液学毒性为疲乏(30.0%)和恶心/呕吐(21.7%)。最常见的免疫治疗相关不良事件为甲状腺功能减退(13.0%)和甲状腺功能亢进(13.0%)。26.1%的患者发生3级不良事件,未观察到4级或4级以上不良事件或治疗相关死亡(表1)。
表1. 本研究中的不良事件
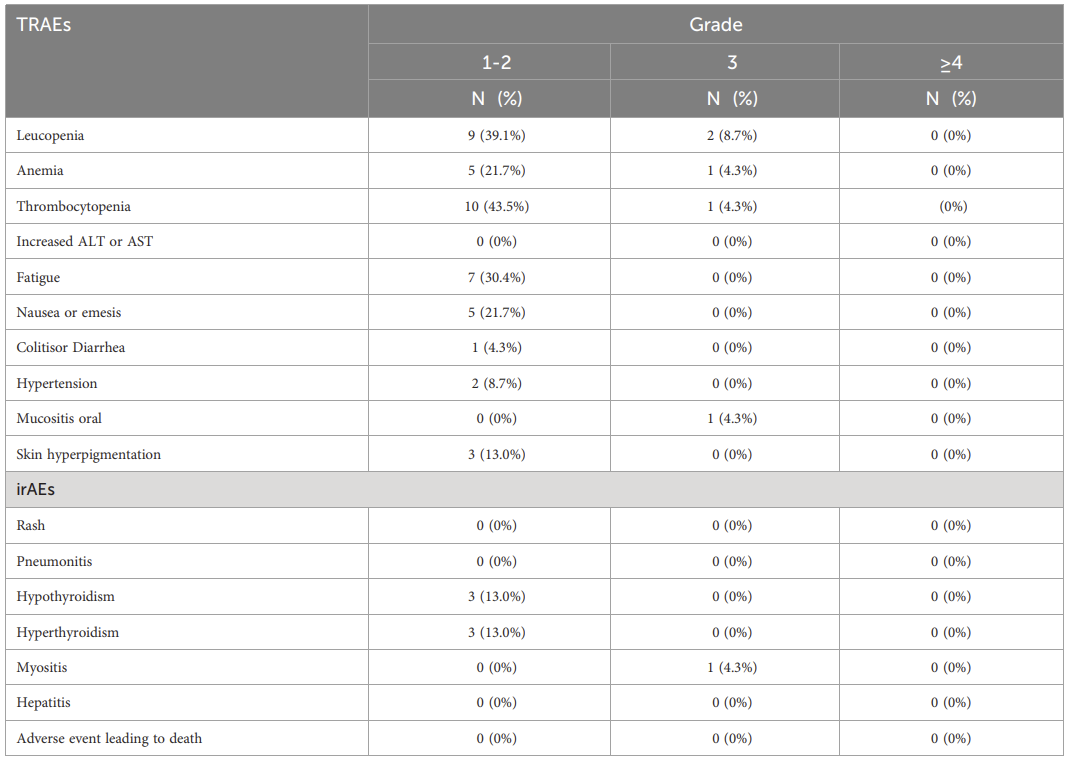
TRAE,治疗相关不良事件;irAE,免疫相关不良事件;ALT,丙氨酸氨基转移酶;AST,天冬氨酸氨基转移酶。
亚组分析发现,接受安罗替尼联合信迪利单抗和替吉奥作为胰腺癌二线治疗的女性患者mOS为9.35个月,而男性患者为4.63个月,但P 值无显著性差异 (图3B)。年龄小于60岁的患者的mPFS比年龄大于60岁的患者差(mPFS 2.43 vs. 4.97个月,P < 0.05) (图3 C)。此外,ECOG PS评分并不能预测生存获益(图3E, F)。
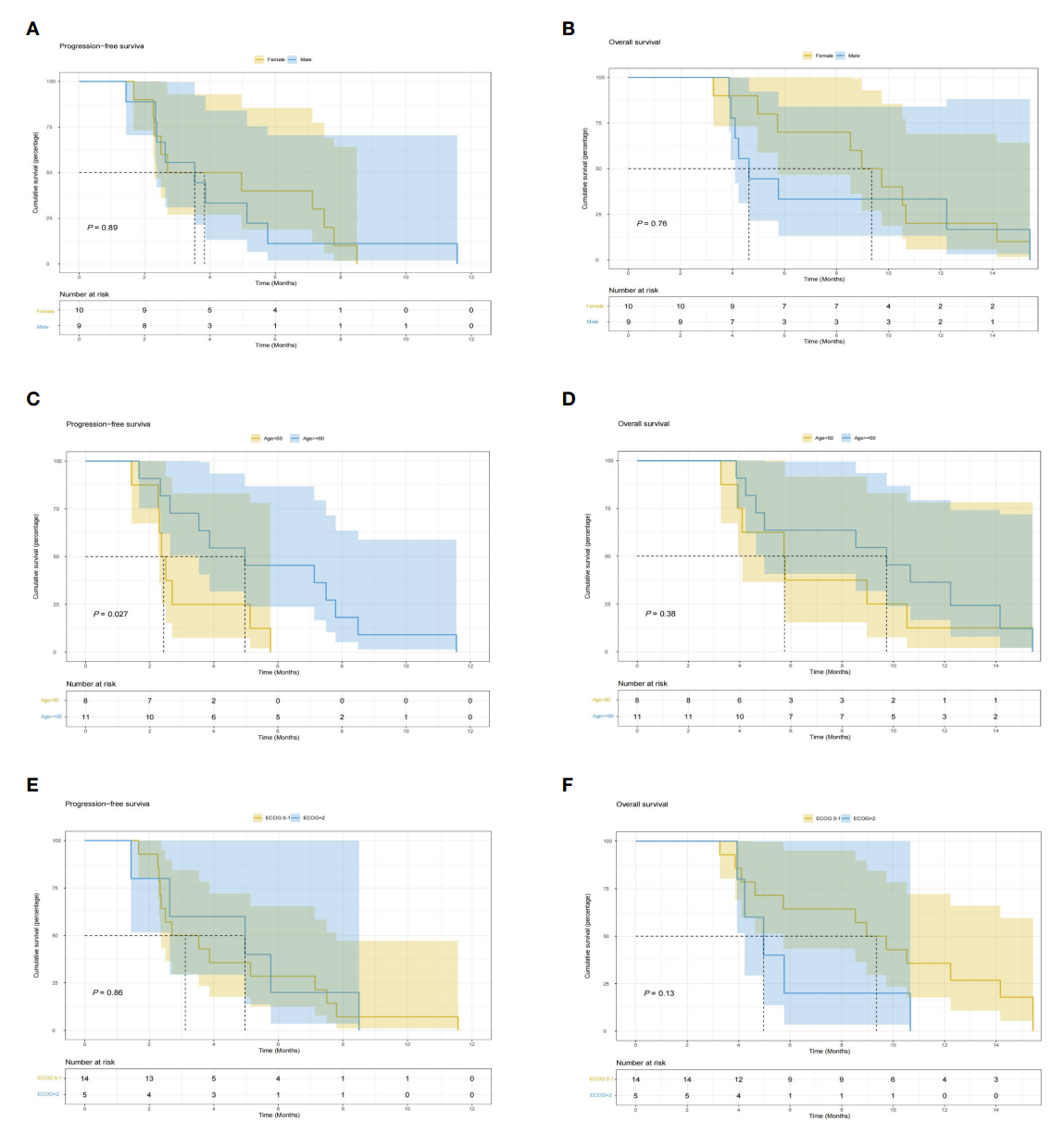
图3. KM生存曲线 A和B为以性别为分组的PFS和OS生存曲线;C和D为以年龄为分组的PFS和OS生存曲线;E和F为以ECOG PS评分为分组的PFS和OS生存曲线
对16例患者的肿瘤标本行高通量基因组测序,6例评价为高同源重组缺陷(HRD-H),10例评价为低同源重组缺陷(HRD-L)。结果显示,HRD-H患者的PFS短于HRD-L患者(2.43个月vs. 5.45个月;P = 0.043)。HRD-H患者的OS有短于HRD-L患者的趋势,但未达到显著差异(4.43个月vs.9.35个月;P = 0.11) (图4A,B)。
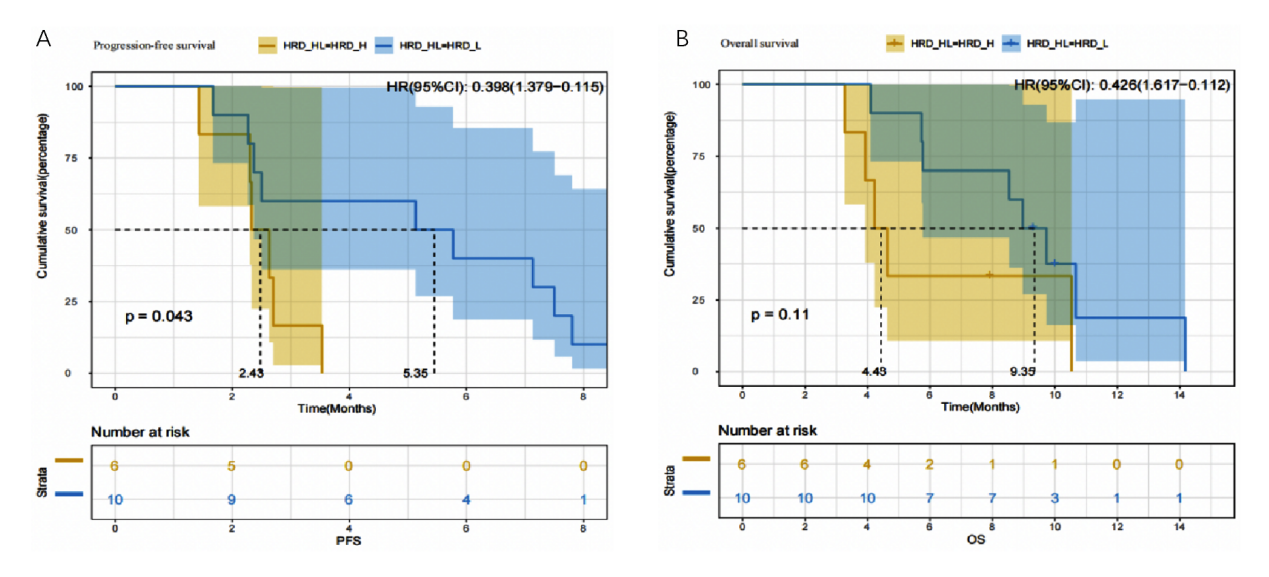
图4. 以HRD高低为分组的生存曲线A. PFS;B. OS
研究结论
胰腺癌是一种预后较差的恶性消化道肿瘤。目前,晚期胰腺癌标准二线治疗选择非常有限。本研究显示,安罗替尼联合信迪利单抗和替吉奥二线治疗胰腺癌肝转移患者的ORR为10.5%,DCR为52.6%,中位PFS和OS分别为3.53个月和8.53个月,3级TRAEs发生率为26.1%,无4级及以上TRAE的发生,安全性良好,为胰腺癌肝转移患者的二线治疗提供了新的思路。
1. Siegel, R.L., et al., Cancer statistics, 2022. CA: A Cancer Journal for Clinicians, 2022. 72(1): p. 7-33.https://doi.org/10.3322/caac.21708
2. Jing, C., et al., Camrelizumab combined with apatinib and S-1 as second-line treatment for patients with advanced gastric or gastroesophageal junction adenocarcinoma: a phase 2, single-arm, prospective study. Cancer Immunology, Immunotherapy, 2022. 71(11): p. 2597-2608.https://doi.org/10.1007/s00262-022-03174-9
3. Wang-Gillam, A., et al., Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial. The Lancet, 2016. 387(10018): p. 545-557.https://doi.org/10.1016/s0140-6736(15)00986-1
4. Morizane, C., et al., A phase II study of S-1 in gemcitabine-refractory metastatic pancreatic cancer. Cancer Chemotherapy and Pharmacology, 2008. 63(2): p. 313-319.https://doi.org/10.1007/s00280-008-0741-7
5. Martin, L.K., et al., VEGF remains an interesting target in advanced pancreas cancer (APCA): results of a multi-institutional phase II study of bevacizumab, gemcitabine, and infusional 5-fluorouracil in patients with APCA. Annals of Oncology, 2012. 23(11): p. 2812-2820.https://doi.org/10.1093/annonc/mds134
6. Kindler, H.L., et al., Axitinib plus gemcitabine versus placebo plus gemcitabine in patients with advanced pancreatic adenocarcinoma: a double-blind randomised phase 3 study. The Lancet Oncology, 2011. 12(3): p. 256-262.https://doi.org/10.1016/s1470-2045(11)70004-3
7. Bear, A.S., R.H. Vonderheide, and M.H. O'Hara, Challenges and Opportunities for Pancreatic Cancer Immunotherapy. Cancer Cell, 2020. 38(6): p. 788-802.https://doi.org/10.1016/j.ccell.2020.08.004
8. Hosein, A.N., R.A. Brekken, and A. Maitra, Pancreatic cancer stroma: an update on therapeutic targeting strategies. Nature Reviews Gastroenterology & Hepatology, 2020. 17(8): p. 487-505.https://doi.org/10.1038/s41575-020-0300-1
9. Finn, R.S., et al., Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. New England Journal of Medicine, 2020. 382(20): p. 1894-1905.https://doi.org/10.1056/NEJMoa1915745
10. Yau, T., et al., Nivolumab versus sorafenib in advanced hepatocellular carcinoma (CheckMate 459): a randomised, multicentre, open-label, phase 3 trial. The Lancet Oncology, 2022. 23(1): p. 77-90.https://doi.org/10.1016/s1470-2045(21)00604-5
11. Liu, J., et al., Multicenter phase II trial of Camrelizumab combined with Apatinib and Eribulin in heavily pretreated patients with advanced triple-negative breast cancer. Nature Communications, 2022. 13(1).https://doi.org/10.1038/s41467-022-30569-0
12. Zhang, B., et al., Phase II clinical trial using camrelizumab combined with apatinib and chemotherapy as the first‐line treatment of advanced esophageal squamous cell carcinoma. Cancer Communications, 2020. 40(12): p. 711-720.https://doi.org/10.1002/cac2.12119











 苏公网安备32059002004080号
苏公网安备32059002004080号


