在转移性前列腺癌的治疗领域,新型雄激素受体(AR)抑制剂达罗他胺灵活联合治疗方案革新了前列腺癌治疗格局,核素联合治疗策略引领了前列腺癌治疗新方向;而随着免疫治疗在肿瘤领域的出色表现,以免疫检查点抑制剂(ICI)为基础的单药或联合策略亦为前列腺癌的治疗带来了新的曙光。
我国前列腺癌患者就诊时机普遍偏晚,初诊时多数患者已处于中晚期,疾病负担较重,5年生存率低,因此临床迫切需要更有效的治疗方案来改善患者的预后。为解决前列腺癌人群未被满足的临床需求,本期特邀西安交通大学第一附属医院泌尿外科梁亮教授,谢宏俊教授,陕西省人民医院泌尿外科董青川教授等汇总近年来前列腺癌领域的前沿进展,期望能够为临床实践提供指导。
ARANOTE研究公布重磅结果,拓宽受益人群,丰富前列腺癌治疗选择
既往ARASENS研究结果已经证实,达罗他胺联合雄激素剥夺疗法(ADT)和多西他赛能够显著提高转移性激素敏感性前列腺癌(mHSPC)患者的整体生存率;但在临床实践中,部分mHSPC患者因为各种原因无法接受多西他赛化疗。全球多中心、随机、双盲、安慰剂对照的Ⅲ期临床试验ARANOTE研究结果的公布,为mHSPC患者提供了一种高效且耐受性优良的治疗方案,进一步丰富了前列腺癌的个体化治疗策略。
ARANOTE研究评估了达罗他胺联合雄激素剥夺疗法(ADT)“二联”疗法在mHSPC治疗中的有效性及安全性。该研究共入组了来自15个国家和地区的669名受试者,中国大陆共纳入90例患者。这些受试者按照2:1的比例随机分配至达罗他胺治疗组与安慰剂对照组。
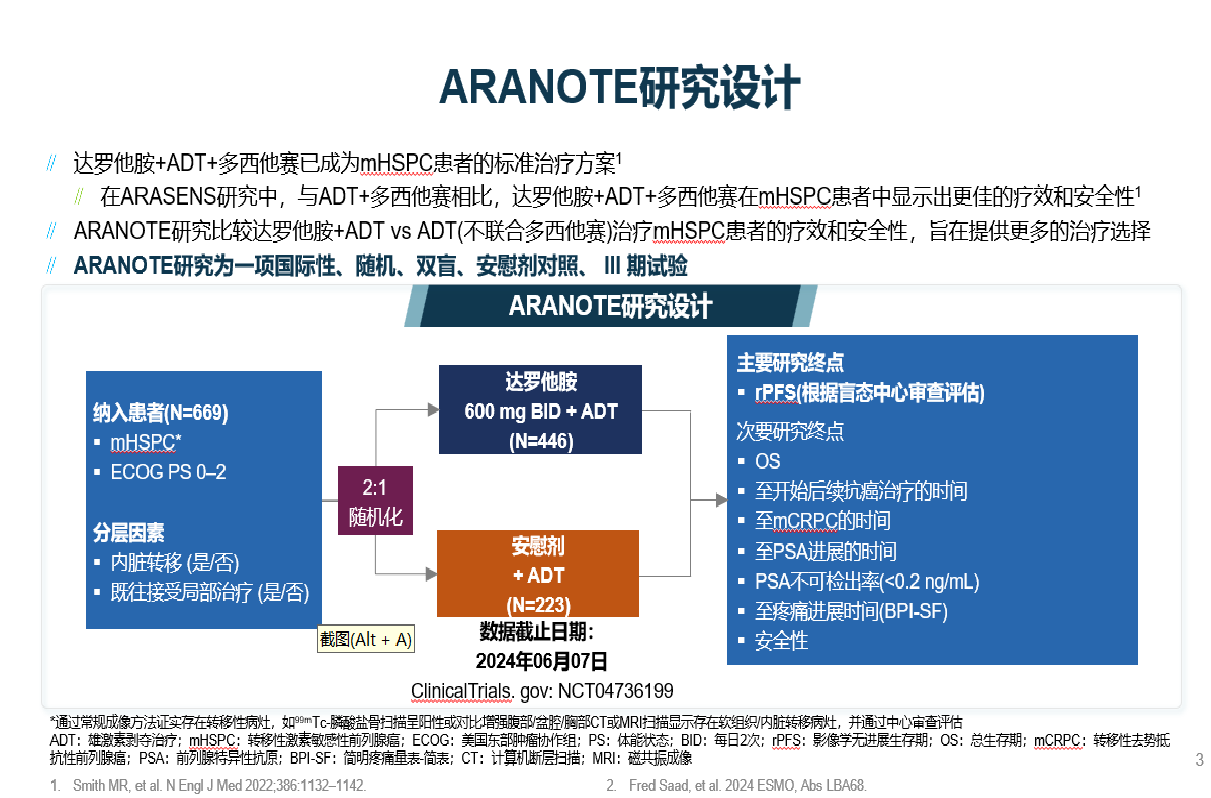
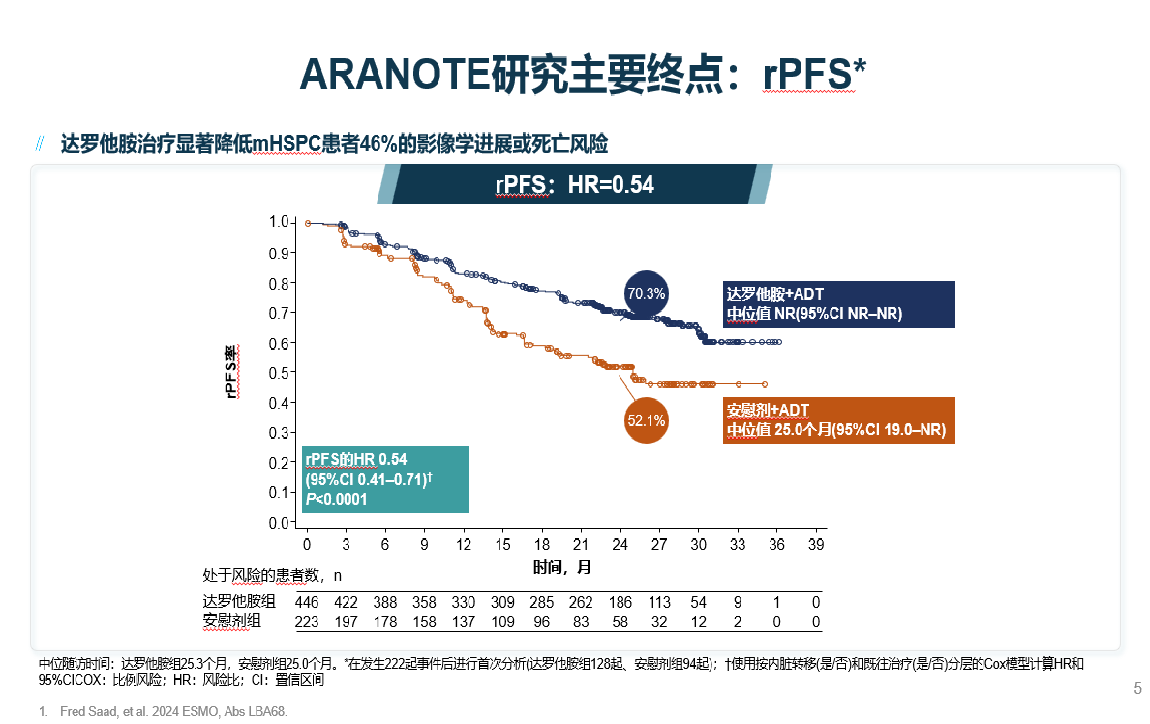
结果显示[1],与安慰剂组相比,达罗他胺组在放射影像学无进展生存期(rPFS)方面取得了显著提升,降低了46%的影像学进展或死亡风险(HR=0.54; 95%CI为0.41-0.71; P<0.0001)。在所有预先设定的亚组中都观察到一致的rPFS获益,无论是高/低瘤负荷的mHSPC患者。此外,与安慰剂+ADT相比,达罗他胺“二联”疗法可延迟进展至mCRPC和至疼痛进展的时间。治疗期间,达罗他胺组更多患者达到前列腺特异性抗原(PSA)<0.2 ng/mL,且延迟至PSA进展时间,这对于控制疾病的恶化和延长患者生命至关重要。
在安全性方面,达罗他胺组与对照组的治疗相关不良事件(TEAEs)发生率相似,且达罗他胺组疲乏与皮疹发生率更低,因TEAEs而中断治疗的比例也相对较低(6.1%对9.0%)。鉴于ARASENS研究的优异结果,达罗他胺+ADT“二联“疗法将成为mHSPC患者新的标准治疗。这为临床医生为患者制定个性化治疗方案提供了更大的灵活性,延长患者PFS,同时将治疗负担最小化。
PEACE-3突破性成果发布,全面开启镭-223联合治疗mCRPC新时代
目前晚期转移性前列腺癌患者的一线治疗方案仍然为内分泌治疗,但经过中位时间为18-24个月的内分泌治疗,绝大多数患者将不可避免地进展为转移性去势抵抗性前列腺癌(mCRPC),预后较差。然而,在PEACE-3研究出现以前,临床尚无任何联合疗法可以被证明能在一线mCRPC患者的治疗中显著增加生存时长。
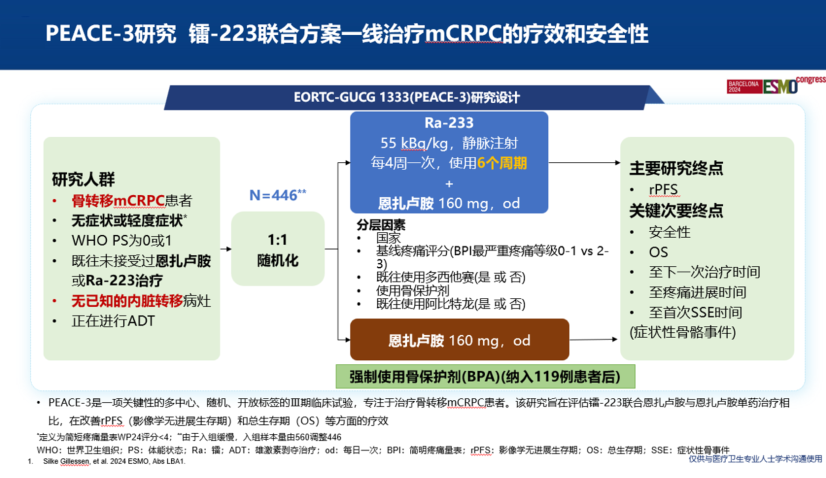
多中心、随机、双盲、安慰剂对照的III期临床研究PEACE-3,旨在探究镭-223联合恩扎卢胺(联合治疗组)与恩扎卢胺(对照组)一线治疗mCRPC患者的疗效和安全性。研究纳入了446例mCRPC和骨转移男性患者,分别接受镭-223联合恩扎卢胺治疗或恩扎卢胺单药治疗。
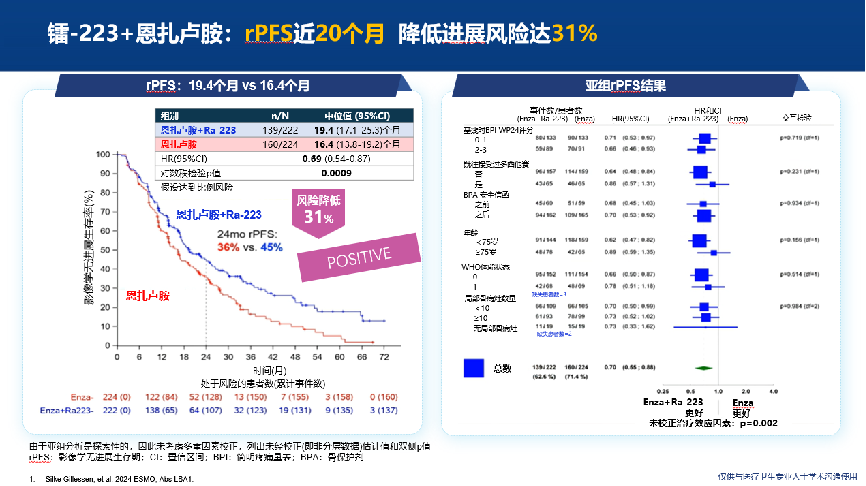
结果显示[2],截至数据分析时,中位随访42.2个月。联合组88%患者接受6周期镭-223治疗。联合治疗组的中位rPFS达到19.4个月,相比之下,对照组仅为16.4个月,联合治疗方案显著降低了31%的疾病进展风险(HR=0.69;95%CI为0.54-0.87,P=0.0009)。 各亚组分析均显示出显著的rPFS获益,与整体人群获益一致。在达到80%总生存期(OS)事件时的期中分析中,联合治疗组一线治疗的中位OS达到了42.3个月(对照组35.0个月,HR 0.69;95% CI:0.52-0.90,p=0.0031),达到显著统计学差异。
24个月时至下一次全身治疗的时间(TTNT)的对比分析显示,联合治疗组与对照组的TTNT比例分别为51% vs. 30%(HR 0.57;95% CI:0.44-0.75,p<0.0001)。在安全性方面,联合治疗组和对照组≥3级药物相关不良事件发生率分别为28%和19%,无一例患者因药物相关不良反应导致死亡。
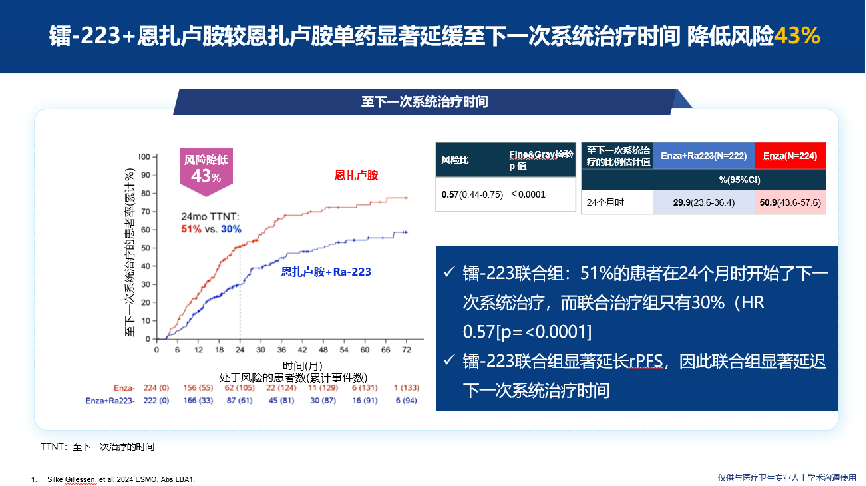 PEACE-3研究不仅为前列腺癌治疗领域带来了突破性进展,更在临床实践中树立了新的治疗标杆。未来,镭-223与恩扎卢胺联合方案亦或可纳入中国临床肿瘤学会(CSCO)指南的I级推荐,并作为mCRPC一线治疗的标准方案。同时,该研究成果也提示,核素治疗在提高患者生活质量方面具有不可忽视的作用,未来在前列腺癌领域的应用前景较为广阔。
PEACE-3研究不仅为前列腺癌治疗领域带来了突破性进展,更在临床实践中树立了新的治疗标杆。未来,镭-223与恩扎卢胺联合方案亦或可纳入中国临床肿瘤学会(CSCO)指南的I级推荐,并作为mCRPC一线治疗的标准方案。同时,该研究成果也提示,核素治疗在提高患者生活质量方面具有不可忽视的作用,未来在前列腺癌领域的应用前景较为广阔。
前景可期,免疫联合治疗或将突破晚期前列腺癌治疗困境
由于患者进入mCRPC阶段时,可供选择的治疗方案较少,中位生存期不足3年。因此,在多种晚期实体瘤系统治疗中大显身手的免疫治疗被寄予厚望。研究显示[3],免疫检查点抑制剂(ICI)治疗mCRPC整体有效率较低,初期ICI单药治疗未达到显著改善mCRPC患者OS的目标,mCRPC中尤其是内脏转移的患者,在内分泌治疗期间疾病进展其预后较差且治疗选择有限。目前,此类患者亟需具有新型作用机制的治疗选择。卡博替尼多靶点酪氨酸激酶抑制剂(TKI),可以改善肿瘤微环境,提高免疫检查点抑制剂(如阿替利珠单抗)的作用,从而提供更好的治疗效果。随机、对照、III期CONTACT-02研究评估了卡博替尼联合阿替利珠单抗与第二次NHT在首次内分泌治疗进展后具有可测量的骨盆外软组织转移病灶(内脏或淋巴结)的mCRPC 患者中的疗效和安全性。该研究入组患者按1:1比例随机分为C+A组(卡博替尼+阿替利珠单抗)和NHT组(阿比特龙+泼尼松或恩扎鲁胺)。并按是否存在肝转移、既往在转移性激素敏感性前列腺癌(mCSPC)阶段是否接受过多西他赛治疗、既往在mCSPC/M0CRPC/mCRPC阶段接受内分泌治疗治疗进行分层。
结果显示[8],在意向治疗(ITT)人群中,C+A组和NHT组的中位PFS分别为6.3个月和4.2个月,降低了35%的影像学进展或死亡风险(HR=0.65; 95%CI为0.50-0.84; P=0.0007)。在伴肝转移和伴骨转移亚组患者中,C+A组和NHT组的中位PFS分别为6.2个月 vs. 2.1个月、6.3个月vs. 4.1个月。在中位随访时间24.0个月时,C+A组的中位OS虽然有优势 (HR 0.89),但未达到统计学意义。在某些亚组(如肝转移、骨转移)中观察到了生存优势,如肝转移患者中两组的中位OS为12.2个月 vs. 7.1个月 (HR 0.68);伴骨转移患者中两组的中位OS为13.8个月 vs. 11.6个月 (HR 0.79)。
在安全性方面,C+A组的耐受性与其他获批的TKI/ICI组合在晚期癌症受试者中的表现相似。而且,与耐受良好的NHT相比,C+A组导致生活质量(QoL)出现中位至具有临床意义恶化的时间相似,C+A组组至开始化疗和至至症状性骨骼事件(SSE)的时间更长。综上,C+A是一种具有新型作用机制的治疗选择,可能对NHT后进展的特定mCRPC患者有效。
总体而言,从ARANOTE、PEACE-3到免疫治疗相关研究的探索,不断推动着晚期前列腺癌治疗手段的进步。随着更多研究数据的进一步公布和应用,相信前列腺癌的治疗将步入一个更加精准化、个体化的新时代,激发前列腺癌治疗领域新一轮的探索与创新热潮,为更多患者带来生命的希望与曙光。
1. Efficacy and safety of darolutamide plus androgen-deprivation therapy (ADT) in patients with metastatic hormone-sensitive prostate cancer (mHSPC) from the phase 3 ARANOTE trial2.ESMO 2024.LBA68.
2. Conteduca V, Briahi N, Gurioli G, et al. Open-label, multicentre randomised trial of Radium223-docetaxelversus docetaxel-Radium223 sequence in Metastatic CastrationResistant Prostate Cancer (RAPSON study) with prospectivebiomarker evaluation. 2024 ESMO, LBA71.
3. 胡志全, 郭淳浩, 杨春光. 免疫检查点抑制剂治疗转移性去势抵抗性前列腺癌研究进展[J]. 临床泌尿外科杂志. 2022,37(10):729-733.
4. Graff JN, Antonarakis ES, Hoimes CJ, et al. Pembrolizumab(pembro) plus enzalutamide(enza) for enza-resistant metastatic castration-resistant prostate cancer(mCRPC):KEYNOTE-199 cohorts 4-5[J]. J Clin Oncol, 2020,38(6_suppl):15-15.
5. Fong A, Durkin A, Lee H. The Potential of Combining Tubulin-Targeting Anticancer Therapeutics and Immune Therapy[J]. Int J Mol Sci, 2019,20(3):586.
6. Galluzzi L ,Buqué A, Kepp O, et al. Immunological Effects of Conventional Chemotherapy and Targeted Anticancer Agents[J]. Cancer Cell, 2015,28(6):690-714.
7. Pachynski RK, Retz M, Goh JC, et al. CheckMate9KD cohort A1 final analysis: Nivolumab(NIVO)+rucaparib for post-chemotherapy(CT) metastatic castration-resistant prostate cancer(mCRPC)[J]. J Clin Oncol, 2021,39(15_suppl):5044-5044.8. Neeraj Agarwal, et al. Cabozantinib (C) Plus Atezolizumab (A) Versus 2nd Novel Hormonal Therapy (NHT) in Patients (Pts) with Metastatic Castration-Resistant Prostate Cancer (mCRPC): Final Overall Survival (OS) Results of the Phase 3, Randomized, CONTACT-02 Study. 2024 ESMOLBA67.
9. Vitkin N, Nersesian S, Siemens DR, et al. The Tumor Immune Contexture of Prostate Cancer[J]. Front Immunol, 2019,10:603.
10. Nombela P,Lozano R, Aytes A, et al.BRCA2 and
Other DDR Genes in Prostate Cancer[J]. Cancers(Basel), 2019,11(3):352.
11. Lozano R, Castro E, Aragón IM, et al. Genetic aberrations in DNA repair pathways: a cornerstone of precision oncology in prostate cancer[J]. BrJ Cancer, 2021,124(3):552-563.
12. Antonarakis ES, Piulats JM, Gross-Goupil M, et al. Pembrolizumab for Treatment-Refractory Metastatic Castration-Resistant Prostate Cancer: Multicohort, Open-Label Phase Ⅱ KEYNOTE-199 Study[J]. J Clin Oncol, 2020,38(5):395-405.
13. Hansen AR, Massard C, Ott PA, et al. Pembrolizumab for advanced prostate adenocarcinoma: findings of the KEYNOTE-028 study[J]. Ann Oncol, 2018,29(8):1807-1813.
14. Antonarakis ES, Velho PI, Fu W, et al. CDK12-Altered Prostate Cancer: Clinical Features and Therapeutic Outcomes to Standard Systemic Therapies, Poly(ADP-Ribose) Polymerase Inhibitors, and PD-1 Inhibitors[J]. JCO Precis Oncol, 2020,4:370-381.
排版编辑:肿瘤资讯-Zika











 苏公网安备32059002004080号
苏公网安备32059002004080号


