在优效系统治疗和精准放疗的时代背景下,乳腺癌新辅助治疗(neoadjuvant treatment,NAT)有助于乳房肿瘤降期实现保乳和腋窝降期,使患者豁免腋窝淋巴结清扫(axillary lymph node dissection,ALND)。目前,在临床腋窝淋巴结阳性的患者中,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性和三阴性乳腺癌(triplenegative breast cancer,TNBC)亚型接受NAT后可达到较高的腋窝病理学完全缓解率(axillary nodal pathologic complete response,apCR),有望实现腋窝局部降阶梯处理,相关指南与专家共识推荐初始临床淋巴结阴性(clinical lymph node negative,cN0)的患者NAT后前哨淋巴结(sentinel lymph node,SLN)阴性可行前哨淋巴结活检(sentinel lymph node biopsy,SLNB)替代ALND,NAT后SLN存在较低肿瘤残留负荷的患者可考虑放疗替代ALND。初始临床淋巴结阳性(clinical lymph node positive,cN+)患者NAT后转为ycN0接受常规SLNB的可行性依然受到质疑,主要障碍是NAT后SLNB 的假阴性率较高,不能准确预测腋窝肿瘤细胞残留且不能明确术后腋窝复发转移风险。在联合示踪、SLN检出数目≥3枚、临床腋窝转移肿瘤负荷较低的条件下,SLNB的假阴性率可能会满足临床需求。然而,由于肿瘤细胞阻塞淋巴管,影响蓝染料或放射性核素的引流等原因,NAT后SLNB的质量并不能得到有效的改善。因此,需要实现NAT后SLNB技术的优化。靶向腋窝淋巴结切除术(targeted axillary lymph node dissection,TAD)是对NAT前穿刺证实转移的腋窝淋巴结放置标记夹并在NAT后SLNB时靶向检出的精准外科手术操作技术,可以进一步降低NAT后SLNB的假阴性率、实现NAT后腋窝淋巴结肿瘤残留负荷的准确评估。对于NAT后转阴的乳腺癌患者,TAD有望成为NAT后腋窝降期患者安全、可靠的腋窝分期技术。本文就初始cN+患者NAT后腋窝降阶梯处理及TAD研究进展进行综述。

初始临床淋巴结阴性( clinical nodal negative ,cN0) 乳腺癌患者在新辅助治疗(neoadjuvant treatment,NAT)后常规行前哨淋巴结活检(sentinel lymph node biopsy,SLNB),SLNB结果阴性可避免腋窝淋巴结清扫(axillary lymph node dissection,ALND)及区域放疗,因此推荐NAT后应行SLNB[1]。St. Gallen专家共识(2021年)中,多数专家推荐初始cN0患者NAT后出现1枚前哨淋巴结(sentinel lymph node,SLN)宏转移、微转移或孤立肿瘤细胞者可考虑腋窝放疗替代ALND[2]。初始临床淋巴结非阴性的cN1患者NAT后SLN阴性免除ALND及腋窝区域放疗是否有生存获益仍缺乏足够的肿瘤安全性数据。目前,该领域主要的研究方向为如何降低NAT后SLNB的假阴性率(false negative rate,FNR),以及NAT后SLNB能否指导豁免ALND和区域放疗。对于临床淋巴结分期为cN2及以上患者NAT后SLNB的有效性尚缺乏大样本量的研究。目前,靶向腋窝淋巴结切除术(targeted axillary lymph node dissection,TAD)是降低NAT后SLNB中FNR的有效方法,能够有效地提高淋巴结活检的检出率、准确率及阴性预测值,为患者豁免ALND、指导放疗的降阶梯提供有力的肿瘤安全性保障[3-5]。在全身治疗效果不断提高的前提下,TAD能够有效评估腋窝淋巴结肿瘤残留负荷,推动腋窝的局部区域处理向降阶梯方向发展。本文将对临床淋巴结阳性(CN+)患者NAT后腋窝降阶处理及TAD的研究进展进行综述。
cN+患者NAT后SLNB的可行性
NAT后SLNB的检出率及FNR
NAT后SLNB是乳腺癌患者腋窝淋巴结的微创分期技术,但cN+患者NAT后常规SLNB的检出率低且FNR高,其可行性仍存在争议。NAT后SLNB准确性与SLN检出数目、示踪技术等存在显著相关性。ACOSOG Z1071临床试验[6]前瞻性入组756例cT0-4N1-2M0患者,NAT后SLNB成功率为92.7%,cN1患者检出1枚、2枚、≥3枚SLN的FNR分别为31.5%、21.1%、9.1%;SLNB(双示踪)的FNR较单示踪核素/蓝染显著降低(10.8% vs 20.0%/22.2%,P<0.05)。Simons等[7]的研究结果显示:cN+患者接受NAT降期后SLNB的成功率为89%,FNR为17%(<3枚和≥3枚SLN分别为22%和8%)。SNFNAC临床试验[8]结果显示,检出1枚SLN的FNR为18.2%,检出≥2枚SLN的FNR可降至4.9%。因此,国内外相关指南推荐cN+ NAT后转阴的乳腺癌患者,通过使用双示踪剂、检出≥3枚SLN等技术可有效降低SLNB的FNR。然而,入组ACOSOG Z1071试验57%的患者和入组SENTINA试验34%的患者并未实现成功检出≥3枚SLN以降低FNR的要求。SENTINA试验[9]入组了1 737例cN0-1患者,NAT后转为ycN0的患者SLNB的检出率仅为80.1%,FNR为14.2%。上述前瞻性多中心临床试验结果显示,NAT后常规行SLNB的检出率、FNR仍不能达到理想的目标值。而对于初始腋窝淋巴结分期≥cN2的患者NAT后SLNB的有效性尚缺乏大样本量的研究,建议无论NAT后是否降期,均应接受ALND。与未行NAT的患者相比,NAT后SLNB可能需要远小于10%的假阴性阈值以提高其准确率。TAD技术可增加SLN检出率且降低FNR,为乳腺癌患者实现NAT后有效优化腋窝SLNB提供有力的技术保障。
较高的FNR会导致乳腺癌患者复发转移风险的增加及相关辅助放化疗的不足。因此,为确保NAT后乳腺癌患者较低的腋窝复发率,必须同时提高SLN的检出率,降低SLNB的FNR,及实现NAT后SLNB人群和技术的优化。
NAT后SLNB人群的优化
NAT后乳腺癌患者能否豁免ALND取决于是否达到腋窝病理学完全缓解率(axillary nodal pathologic complete response,apCR)。因乳腺癌各分子分型对NAT敏感性不同,NAT后能否达到ypN0与分子分型显著相关并影响患者的生存获益。Bi等[10]研究发现,cN+患者中人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性患者接受靶向治疗和三阴性乳腺癌(triple-negative breast cancer,TNBC)患者接受NAT后的apCR率分别为58.6%和53.2%,较激素受体阳性、HER2阴性的患者(21.2%)与HER2阳性未接受靶向治疗的患者(28.2%)显著增高(P<0.001)。Shi等[11]进一步分析HER2阳性和TNBC患者的临床病理学特征与apCR的相关性发现,患者NAT前临床淋巴结分期及达到ycN0和乳腺病理学完全缓解(breast pathologic complete response,bpCR)均是达到apCR的独立影响因素,其中cN0-1患者NAT后的ypN0率显著高于cN2-3患者(97.6% vs 62.5%,P<0.001),该部分患者腋窝残留肿瘤负荷较低,可考虑选择性豁免腋窝手术。另外,Barron等[12]的一项回顾性研究同样显示,NAT后实现bpCR的HER2阳性和TNBC的cN0患者前哨淋巴结的转移风险<2%,同样建议该患者人群可考虑豁免腋窝手术。综上所述,鉴于HER2阳性行靶向治疗及TNBC的cN0-1早期乳腺癌患者NAT后有较高的apCR率,并且实现NAT后ycN0、bpCR的cN0-1早期乳腺癌患者前哨淋巴结的转移风险低,这一部分人群可能会更适宜腋窝手术的降阶梯治疗。
Kantor等[13]的预测模型可较准确地预测初始cN+患者NAT后达到ypN0的概率,该模型对比术后肿瘤病理学与术前影像学检查结果的差别评估原发肿瘤反应,理论上可以准确预测NAT后腋窝淋巴结状态,然而无助于术前预测ypN0。郑卫真等[14]分析对比NAT前后肿瘤超声影像学大小差异改良模型,并对比术后切除肿块大小与NAT前肿瘤超声影像学的改变以验证Kantor等[13]的预测模型,结果显示,Kantor等[13]的模型与改良模型的AUC分别为0.788和0.782,差异无统计学意义(P = 0.579)。改良模型具有同等的预测效能,更切合临床实际应用并可在术前进行有效的评估,为乳腺癌NAT后腋窝降阶处理提供重要的参考。但是,我们仍需从技术方面进行优化,从而提升NAT后SLNB的准确率,指导后续治疗的选择。
NAT后SLNB 技术的优化
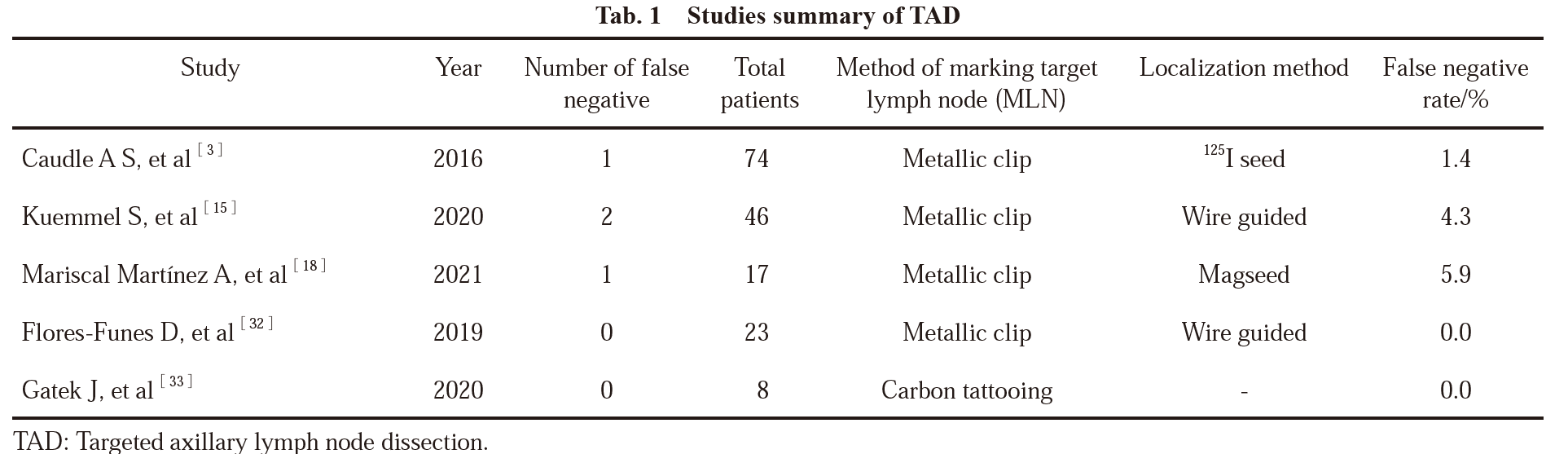
TAD是对NAT前穿刺证实转移且已标记的腋窝淋巴结(marked lymph node,MLN)放置标记夹并在NAT后SLNB时靶向检出的精准外科手术操作技术。目前,TAD技术评估cN+的患者NAT后的腋窝淋巴结状态是可行的,具有较高的MLN活检成功率和较低FNR。Caudle等[3]正式提出TAD的概念,前瞻性入组208例cT0-4M0乳腺癌患者(未限制N分期),利用125I粒子术前定位96例放置标记夹的转移淋巴结,其中85例行ALND,TAD[标记的淋巴结活检(marked lymph node biopsy,MLNB)+SLNB]、MLNB、常规SLNB的FNR分别为2.0%(95% CI:0.1~10.7)、4.2%(95% CI:1.4 ~ 9.5)和10.1%(95% CI:4.2 ~ 19.8)。Kuemmel等[15]研究结果显示,在接受TAD成功的患者中,仅行SLNB的FNR为23.9%(95% CI:12.6~38.8),MLNB的FNR为8.7%(95% CI:2.4~20.8),TAD技术可将FNR降至4.3%(95% CI:0.5~14.8)。Swarnkar等[4]的meta分析显示,TAD可将FNR降至5.16%(95% CI:3.4 ~ 7.5)。因此,TAD技术能够有效地降低NAT后常规SLNB的FNR(表1)。St. Gallen(2021年)专家共识中,90.20%的专家建议cN1接受NAT转化为ycN0的患者行TAD代替腋窝淋巴结清扫[2]。2021年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)指南[16]也建议NAT后ycN0的乳腺癌患者接受TAD进行腋窝分期,但未对接受TAD腋窝分期的SLN检出数目作出明确要求。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)乳腺癌临床实践指南V3版(2022年)建议在双示踪剂、检出≥3枚SLN的基础上,强调标记穿刺证实转移淋巴结并于术中检出的TAD技术可有效地降低NAT后SLNB的FNR(2B类证据)[17]。《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》推荐cT1-3N1、双示踪剂显像、检出≥3枚SLN、NAT前穿刺证实转移的腋淋巴结放置标记夹并于术中检出并且SLN阴性可豁免ALND,仍推荐术后对腋窝Ⅰ/Ⅱ水平辅助放疗;穿刺证实cN1患者NAT后SLN阳性[包括宏转移、微转移及孤立的肿瘤细胞群(isolated tumor cell,ITC)],应行ALND[1]。可见,TAD对于优化cN+患者NAT后的SLNB结果十分关键。
表1 TAD的相关研究汇总
标记淋巴结定位与检出
标记淋巴结的最佳定位方式及定位材料依然存在争议,临床应用的定位方式包括磁性粒子(magnetic seed localization,MSL)[18-19]、雷达反射器[20-21]和射频识别器[22],然而,磁性粒子的应用需在手术区移除与磁性相关的金属仪器,并且要求外科医师使用非磁性聚合物工具[23],雷达反射器和射频识别器的尺寸较大、且系统整体价格较昂贵,以上定位方式均存在临床推广的障碍。为解决上述定位技术的局限性问题,优化TAD技术在临床实践中的应用,Donker等[5]提出在NAT前使用125I粒子定位MLN的TAD技术(marking axillary lymph nodes with radioactive iodine seeds,MARI),100例患者MLNB的检出率和FNR分别为97%和7%。Caudle等[3]利用125I粒子定位阳性淋巴结将NAT后SLNB的FNR降至1.4%。Man等[24]的meta分析结果显示,纳入的11项研究共498例患者术前置入502个125I粒子/标记夹定位转移淋巴结,并准确定位90%(n = 454)的125I粒子/标记夹,TAD术中成功识别、检出88%(n = 442)的125I粒子/标记夹,其中γ探测仪定位、导丝和术中超声定位的检出率分别为94%、84%和95%。Lowes等[22]研究显示,达到ypN0的cN+患者NAT后选择TAD技术进行腋窝分期的比例在2016年上升至58%,TAD技术的应用呈逐年增加趋势。标记夹与125I粒子标记活检阳性淋巴结的TAD技术具有定位准确、操作简易的优势,能较好地应用于临床。
NAT后行SLNB的腋窝处理
SLNB阴性的腋窝处理
目前,cN0患者NAT后SLNB已成为腋窝分期的标准治疗方法;NAT后SLN阴性可避免ALND及区域放疗;NAT后SLN阳性,腋窝淋巴结仍需进一步处理。cN1患者NAT后转为ycN0时,检出≥3枚SLN/标记夹可将FNR降低到10%以内,常规SLNB可代替ALND[8-9,25]。然而,上述试验入组的患者均接受了ALND来明确SLNB的FNR,故cN+患者NAT后SLN阴性豁免腋窝清扫及豁免腋窝区域放疗的生存获益仍缺乏足够的肿瘤安全性数据。以下研究对cN+患者NAT后SLN阴性豁免ALND的总生存期和无病生存期进行了随访评估。
Barrio等[26]的一项单中心前瞻性研究入组610例cT1-3N1M0患者(中位年龄49岁),术中使用双示踪剂、检出≥3枚SLN且达到ypN0则豁免ALND(未对转移淋巴结常规放置标记夹定位),234例检出前哨淋巴结≥3枚且达到ypN0,未给予ALND,其中87.6%(205/234)患者接受了术后辅助放疗,其中70%(164/234)也接受淋巴结区域放疗(包括同侧腋窝Ⅰ、Ⅱ水平、锁骨上下、前三肋内乳区淋巴引流区),中位随访40个月,仅1例(0.4%)拒绝放疗的患者腋窝淋巴结复发转移,205例接受放疗患者的腋窝淋巴结均未复发。可见,cN1患者NAT后行标准的SLNB(检出SLN≥3枚且为阴性)并接受术后辅助放疗,SLN阴性豁免ALND并未影响患者的生存获益。
Kahler-Ribeiro-Fontana等[27]研究回顾性分析688例cT1-3N0-2M0患者,其中cN0亚组患者466例。在cN1-2亚组中,cN1(n = 211)、cN2(n = 11)患者接受完整的NAT后转为ycN0,入组的患者均接受常规SLNB手术,SLN(不限检出数目且未放置标记夹定位)未转移则豁免ALND,术后非强制性接受辅助放疗(全乳房或腋窝Ⅱ、Ⅲ、Ⅳ水平),中位随访9.2年,腋窝复发转移仅发生在未行ALND的11例患者中,9例未接受腋窝放疗(1例仅接受乳房区域放疗,8例未接受放疗),cN0组1.5%(7/466)的SLN阴性患者发生腋窝淋巴结复发;cN1-2组中1.8%(2例SLN阴性和2例SLN阳性拒绝行ALND)的患者出现腋窝淋巴结转移,该研究结果显示,经过完整的NAT治疗后,转为ycN0的cN0-2患者接受标准的SLNB不会影响两组患者淋巴结分期的总生存情况,然而该研究入组cN2患者样本量少且未对可疑阳性淋巴结标记、未考虑淋巴结FNR问题。对于NAT后转为ycN0的cN2患者接受标准SLNB进行腋窝分期安全性问题仍需多中心、大样本量研究的进一步探索。
正在进行的随机试验(NSABP B- 51/RTOG1304)将阐明局部放疗对达到ypN0的cN1患者的临床价值,主要研究终点是NAT后SLNB/ALND阴性的cN1患者能否进一步豁免局部区域放疗[28]。
基于已完成和正在进行的临床试验,cN1乳腺癌术前NAT后转为ycN0、SLNB检出≥3枚阴性、使用TAD技术而豁免ALND的患者,腋窝淋巴结残留肿瘤负荷较低,并且随着TAD技术的日益成熟及辅助治疗的完善,cN2患者也可能成为豁免ALND的获益人群。
SLNB阳性的腋窝处理
cN+患者NAT后即使淋巴结中可见孤立的肿瘤细胞群(ITC≤0.2 mm)亦应行ALND。Moo等[29]分析SLN转移程度与腋窝淋巴结残留病变之间的关系,其中17%(1/6)为SLN残留的ITC患者,64%(28/44)SLN微转移患者均有非SLN转移,NAT后残留的肿瘤负荷更易复发转移,即使是ITC患者仍须接受ALND。值得关注的是,Piltin等[30]研究中20例SLN阳性患者仅接受腋窝区域放疗未行ALND(8例术中病理学检查结果为阴性,常规病理学检查结果为阳性;7例入组Alliance A11202临床试验;5例拒绝ALND),且2年内未发生复发转移。正在进行的Alliance A11202前瞻性随机临床试验[31]将提供NAT后SLN阳性cN1患者区域放疗代替ALND的预后数据。随着乳腺癌患者接受NAT后apCR率不断提高、放疗技术不断提高及对于腋窝残留负荷的有效控制,NAT后SLN阳性患者有望接受放疗替代ALND,可有效降低组织损伤、上肢运动的障碍、神经系统后遗症以及淋巴水肿的发生率。
总结与展望
综上所述,初始cN0的患者,NAT后已实现SLNB替代ALND的腋窝降阶梯处理,但初始cN1患者接受NAT后SLN阴性豁免ALND及豁免腋窝区域放疗的生存获益仍缺乏足够的肿瘤安全性数据。NAT后SLNB难以达到检出≥3枚SLN以降低FNR的要求,TAD技术可准确定位检出MLN,有望成为NAT后腋窝降期患者安全、可靠的腋窝分期技术。正在进行的前瞻性临床试验将提供SLN阳性患者接受放疗替代ALND的循证医学证据。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


