乳腺癌已经成为全球范围内的严重健康问题,对女性健康构成严重威胁,全球范围内乳腺癌的防治工作任重道远。随着对乳腺癌发病和转移机制的深入研究,以及多组学技术和肿瘤免疫等转化研究的快速发展,我们逐渐认识到乳腺癌是一种分子分型和临床特征高度异质性的肿瘤。不同亚型的乳腺癌在临床治疗方式上既存在差异又相互联系。因此,乳腺癌临床研究领域的成果层出不穷。
2024上半年,乳腺癌领域的研究在内分泌治疗、靶向治疗、免疫治疗和化疗等方面都取得了不断的进步,针对不同分型、分期的精准治疗方案更加关注患者生存质量和生存期的平衡。我们期待未来有更多高质量的临床研究数据和新型抗肿瘤药物的出现,为乳腺癌患者的管理提供更多的选择和支持。
本文回顾2024上半年乳腺癌领域的重磅内科治疗研究进展,为乳腺癌相关研究人员和临床医师提供参考,共同推进乳腺癌诊疗事业的发展!
三阴性乳腺癌
The Lancet Oncology :复旦大学附属肿瘤医院邵志敏教授、王中华教授、江一舟教授、范蕾教授团队公布基于分子亚型进行分类的复发或转移性TNBC一线治疗方案Ⅱ期试验(FUTURE-SUPER)结果 [1] 。
TNBC在分子驱动和免疫特性上表现出高度异质性。此前,复旦大学附属肿瘤医院邵志敏教授团队将TNBC分为四种亚型:腔面雄激素受体型(LAR)、免疫调节型(IM)、基底样免疫抑制型(BLIS)和间质型(MES)。FUTURE-SUPER研究的主要目的则是评估基于分子亚型进行分类的复发或转移性TNBC一线治疗的疗效与安全性。
根据分子亚型和基因组生物标志物,该研究将患者分为五个队列,随后按照1:1随机分配至A组(白蛋白结合型紫杉醇+靶向/免疫药物)和B组(白蛋白结合型紫杉醇),其中队列1(LAR-HER2 mut ):白蛋白结合型紫杉醇+吡咯替尼;队列2(LAR-PI3K/AKT mut ):白蛋白结合型紫杉醇+依维莫司;队列3(IM):白蛋白结合型紫杉醇+卡瑞利珠单抗+法米替尼;队列4(BLIS/MES-PI3K/AKT WT ):白蛋白结合型紫杉醇+贝伐珠单抗;队列5(MES-PI3K/AKT mut ):白蛋白结合型紫杉醇+依维莫司。研究的主要终点是PFS。
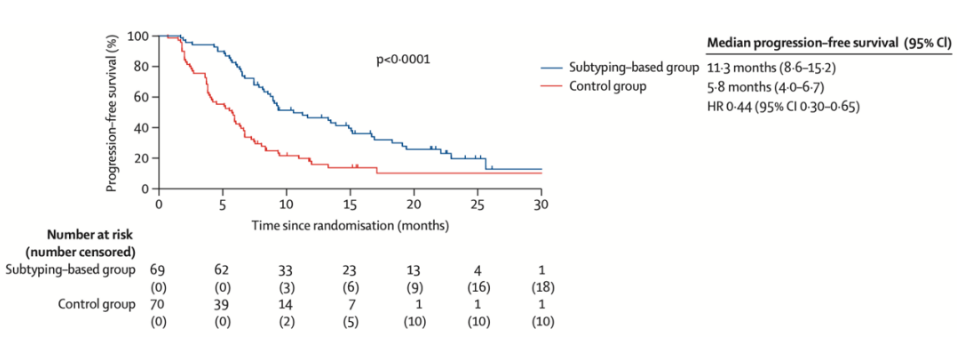
研究共纳入139例女性患者,中位随访时间为22.5个月。A组的中位PFS(11.3个月,95% CI:8.6~15.2)明显长于B组(5.8个月,95% CI:4.0~6.7),HR=0.44(95% CI:0.30~0.65, P <0.0001)。与B组相比,A组最常见的3~4级TRAE是中性粒细胞减少(30% vs 23%)、贫血(7% vs 0%)和丙氨酸氨基转移酶升高(6% vs 1%)。在A组中,69名患者中有7名(10%)报告了与治疗相关的严重不良事件。两组均无治疗相关死亡报告。
该研究表明,在TNBC患者中使用基于分子亚型的治疗方案具有潜在的临床益处,同时也为后续临床研究提供了理论基础与实证支持。
Nature :PARTNER试验结果公布——奥拉帕利新辅助化疗治疗TNBC并未改善pCR率、EFS或OS [2] 。
对于TNBC患者特别是那些携带BRCA1和BRCA2基因突变的患者,PARP抑制剂是一种极具潜力的治疗选择。奥拉帕利作为全球首个获批上市的PARP抑制剂,已被证实能够有效治疗BRCA1或BRCA2基因(gBRCAm)致病变异的乳腺癌患者。
PARTNER试验是一项前瞻性Ⅱ~Ⅲ期随机对照临床试验,招募患者为种系BRCA1和BRCA2野生型(gBRCAwt),这些患者以1:1的比例随机接受新辅助卡铂+紫杉醇联合/不联合奥拉帕利(150 mg)。主要终点是pCR,次要终点包括EFS和OS。
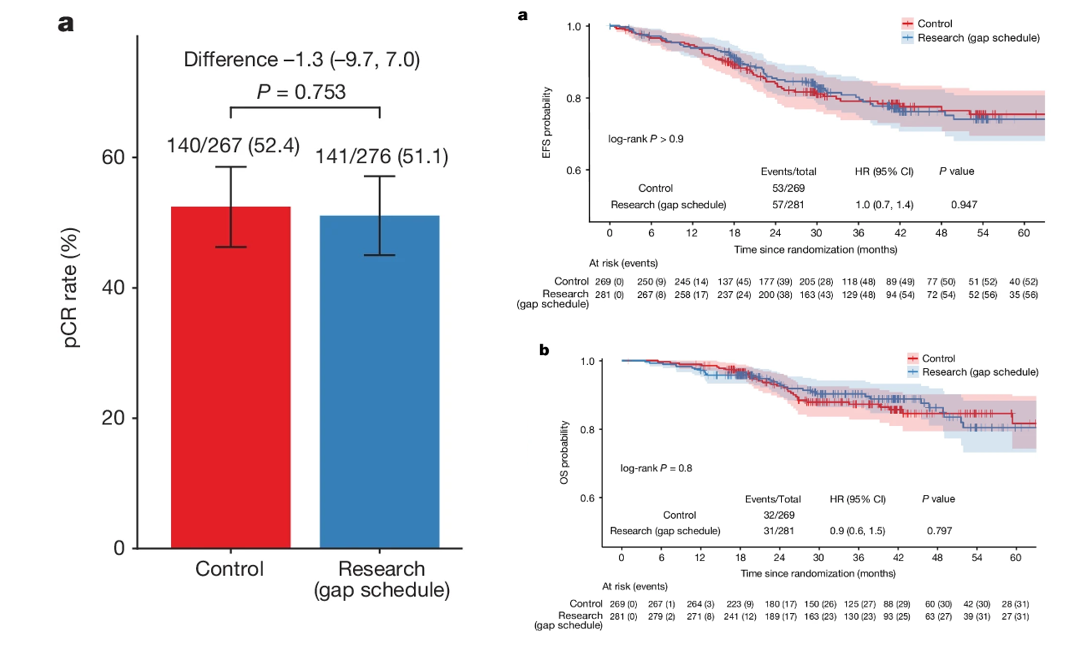
研究共纳入559例患者,中位随访时间为38个月。研究组有51.1%的患者达到pCR,对照组有52.4%的患者达到pCR( P=0.753)。研究组和对照组36个月时的估计EFS分别为80.2%和79.1%( P>0.9),OS分别为90%和87.2%( P=0.8)。在pCR患者中,36个月时的估计EFS为90.4%,在非pCR患者中为70%( P<0.001),OS分别为95.7%和83%( P<0.001)。
该研究表明,新辅助奥拉帕利与卡铂、紫杉醇和基于蒽环类的化疗联合用于种系BRCA1和BRCA2野生型三阴性乳腺癌患者时,并未改善pCR率、EFS或OS。
ASCO 2024 :中国医学科学院肿瘤医院徐兵河院士公布芦康沙妥珠单抗用于既往接受治疗的局部复发/转移性TNBC患者Ⅲ期试验(OptiTROP-Breast01)结果 [3]。
TROP2在TNBC中高表达,与较差的生存率相关。芦康沙妥珠单抗(SKB264)是一种靶向TROP2抗体偶联药物,OptiTROP-Breast01研究旨在评估SKB264用于治疗晚期TNBC患者的疗效与安全性。
在该研究中,研究团队将局部复发或转移性TNBC患者分为两组:A组(SKB264)与B组(医生选择的化疗方案:艾立布林、长春瑞滨、卡培他滨或吉西他滨),这些患者之前接受过两种或两种以上的治疗,包括至少一种转移性治疗。研究的主要终点是BICR评估的PFS。
研究共纳入263例患者,结果显示:BICR评估的中位PFS为A组5.7个月(95% CI:4.3~7.2),B组2.3个月(95% CI:1.6~2.7),进展或死亡风险降低69%(HR=0.31,95% CI:0.22~0.45, P<0.00001);6个月的PFS分别为43.4%和11.1%。TROP2 H-score评分>200的患者亚组分析显示,A组的中位PFS为5.8个月,B组的中位PFS为1.9个月(HR=0.28,95% CI:0.17~0.48)。OS中期分析显示,中位随访时间为10.4个月,A组中位OS未达到(95% CI:11.2~NE),B组中位OS为9.4个月(95% CI:8.5~11.7)。BICR评估的客观缓解率(A vs B)为43.8% vs 12.8%。安全性方面,最常见的3级TRAE(A vs B)是中性粒细胞减少(32.3% vs 47.0%),贫血(27.7% vs 6.1%)和白细胞计数下降(25.4% vs 36.4%)。
该研究表明,与化疗相比,在TNBC患者中使用SKB264具有显著临床获益,对晚期TNBC患者和治疗选择有限的患者具有可控的安全性。
HR + HER2 -乳腺癌
Journal of Clinical Oncology :PALOMA-2研究次要终点OS公布——与安慰剂联合来曲唑相比,哌柏西利联合来曲唑一线治疗ER + /HER2 - 晚期乳腺癌患者OS结局未显著改善 [4] 。
PALOMA-2研究是一项全球多中心、随机双盲、安慰剂对照的Ⅲ期临床研究。虽然该研究的初步结果显示,与安慰剂联合来曲唑相比,哌柏西利联合来曲唑可显著改善ER +/HER2 -晚期乳腺癌患者的PFS,但是哌柏西利能否显著改善这类患者的OS数据尚不成熟。
研究共纳入666例绝经后未经晚期系统治疗的ER +/HER2 -晚期乳腺癌患者,这些患者按照2:1随机分组至A组(哌柏西利+来曲唑,n=444),B组(安慰剂+来曲唑,n=222)。主要研究终点是由研究者评估的PFS,次要终点包括OS、ORR、临床获益、患者报告结局和安全性。
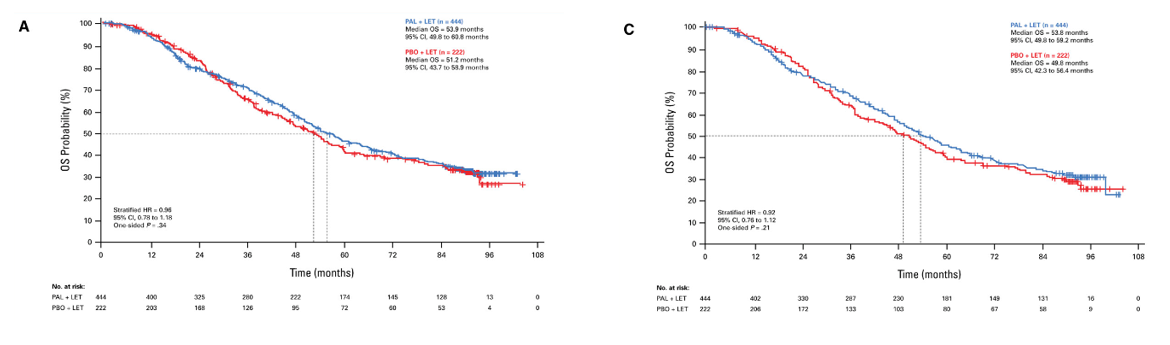
此次OS数据显示,中位随访90.1个月后,在666例患者(A vs B)中,观察到405例死亡(273 vs 132)。中位OS(A vs B)为:53.9个月(95%CI:49.8~60.8) vs 51.2个月(95%CI:43.7~58.9),HR=0.96(95% CI:0.78~1.18), P=0.34。由于治疗组之间生存结局未知的患者数量不平衡(分别为13.3%和21.2%),限制了对OS结果的解释。处理后的生存数据显示,OS仍无显著改善(A vs B):53.8个月(95%CI:49.8~59.2) vs 49.8个月(95%CI:42.3~56.4),HR=0.92(95% CI:0.76~1.12), P=0.21。
总之,所有PALOMA试验都表明,与安慰剂联合内分泌治疗或单独使用内分泌治疗相比,哌柏西利联合内分泌治疗在ER +/HER2 -晚期乳腺癌患者的主要终点PFS中具有统计学意义和临床获益,但OS无显著改善。
The New England Journal of Medicine :瑞波西利联合内分泌治疗HR + /HER2 - 早期乳腺癌患者Ⅲ期试验中期分析结果公布 [5] 。
瑞波西利已被证明对HR +/HER2 -的晚期乳腺癌患者具有显著的OS获益,但是其对HR +/HER2 -的早期乳腺癌的疗效尚不清楚。该研究旨在评估瑞波西利联合内分泌治疗HR +/HER2 -的早期乳腺癌患者的疗效与安全性。
该研究是一项国际、开放标签、随机、Ⅲ期试验,患者以1:1的比例随机分配接受瑞波西利联合非甾体芳香化酶抑制剂(NSAI,来曲唑或阿那曲唑;n=2549)或NSAI治疗(n=2552)。符合条件的患者均为Ⅱ/Ⅲ期乳腺癌。研究的主要终点是无浸润性疾病生存期(IDFS)。
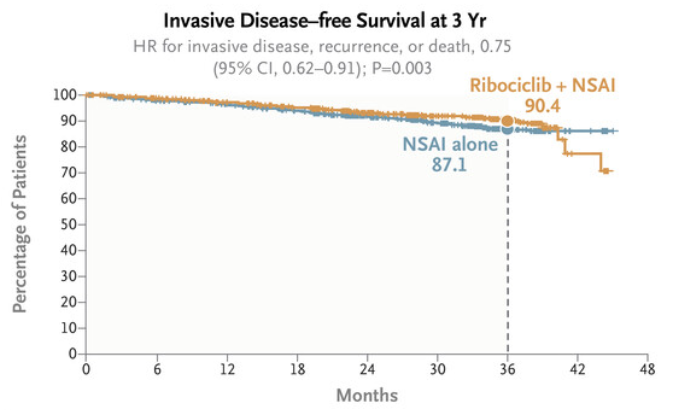
截至2023年1月11日,共有426名患者患有浸润性疾病、复发或死亡。与单独使用NSAI相比,瑞波西利联合NSAI具有显著的IDFS获益。3年时,瑞波西利联合NSAI组的IDFS率为90.4%,NSAI组为87.1%(HR=0.75,95% CI:0.62~0.91, P=0.003)。安全性方面,并未增加新的不良事件。
研究表明,瑞波西利联合NSAI显著改善了HR +/HER2 -Ⅱ期/Ⅲ期乳腺癌患者的无浸润性疾病生存期。
The Lancet Oncology :Enobosarm用于治疗ER + /HER2 + /AR + 晚期乳腺癌患者Ⅱ期试验(G200802研究)结果公布 [6] 。
AR是ER阳性乳腺癌的肿瘤抑制因子。本研究旨在评估Enobosarm用于治疗ER +/HER2 +/AR +晚期乳腺癌患者的疗效和安全性。
G200802研究是一项国际、随机、开放标签、多中心、平行设计、Ⅱ期试验,患者以1:1的比例随机分配为两组:A组(Enobosarm每天口服9 mg;n=72),B组(Enobosarm每天口服18 mg;n=64)。主要终点是中心确诊的AR阳性患者(即可评估人群)24周时的临床获益率。
结果显示,在136例患者中,有102例构成了可评估人群(A组,n=50;B组,n=52)。中位随访时间为7.5个月。在24周时,A组当中16例(32%,95% CI:20~47)和B组当中的15例(29%,95% CI:17~43)具有临床获益。安全性方面,最常见的3级或4级药物相关不良事件是肝转氨酶升高、高钙血症和疲劳。其中4例患者死亡(A组1例,B组3例)被认为与Enobosarm无关。
该研究表明,Enobosarm在ER +/HER2 +/AR +的晚期乳腺癌患者中具有临床获益。
JAMA Oncology :一项评估接受新辅助阿那曲唑、氟维司群或其联合治疗的ER + /HER2 - 临床Ⅱ至Ⅲ期绝经后乳腺癌患者的内分泌敏感疾病发生率的Ⅲ期随机临床试验结果公布 [7] 。
这是一项随机、多中心、开放标签、Ⅲ期试验(ALTERNATE研究),此次是针对该研究新辅助阶段的主要分析,旨在确定单独使用氟维司群、阿那曲唑或联合是否会增加内分泌敏感性疾病的发生率(ESDR)。
共有1362例女性患者登记到新辅助阶段,其中1298例组成了分析队列(阿那曲唑:n=434;氟维司群:n=430;联合治疗:n=434)。结果显示,在1298例可评估患者中,阿那曲唑、氟维司群和联合治疗的ESDR分别为18.7%(95% CI,15.1%~22.7%)、22.8%(95% CI,18.9%~27.1%)和20.5%(95% CI,16.8%~24.6%)。与阿那曲唑相比,含氟维司群的方案均未显著改善ESDR或第4周Ki67抑制。阿那曲唑、氟维司群和联合治疗组第4周或第12周Ki67大于10%的发生率分别为25.1%、24.2%和15.7%。
在这项随机临床试验中,ALTERNATE研究的新辅助阶段分析表明,在改善ESDR方面,并未证明氟维司群或氟维司群联合阿那曲唑优于单独使用阿那曲唑。
The Lancet Oncology :吉达利塞联合哌柏西利和内分泌治疗药物治疗HR + /HER2 - 晚期乳腺癌患者的Ib期研究剂量扩展结果公布 [8] 。
在乳腺癌中,PI3K-mTOR通路的失调经常发生。该研究对吉达利塞联合哌柏西利和内分泌治疗药物治疗HR +/HER2 -晚期乳腺癌患者进行了评估。
共有103例女性被纳入剂量扩增组,这些患者被分为4组:A组31例(晚期患者未接受治疗,一线),B组13例(一~二线内分泌治疗进展但未使用CDK4/6抑制剂),C组32例和D组27例(接受过包括CDK4/6抑制剂的一线或多线治疗者)。A组和C组每周静脉注射吉达利塞180 mg,治疗周期为28天,D组为第1、8和15天。来曲唑(A组)、氟维司群(B组和D组)和哌柏西利(所有组)以标准剂量和治疗方案给药。主要终点是研究者根据RECIST 1.1版评估的ORR。
结果显示,中位随访时间分别为:A组16.6个月,B组11.0个月,C组3.6个月,D组9.4个月。A组27例可评估的患者中,有23人(85.2%;90% CI:69.2~94.8)观察到客观缓解;B组13例可评估的患者中有8人(61.5%,90% CI:35.5~83.4)观察到客观缓解,C组28例可评估的患者中有7人(25.0%,90% CI:12.4~41.9)观察到客观缓解,D组27例可评估的患者中有15人(55.6%,90% CI:38.2~72.0)观察到客观缓解,其中包括携带野生型和突变型PIK3CA肿瘤患者。安全性方面,最常见的3~4级TRAE是中性粒细胞减少症(65/103,63%)、口腔炎(28/103,27%)和皮疹(21/103,20%)。
研究表明,有必要进一步开展关于吉达利塞联合哌柏西利和来曲唑或氟维司群治疗HR +/HER2 -晚期乳腺癌患者的相关研究。
HER2阳性乳腺癌
Nature Communication :复旦大学附属肿瘤医院邵志敏教授、黄亮教授团队公布帕妥珠单抗用于新辅助/辅助治疗HER2阳性早期/局部晚期乳腺癌的Ⅲ期试验(PEONY研究)结果 [9] 。
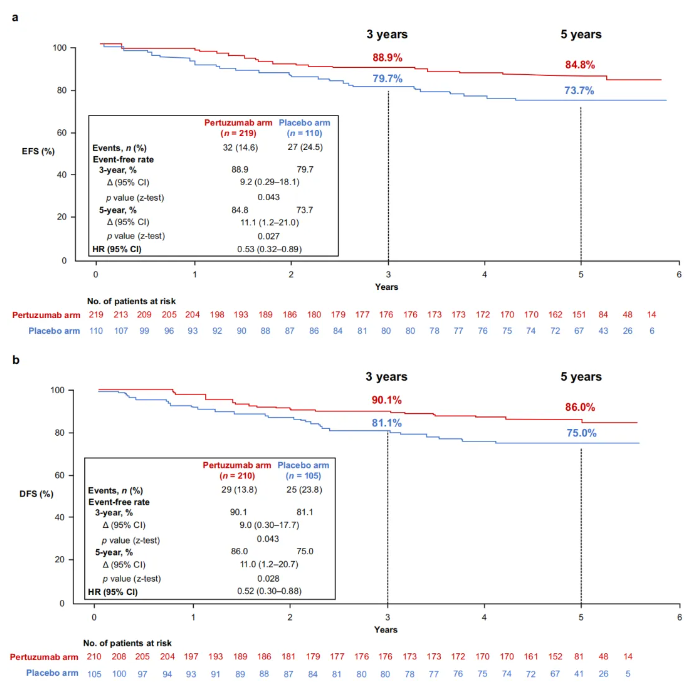
这是一项随机、多中心、双盲、安慰剂对照Ⅲ期试验,旨在比较在曲妥珠单抗和多西他赛的基础上加用帕妥珠单抗治疗亚洲HER2阳性早期或局部晚期乳腺癌患者的疗效、安全性和耐受性。这一研究是该人群中首个在曲妥珠单抗基础上加用帕妥珠单抗的随机Ⅲ期研究,并达到了其主要终点。本次报告该研究的长期疗效最终分析(3年与5年)。
研究共纳入329例原发肿瘤大于2 cm的HER2阳性早期或局部晚期乳腺癌女性患者,这些患者随机分为帕妥珠单抗组219例;安慰剂组110例。结果显示,5年随访结束时59例(17.9%)患者发生疾病复发/进展或死亡。安慰剂组和帕妥珠单抗组的3年EFS率分别为79.7%和88.9%,5年EFS率分别为73.7%和84.8%;两组3年DFS率分别为81.1%和90.1%,5年DFS率分别为75.0%和86.0%。安慰剂组和帕妥珠单抗组的3年OS率分别为91.0%和97.0%,5年OS率分别为90.0%和93.9%。安全性数据与已知的帕妥珠单抗安全性一致。
在这项随机临床试验中,帕妥珠单抗组在5年EFS率和5年DFS率上均有显著提高,且安全性良好,进一步证实了“曲帕双靶”在HER2阳性乳腺癌新辅助/辅助治疗中的积极作用,增加了该方案术前术后全程治疗的循证依据。
Journal of Clinical Oncology :中山大学宋尔卫院士公布SHR-A1811(靶向HER2抗体偶联药物)用于治疗HER2表达或突变的晚期实体瘤中的安全性、有效性和药代动力学Ⅰ期研究结果 [10] 。
这是一项全球、多中心、首次人体Ⅰ期试验,旨在评估SHR-A1811在经过大量预处理的HER2表达或突变的晚期实体瘤中的安全性、耐受性、抗肿瘤活性和药代动力学。
共纳入307例HER2表达或突变的不可切除、晚期或转移性实体瘤且对标准疗法难治或不耐受的患者。SHR-A1811每3周静脉注射一次,剂量范围为1.0至8.0 mg/kg。主要终点是剂量限制性毒性、安全性和推荐的Ⅱ期剂量。
截至2023年2月28日,6.4 mg/kg组的一名患者出现剂量限制性毒性(全血细胞减少症和结肠炎)。最常见的3级或更高级别的AE包括中性粒细胞计数减少(119例,38.8%)和白细胞计数减少(70例,22.8%)。间质性肺病仅发生于8例(2.6%)患者。严重不良事件和死亡发生率分别为70例(22.8%)和13例(4.2%)。对于客观反应率,SHR-A1811在所有患者中为59.9%(184/307),HER2阳性乳腺癌为76.3%(90/118),HER2低表达乳腺癌为60.4%(55/91),98例非乳腺肿瘤为45.9%(39/85)。
研究表明,SHR-A1811在经过大量预处理的晚期实体瘤中表现出可接受的耐受性、有希望的抗肿瘤活性和良好的药代动力学特征。对于各种肿瘤类型,推荐的Ⅱ期剂量为4.8或6.4 mg/kg。
Cancer Communications :中国医学科学院肿瘤医院徐兵河院士公布维迪西妥单抗(DV,靶向HER2抗体偶联药物)用于HER2过表达和HER2低表达晚期乳腺癌患者的Ⅰ/Ⅰb期研究结果 [11] 。
这是一项开放标签、单臂、Ⅰ/Ⅰb期试验,旨在评估DV用于HER2过表达和HER2低表达晚期乳腺癌患者的安全性和疗效。
在Ⅰ期剂量递增研究(C001 CANCER)中,HER2过表达晚期乳腺癌患者每两周接受一次剂量为0.5~2.5 mg/kg的DV,直到出现不可接受的毒性或疾病进展。Ⅰb期剂量范围和扩展研究(C003 CANCER)招募了两个队列:以1.5~2.5 mg/kg Q2W剂量接受DV的HER2过表达晚期乳腺癌患者,并确定推荐的Ⅱ期剂量,以及以2.0 mg/kg Q2W剂量接受DV的HER2低表达晚期乳腺癌患者,以探索DV在HER2低表达晚期乳腺癌中的疗效和安全性。其中C001 CANCER纳入24例HER2过表达晚期乳腺癌患者,C003 CANCER纳入46例HER2过表达晚期乳腺癌患者和66例HER2低表达晚期乳腺癌患者。
结果显示,疗效方面,在2.0 mg/kg RP2D Q2W时,HER2过表达和HER2低表达晚期乳腺癌确认的ORR分别为42.9%(95% CI:21.8%~66.0%)和33.3%(95% CI:22.2%~46.0%),HER2过表达和HER2低晚期乳腺癌的中位无进展生存期分别为5.7个月(95% CI:5.3~8.4个月)和5.1个月(95% CI:4.1~6.6个月)。安全性方面,常见的3级或更高级别TRAE包括中性粒细胞计数减少(17.6%)、γ-谷氨酰转移酶升高(13.2%)、乏力(11.0%)、白细胞计数减少(9.6%)、周围神经病变(感觉减退:5.9%;神经毒性:0.7%)、疼痛(5.9%)。
研究表明,DV在HER2过表达和HER2低表达晚期乳腺癌中显示出良好的疗效,在2.0 mg/kg Q2W时具有良好的安全性。
Annals of Oncology :T-DXd用于既往接受过治疗的HER2阳性转移性乳腺癌患者的最新生存结果公布(DESTINY-Breast01 Ⅱ期试验) [12] 。
DESTINY-Breast01试验是一项多中心、开放标签、单臂、Ⅱ期试验,其初步分析表明,T-DXd用于既往接受T-DM1治疗的HER2阳性转移性乳腺癌患者具有持久的抗肿瘤活性。此次DESTINY-Breast01报告的最新生存结果进一步证明了T-DXd在既往接受过治疗的HER2阳性转移性乳腺癌患者中具有持久的抗肿瘤活性,并且具有和此前一致的安全性。
该试验对T-DM1耐药或难治的HER2阳性转移性乳腺癌患者每3周静脉注射T-DXd 5.4 mg/kg,直至疾病进展、不可接受的不良事件或参与者退出。主要终点是ORR。次要终点包括OS、DoR、PFS和安全性。
最新结果显示,在每3周接受T-DXd 5.4 mg/kg的患者中,ORR为62.0%(95% CI:54.5%~69.0%;n=184)。中位OS为29.1个月(95% CI:24.6~36.1个月),比初步分析延长了4.5个月。中位PFS和DoR分别为19.4个月(95% CI:14.1~25.0个月)和18.2个月(95% CI:15.0个月~不可评估)。安全性方面,183例患者(99.5%)观察到药物相关治疗不良事件,99例患者(53.8%)有一种或多种≥3级相关治疗不良事件。
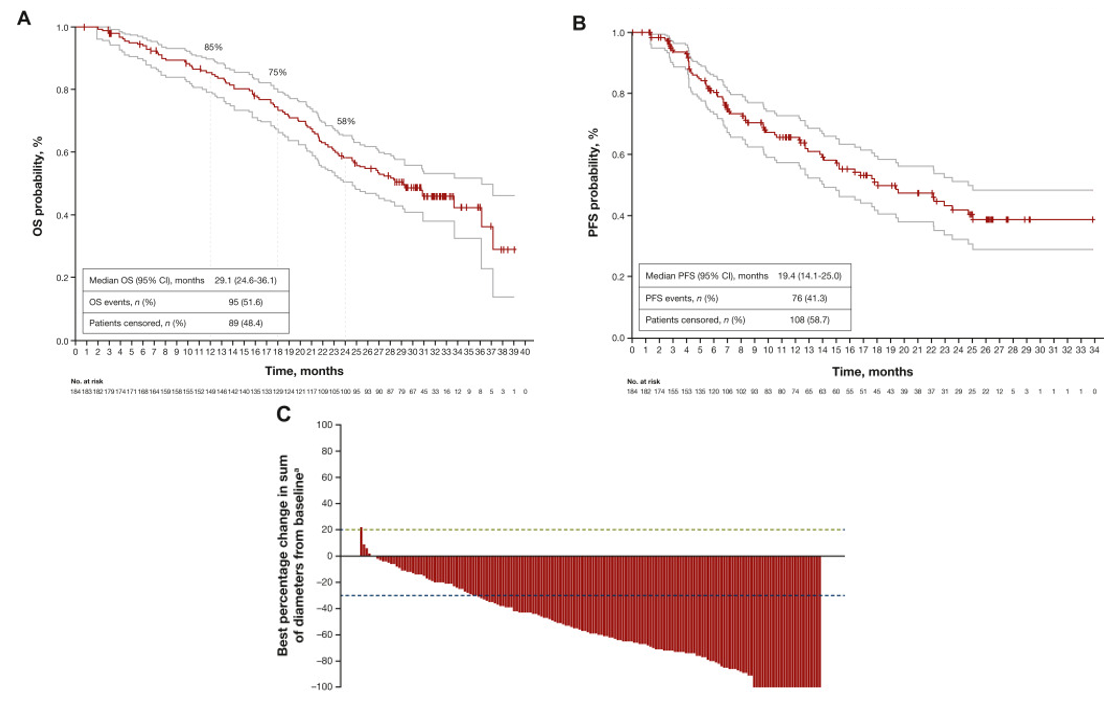
此次更新的DESTINY-Breast01试验生存数据,为T-DXd在既往接受过治疗的HER2阳性转移性乳腺癌患者中展现出的持续抗肿瘤活性提供了有力证据。
[1]Fan L, Wang ZH, Ma LX, et al. Optimising first-line subtyping-based therapy in triple-negative breast cancer (FUTURE-SUPER): a multi-cohort, randomised, phase 2 trial. Lancet Oncol. 2024 Feb;25(2):184-197.
[2]Abraham JE, Pinilla K, Dayimu A, et al. The PARTNER trial of neoadjuvant olaparib with chemotherapy in triple-negative breast cancer. Nature. 2024 May;629(8014):1142-1148.
[3]Binghe Xu, et al. Sacituzumab tirumotecan (SKB264/MK-2870) in patients (pts) with previously treated locally recurrent or metastatic triple-negative breast cancer (TNBC): Results from the phase III OptiTROP-Breast01 study. JCO 42, 104-104(2024).
[4]Slamon DJ, Diéras V, Rugo HS, et al. Overall Survival With Palbociclib Plus Letrozole in Advanced Breast Cancer. J Clin Oncol. 2024 Mar 20;42(9):994-1000.
[5]Slamon D, Lipatov O, Nowecki Z, et al. Ribociclib plus Endocrine Therapy in Early Breast Cancer. N Engl J Med. 2024 Mar 21;390(12):1080-1091.
[6]Palmieri C, Linden H, Birrell SN, et al. Activity and safety of enobosarm, a novel, oral, selective androgen receptor modulator, in androgen receptor-positive, oestrogen receptor-positive, and HER2-negative advanced breast cancer (Study G200802): a randomised, open-label, multicentre, multinational, parallel design, phase 2 trial. Lancet Oncol. 2024 Mar;25(3):317-325.
[7]Ma CX, Suman VJ, Sanati S, et al. Endocrine-Sensitive Disease Rate in Postmenopausal Patients With Estrogen Receptor-Rich/ERBB2-Negative Breast Cancer Receiving Neoadjuvant Anastrozole, Fulvestrant, or Their Combination: A Phase 3 Randomized Clinical Trial. JAMA Oncol. 2024 Mar 1;10(3):362-371.
[8]Layman RM, Han HS, Rugo HS, et al. Gedatolisib in combination with palbociclib and endocrine therapy in women with hormone receptor-positive, HER2-negative advanced breast cancer: results from the dose expansion groups of an open-label, phase 1b study. Lancet Oncol. 2024 Apr;25(4):474-487.
[9]Huang L, Pang D, Yang H, et al. Neoadjuvant-adjuvant pertuzumab in HER2-positive early breast cancer: final analysis of the randomized phase III PEONY trial. Nat Commun. 2024 Mar 9;15(1):2153.
[10]Yao H, Yan M, Tong Z, et al. Safety, Efficacy, and Pharmacokinetics of SHR-A1811, a Human Epidermal Growth Factor Receptor 2-Directed Antibody-Drug Conjugate, in Human Epidermal Growth Factor Receptor 2-Expressing or Mutated Advanced Solid Tumors: A Global Phase I Trial. J Clin Oncol. 2024 Jun 20:JCO2302044.
[11]Wang J, Liu Y, Zhang Q, et al. Disitamab vedotin, a HER2-directed antibody-drug conjugate, in patients with HER2-overexpression and HER2-low advanced breast cancer: a phase I/Ib study. Cancer Commun (Lond). 2024 Jun 28.
[12]Saura C, Modi S, Krop I, et al. Trastuzumab deruxtecan in previously treated patients with HER2-positive metastatic breast cancer: updated survival results from a phase II trial (DESTINY-Breast01). Ann Oncol. 2024 Mar;35(3):302-307.











 苏公网安备32059002004080号
苏公网安备32059002004080号


