2024年6月,达拉非尼+曲美替尼(D+T)双靶再登顶刊,Ⅲ期COMBI-AD研究的最终随访结果刊于《The New England Journal of Medicine》(IF=96.2),披露了双靶黑色素瘤辅助治疗100个月随访结果,为该治疗领域迄今为止最长的随访结果数据,证实了对于BRAF V600突变黑色素瘤III期辅助治疗双靶方案的长生存获益。双靶方案最早在疾病领域的探索始于黑色素瘤,于2014年及2018年获美国食品药品监督管理局(FDA)相继批准黑色素瘤晚期及辅助治疗适应症。基于早期夯实的基础研究及转化医学策略,随后获批了肺癌、甲状腺癌等多项适应症。随后新型研究设计推动下精准治疗理念落地实践,2022年FDA批准双靶治疗用于1岁及以上BRAF V600E突变的泛癌种患者的治疗。回顾D+T从黑色素瘤、非小细胞肺癌、再到实体瘤泛癌种的发展的研发历程,多项突破性治疗结果推动了肿瘤治疗领域的创新进步,囊括了包括《The Lancet Oncology》(《Lancet Oncol》IF=41.6)、《The New England Journal of Medicine》(《NEJM》 IF=96.2)、《Journal of Clinical Oncology》(《JCO》IF=42.1)、《Annals Of Oncology》(IF=56.7)等21篇顶刊研究,稳扎稳打擘画“异病同治”治疗格局(图1)。
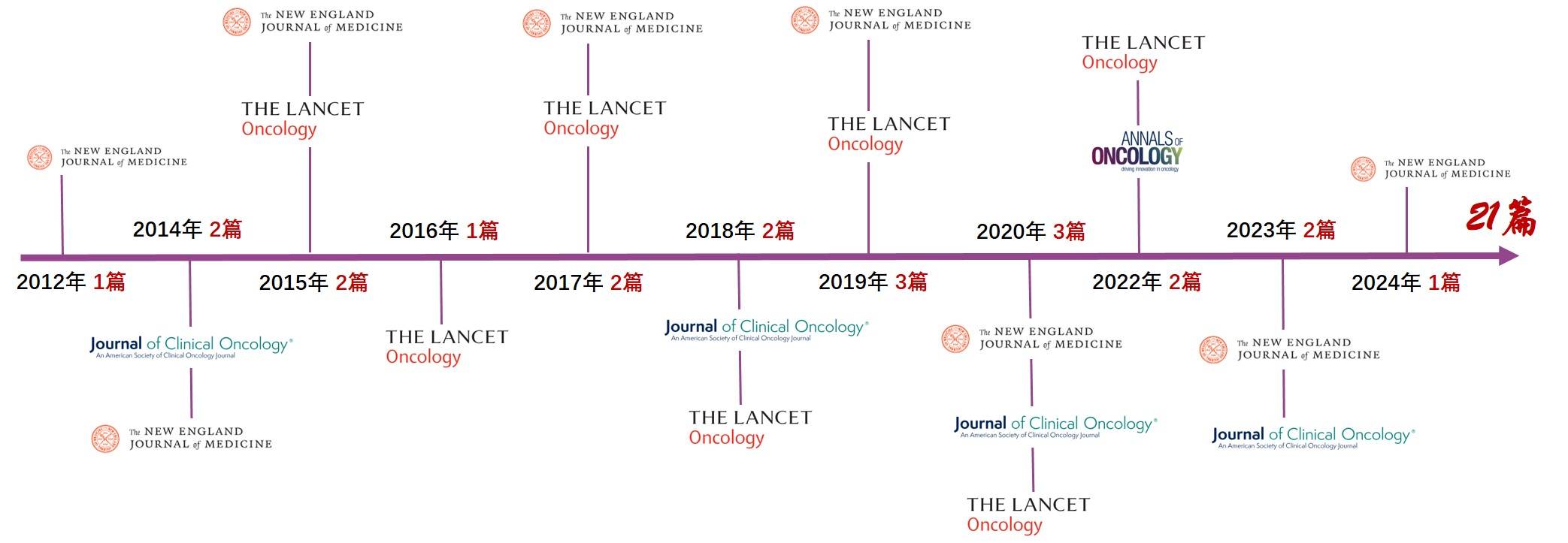
图1. D+T双靶顶刊之旅
早期临床前探索:通路及耐药机制探索 奠定双靶方案优势
早在2002年,癌症基因组计划首次阐述了BRAF突变与肿瘤发生的关联,报告了66%的黑色素瘤存在BRAF突变[1]。BRAF抑制剂通过抑制ERK磷酸化实现对肿瘤细胞的抑制。最早上市的BRAF抑制剂维莫非尼单药在晚期黑色素瘤患者中快速缩瘤,但多数患者6个月后出现了耐药及复发[2],随后的基础研究及临床研究迈入双靶治疗时代,BRAF抑制剂联合MEK抑制剂能够起到协同增效的作用,抑制MEK能够使耐药细胞系再次敏感,克服肿瘤复发(图2)。
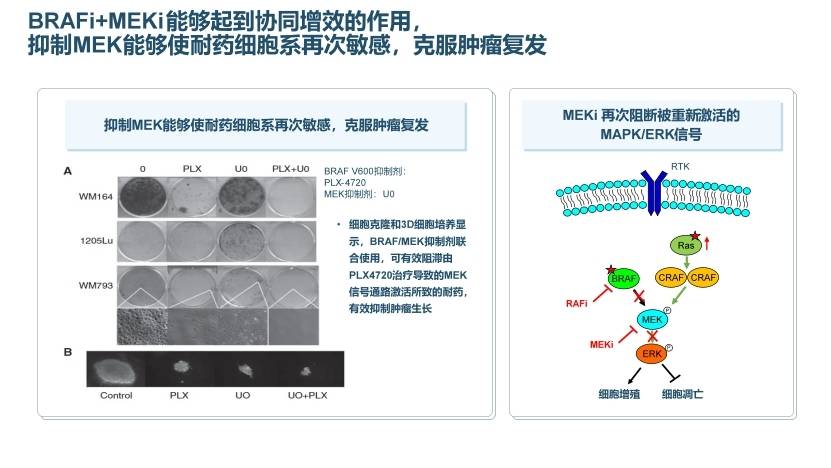
图2. BRAFi+MEKi协同增效
始于黑色素瘤:晚期、辅助、新辅助,治疗获益不断延伸
双靶研发之旅始于BRAF V600突变晚期黑色素瘤,I/II期无缝研究临床数据于2012年首次见刊于《The New England Journal of Medicine》(《NEJM》 IF=96.2),证实了不同剂量组合的疗效及安全性数据(图3)。2014年该研究第二次研究数据结果刊登于《Journal of Clinical Oncology》(《JCO》IF=42.1),报道了不同剂量组合达拉非尼单药及联合治疗组ORR、PFS及OS获益情况[4]。2018年该研究5年随访结果再次登临《Journal of Clinical Oncology》,显示接受D+T双靶以及达拉非尼交叉至D+T双靶患者的4年和5年OS率分别为30%和28%,4年和5年PFS率均为13%,未见新的安全信号,初步显示了D+T双靶治疗的生存获益[5]。
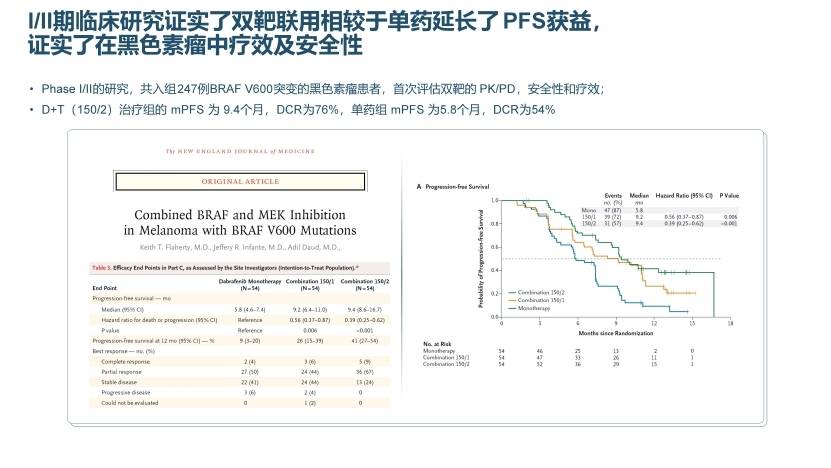
图3. D+T双靶初步证实治疗晚期黑色素瘤获益
在恶性黑色素瘤领域随后开展了两项全球多中心III期注册研究,COMBI-d[6]及COMBI-v研究[7]中D+T分别对比当时的标准治疗方案达拉非尼单药及维莫非尼单药,研究结果分别于2014年及2015年连续两年攀顶《The New England Journal of Medicine》,显示了D+T双靶较单靶更高的生存获益。同年,COMBI-v研究生活质量结果刊登于《The Lancet Oncology》(《Lancet Oncol》IF=41.6),显示D+T双靶较维莫非尼的欧洲癌症研究与治疗组织生命质量测定量表(EORTC QLQ-C30)整体健康评分持续显著改善,为患者带来了更好的生活质量[8]。2019年,COMBI-d和 COMBI-v研究的5年随访汇总分析结果刊发于《The New England Journal of Medicine》。5年随访结果显示,D+T双靶一线治疗BRAF V600突变晚期黑色素瘤,4年PFS率为21%,OS率为37%;5年PFS率为19%,OS率为34%(图4);19%的患者达到CR,其5年OS率为71%,最终奠定了D+T双靶一线治疗BRAF V600突变晚期黑色素瘤治疗金标准位置[9]。
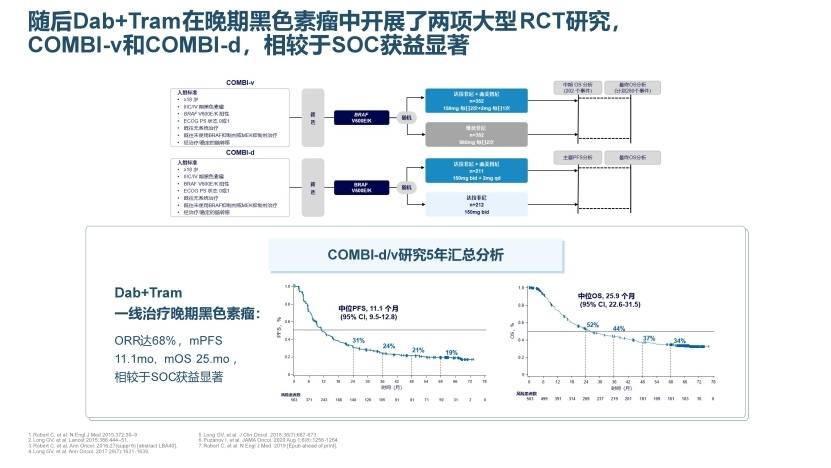
图4. COMBI-d/v研究D+T双靶5年汇总分析
在黑色素瘤辅助治疗领域的COMBI-AD研究在2017年刊登于《The New England Journal of Medicine》。对于BRAF V600E/K突变的Ⅲ期黑色素瘤患者按1:1随机分组后予以D+T双靶(n=438例)和安慰剂(n=432例)辅助治疗,报道了随访2.8年的初步研究结果[10]。患者报告结局(PRO)于2019年见刊于《The Lancet Oncology》,在48个月的随访期间,D+T双靶与安慰剂组的EQ-5D-3L量表评分视觉模拟评分(VAS)均较基线改善,且二者间无显著差异,保障了患者的生活质量[11]。2020年,5年随访结果再登《The New England Journal of Medicine》,D+T双靶较安慰剂组改善5年RFS率(52% vs 36%)及DMFS率(65% vs 54%)[12]。2024年,COMBI-AD研究最终随访结果三临《The New England Journal of Medicine》,披露了黑色素瘤辅助治疗领域最长的随访结果。此时,D+T双靶中位随访时间已达100个月,D+T双靶较安慰剂提升患者8年RFS率(50% vs 35%),提升患者8年DMFS率(64% vs 53%);8年OS率具有改善趋势(71% vs 65%)。安全性与既往一致,未见新的安全信号,证实了D+T双靶辅助治疗黑色素瘤的持续、长期获益(图5)[13]。除在晚期及辅助阶段的布局,D+T也相继开展2项在新辅助阶段的探索,于2018年及2019年见刊于《The Lancet Oncology》,针对可手术的III期或伴寡转移的IV 期BRAF V600E/K突变黑色素瘤患者进行探索,均获得满意的病理完全缓解(pCR),显示了D+T双靶新辅助治疗的潜能[14,15]。
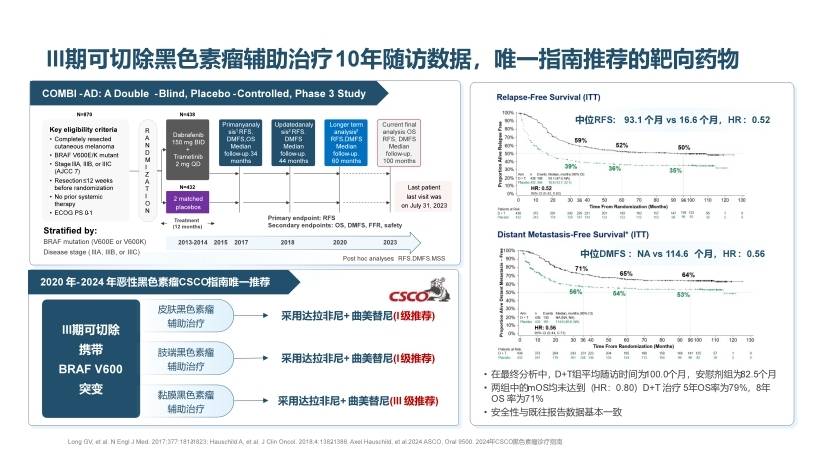
图5. COMBI-AD研究最终随访的RFS与DMFS
拓展至非小细胞肺癌领域:加速至转换研究阶段
针对BRAF V600突变非小细胞肺癌(NSCLC)的BRF113928研究为II期、开放、多中心研究,分为3个队列:队列A主要纳入达拉非尼单药后线治疗、队列B则纳入双靶后线治疗患者、队列C入组D+T一线初治患者,BRF113928研究分别于2016年、2017年两次见刊于《The Lancet Oncology》,显示队列C双靶一线治疗在三种方案中生存获益最优,mPFS 14.6个月,mOS 24.6个月,5年OS率22%(图6)[16,17]。 2022年世界肺癌大会(WCLC)发布了首个中国BRAF 突变NSCLC前瞻性研究结果。该项多中心、单臂、II期研究纳入20例Ⅳ期NSCLC患者,予以D+T双靶治疗,中位随访5个月,ORR 75%,DCR 95%,mPFS与mOS均未成熟,填补亚洲空白[18]。
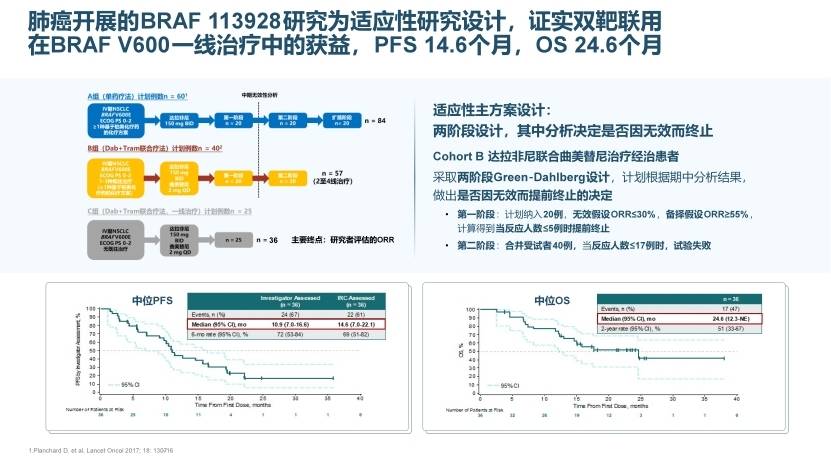
图6. BRF113928研究D+T双靶治疗NSCLC的生存获益
布局“异病同治”格局:优势瘤种不断扩展
伴随精准治疗理念发展,基于患者分子生物病理学特征基因组信息,匹配个体化诊断和治疗策略已成为肿瘤治疗的新趋势。双靶在临床前研究阶段探索了在多种实体瘤中的治疗活性,在多种肿瘤类型中均有相对广泛的治疗反应。2022年6月,达拉非尼联合曲美替尼方案获FDA批准用于BRAF突变“tumor agnostic”适应症,而该适应症的获批主要基于三项研究数据NC-MATCH、ROAR及儿童胶质瘤患者中展开的研究CTMT212X2101(图7)。
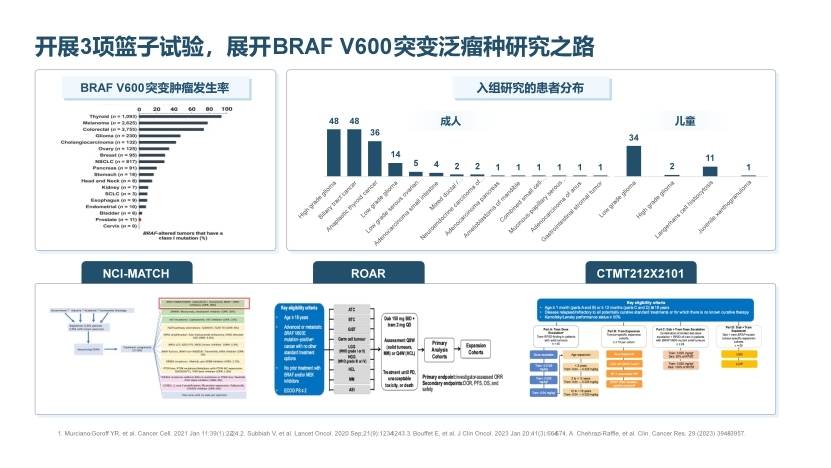
图7. D+T双靶的三项泛瘤种研究
NCI-MATCH是一个由美国国家癌症研究所(NCI)主导的重要研究项目,招募了数千名患有不同类型肿瘤的患者,通过对他们的肿瘤样本进行全面的分子分析和遗传检测,探索肿瘤患者精准治疗方案路径。其中BRAF V600E队列的实体瘤患者选择D+T治疗方案,初步结果于2020年刊登于《Journal of Clinical Oncology》,纳入了妇科肿瘤、肝内胆管癌、中枢神经系统肿瘤、混合型神经内分泌癌、肛门腺癌、胰腺癌、下颌骨成釉细胞瘤癌共计35例患者,D+T方案显示出广泛的治疗反应,ORR 37.9%,mPFS 11.4个月,mOS 28.6个月[19]。
ROAR研究为II期多中心篮子研究,共纳入BRAF V600突变的未分化甲状腺癌(ATC)、胆道癌(BTC)、胃肠道间质瘤(GIST)、生殖细胞肿瘤(Germ cell tumour)、高级别胶质瘤(HGG)、低级别胶质瘤(LGG)、毛细胞白血病(HCL)、恶性黑色素瘤(MM)、肺原位癌(ASI)9种实体瘤队列,采用D+T双靶治疗,多个队列已报道研究数据:
胆管癌-2020年《The Lancet Oncology》:独立评审委员会评估的ORR为47%,mPFS为9个月,mOS为14个月[20]。
胶质瘤-2022年《The Lancet Oncology》:45例高级别胶质瘤、13例低级别胶质瘤予以D+T双靶治疗,显示高级别胶质瘤ORR为33%,低级别为69%[21]。
未分化甲状腺癌-2022年《Annals Of Oncology》(IF=56.7):研究者评估的ORR为56%,12个月肿瘤持续缓解(DOR)率为50%,mPFS为6.7个月,mOS为14.5个月[22]。
毛细胞白血病-2018年美国血液学会年会(ASH):中位治疗17个月显示,ORR为78%,12个月PFS率及OS率均为97.6%[23]。
2023年,D+T 双靶在儿童胶质瘤患者中展开的研究CTMT212X2101见刊于《The New England Journal of Medicine》,双靶一线治疗BRAF V600突变儿童(1~17岁)低级别胶质瘤II期研究显示,D+T双靶较标准化疗(SOC)的ORR(47% vs 11%,P<0.001)、mPFS(20.1个月 vs 7.4个月, P<0.001)及安全性均得到显著改善[24]。同年《Journal of Clinical Oncology》的一项D+T双靶治疗复发/难治BRAF V600突变儿童高级别胶质瘤II期研究显示ORR为56%,mOS为32.8个月[25],改写了儿童脑胶质瘤的治疗格局。
基于上述国际顶刊的一座座里程碑,D+T双靶研发历程从黑色素瘤及肺癌开始布局,在FDA相继获批了6项适应症。精准治疗时代,“Tumor agnostic”成为热点议题,临床治疗方案选择仍需要基于夯实的循证医学证据,泛瘤种的小规模篮子研究设计对临床研究指导意义有限。D+T的研发路径借力于新型研究设计同时仍有夯实的数据基础,在多瘤种中进行了充分的数据验证,稳扎稳打在多瘤种中开展临床研究证实了其广泛的治疗反应。
1. Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer. Nature. 2002;417(6892):949-954. doi:10.1038/nature00766
2. McArthur GA, Chapman PB, Robert C, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014;15(3):323-332. doi:10.1016/S1470-2045(14)70012-9
3. Flaherty KT, Infante JR, Daud A, et al. Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N Engl J Med. 2012;367(18):1694-1703.
4. Johnson DB, Flaherty KT, Weber JS, et al. Combined BRAF (Dabrafenib) and MEK inhibition (Trametinib) in patients with BRAFV600-mutant melanoma experiencing progression with single-agent BRAF inhibitor. J Clin Oncol. 2014;32(33):3697-3704. doi:10.1200/JCO.2014.57.3535
5. Long GV, Eroglu Z, Infante J, et al. Long-Term Outcomes in Patients With BRAF V600-Mutant Metastatic Melanoma Who Received Dabrafenib Combined With Trametinib. J Clin Oncol. 2018;36(7):667-673. doi:10.1200/JCO.2017.74.1025
6. Long GV, Stroyakovskiy D, Gogas H, et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med. 2014;371(20):1877-1888. doi:10.1056/NEJMoa1406037
7. Robert C, Karaszewska B, Schachter J, et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med. 2015;372(1):30-39. doi:10.1056/NEJMoa1412690
8. Grob JJ, Amonkar MM, Karaszewska B, et al. Comparison of dabrafenib and trametinib combination therapy with vemurafenib monotherapy on health-related quality of life in patients with unresectable or metastatic cutaneous BRAF Val600-mutation-positive melanoma (COMBI-v): results of a phase 3, open-label, randomised trial. Lancet Oncol. 2015;16(13):1389-1398. doi:10.1016/S1470-2045(15)00087-X
9. Robert C, Grob JJ, Stroyakovskiy D, et al. Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med. 2019;381(7):626-636. doi:10.1056/NEJMoa1904059
10. Long GV, Hauschild A, Santinami M, et al. Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med. 2017;377(19):1813-1823. doi:10.1056/NEJMoa1708539
11. Schadendorf D, Hauschild A, Santinami M, et al. Patient-reported outcomes in patients with resected, high-risk melanoma with BRAFV600E or BRAFV600K mutations treated with adjuvant dabrafenib plus trametinib (COMBI-AD): a randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2019;20(5):701-710. doi:10.1016/S1470-2045(18)30940-9
12. Dummer R, Hauschild A, Santinami M, et al. Five-Year Analysis of Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. N Engl J Med. 2020;383(12):1139-1148. doi:10.1056/NEJMoa2005493
13. Long GV, Hauschild A, Santinami M, et al. Final Results for Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. N Engl J Med. Published online June 19, 2024. doi:10.1056/NEJMoa2404139
14. Long GV, Saw RPM, Lo S, et al. Neoadjuvant dabrafenib combined with trametinib for resectable, stage IIIB-C, BRAFV600 mutation-positive melanoma (NeoCombi): a single-arm, open-label, single-centre, phase 2 trial. Lancet Oncol. 2019;20(7):961-971. doi:10.1016/S1470-2045(19)30331-6
15. Amaria RN, Prieto PA, Tetzlaff MT, et al. Neoadjuvant plus adjuvant dabrafenib and trametinib versus standard of care in patients with high-risk, surgically resectable melanoma: a single-centre, open-label, randomised, phase 2 trial. Lancet Oncol. 2018;19(2):181-193. doi:10.1016/S1470-2045(18)30015-9
16. Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol. 2016;17(7):984-993. doi:10.1016/S1470-2045(16)30146-2
17. Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol. 2017;18(10):1307-1316. doi:10.1016/S1470-2045(17)30679-4
18. Fan Yun, et al. 2022 WCLC EP08.02-052 Safety and Efficacy of Dabrafenib Plus Trametinib in Chinese Patients With BRAF V600E- Mutation Positive Metastatic NSCLC. J Thorac Oncol. 2022;17(9):S423. doi.org/10.1016/j.jtho.2022.07.734
19. Salama AKS, Li S, Macrae ER, et al. Dabrafenib and Trametinib in Patients With Tumors With BRAFV600E Mutations: Results of the NCI-MATCH Trial Subprotocol H. J Clin Oncol. 2020;38(33):3895-3904. doi:10.1200/JCO.20.00762
20. Subbiah V, Lassen U, Élez E, et al. Dabrafenib plus trametinib in patients with BRAFV600E-mutated biliary tract cancer (ROAR): a phase 2, open-label, single-arm, multicentre basket trial. Lancet Oncol. 2020;21(9):1234-1243. doi:10.1016/S1470-2045(20)30321-1
21. Wen PY, Stein A, van den Bent M, et al. Dabrafenib plus trametinib in patients with BRAFV600E-mutant low-grade and high-grade glioma (ROAR): a multicentre, open-label, single-arm, phase 2, basket trial. Lancet Oncol. 2022;23(1):53-64. doi:10.1016/S1470-2045(21)00578-7
22. Subbiah V, Kreitman RJ, Wainberg ZA, et al. Dabrafenib plus trametinib in patients with BRAF V600E-mutant anaplastic thyroid cancer: updated analysis from the phase II ROAR basket study. Ann Oncol. 2022;33(4):406-415. doi:10.1016/j.annonc.2021.12.014
23. Kreitman R J, Moreau P, Hutchings M, et al. Treatment with combination of dabrafenib and trametinib in patients with recurrent/refractory BRAF V600E-mutated hairy cell leukemia (HCL)[J]. Blood, 2018, 132: 391.
24. Bouffet E, Hansford JR, Garrè ML, et al. Dabrafenib plus Trametinib in Pediatric Glioma with BRAF V600 Mutations. N Engl J Med. 2023;389(12):1108-1120. doi:10.1056/NEJMoa2303815
25. Hargrave DR, Terashima K, Hara J, et al. Phase II Trial of Dabrafenib Plus Trametinib in Relapsed/Refractory BRAF V600-Mutant Pediatric High-Grade Glioma. J Clin Oncol. 2023;41(33):5174-5183. doi:10.1200/JCO.23.00558
排版编辑:肿瘤资讯-Raffle











 苏公网安备32059002004080号
苏公网安备32059002004080号


