腹腔镜辅助全胃切除术和近端胃切除术(LATG 和LAPG)的安全性较高,故近期,日本一项研究对246名进行了LATG或LAPG的胃癌患者进行了长达5年的随访,以观察LATG或LAPG对不同分期的胃癌的治疗效果。
试验设计
招募了经组织学证实患有胃腺癌并根据日本胃癌分类第14 版诊断为临床 T1N0、T1N(+) 或T2N0肿瘤的患者。共246名患者,其中排除了1名注册错误的患者。另一名患者因ESD后穿孔接受胃切除术而被判定为不合格并被排除在安全性分析之外。故,总共244名患者被认定合格。
当肿瘤扩展限制在胃的上三分之一内,并且根治性切除后剩余的远端胃超过胃的一半时,可以进行LAPG。
淋巴结清扫的范围根据手术T分期和N分期确定。对cStage IA肿瘤进行D1或更广泛解剖,对cIb期肿瘤进行D2解剖。虽然脾切除术和滑囊切除术是不可接受的,但保留迷走神经的网膜和/或腹腔支是允许的。在需要全胃切除术的患者中进行 Roux-en-Y重建。对于需要近端胃切除术的患者,允许进行双束和空肠间置重建。迷你剖腹手术仅限于一个部位,皮肤切口的长度≤ 6 cm。当皮肤切口延长至>6厘米时,这种情况被视为转换为开放手术。如果术中发现肿瘤已为II期或更晚期,则将LATG或LAPG转为开放手术。
根据体表面积,建议将8个疗程的S-1口服辅助化疗,每日剂量为 80~120 mg/全身,持续 1 年,作为病理性II、IIIA或 IIIB期肿瘤患者的方案后治疗。每3~6个月进行一次随访评估,至少每年进行一次,至少持续5年。随访程序包括病史、体格检查、血常规检查、上消化道内窥镜检查以及腹部和盆腔计算机断层扫描。局部复发和远处转移经组织学或影像学证实。
终点事件
主要终点是食管空肠吻合口瘘患者的比例。次要终点是OS、RFS、完成LATGs或LAPGs的比例、转为开放手术的比例、不良事件(3~4级非血液学毒性)和短期临床结局,包括死亡率。
结果
195 例 (79.9%) 患者进行了 LATG,49 例 (20.1%) 患者进行了 LAPG。中位手术时间为309 min,中位出血量为30 mL,5例患者(2.0%)需要输血。195 例 (79.9%) 患者行 Roux-en-Y,45 例 (18.4%) 患者行双尿道行列。在这项研究中,完成LATG或LAPG的比例定义为所有接受手术治疗的 244 名接受LATG或LAPG而未转为开放手术的患者比例。此外,将转为开放手术的比例定义为242名在胃切除术前被诊断为 cStage IA 或 IB 疾病的患者的转换比例。在244 例患者中,有238例(97.5%;95% 置信区间 [CI] 94.7~99.1)成功完成了腹腔镜手术。LATG组和LAPG组的完成率分别为96.9%(95%CI 93.4~98.9)和100%(95%CI 92.8~100)。转为开放手术的患者比例为 1.7%(95% CI 0.5~4.2)(4/242:242 例cT1No和 cT1N(+) 患者)。LATG组和LAPG组转为开放手术的患者数分别为4/193(2.1%,0.6~5.2)和0/49(0%,0~7.3)。
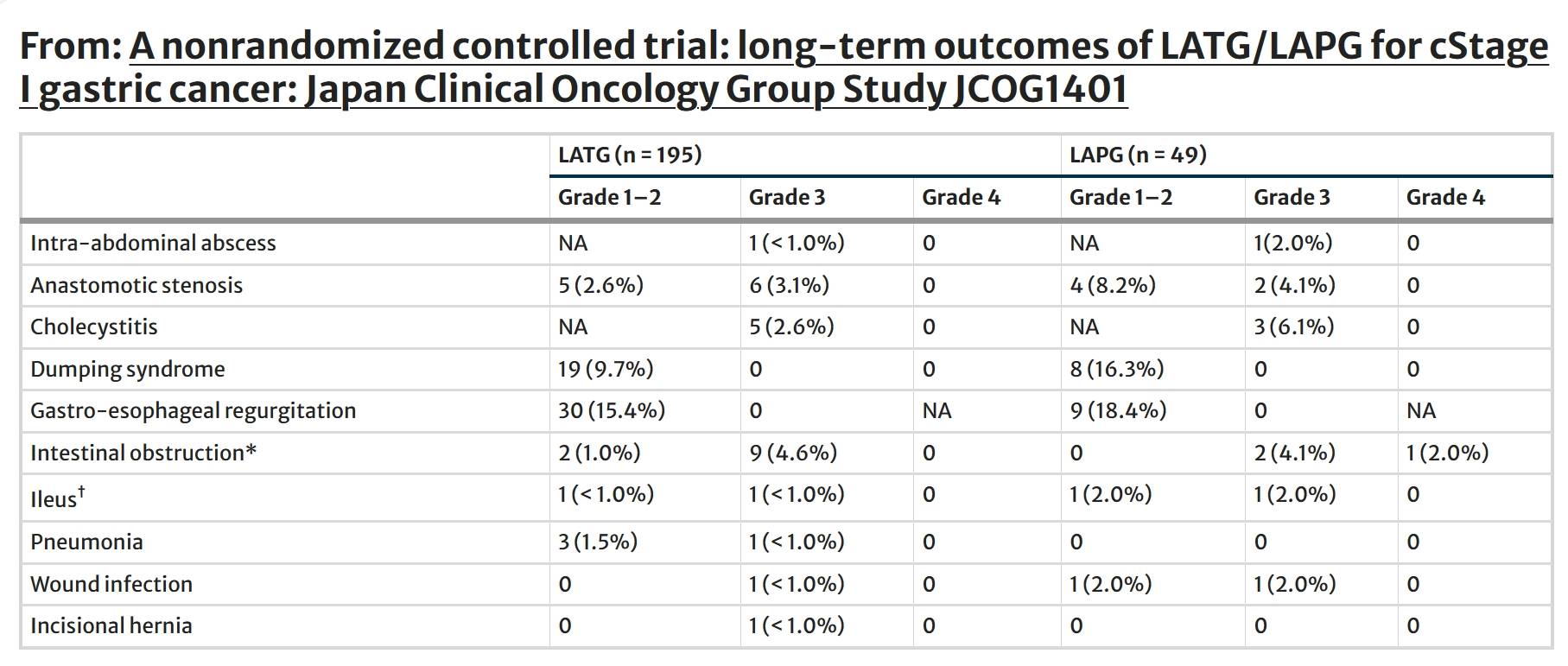
在随访期间,LATG和LAPG组最常观察到1-2级倾倒综合征和胃食管反流。12.7%(31/244)的患者检测到3级或4级术后晚期并发症。其中,肠梗阻在12例患者中最常见,胆囊炎和吻合口狭窄在8例患者中同样可见。在3级或4级肠梗阻患者中,2例3级肠梗阻患者和1例4级肠梗阻患者分别因绞窄而行粘连切开术和肠切除术。
表1 术后晚期并发症
在 244 例患者中,24 例接受了辅助化疗。其中,一名患者尽管病理分期为 IA 肿瘤,但仍接受了S-1。在这种情况下,由于病理性突出的静脉侵犯,患者强烈希望接受辅助化疗。在30例病理性II期肿瘤患者中,15例接受S-1治疗,1例接受FOLFOX治疗。在8例病理性III期肿瘤患者中,7例接受了S-1治疗。在接受 S-1 的 22 例患者中,16 例 (72.7%) 完成了辅助化疗。共有15例有辅助化疗指征的患者因自身意愿而拒绝。
在排除了在研究批准前被审查委员会错误注册的患者后,对 245 名患者进行了分析。随访期间,22例患者死亡,12例患者复发。在12例胃癌复发患者中,有7例死亡。在这 12 例患者中,有 3 例患有病理学 I 期早期胃癌。这3例患者均有肝转移复发。8例病理性II期胃癌复发患者中,6例为血行转移,其余2例为腹膜播散。在 12 例复发患者中,4 例接受了辅助化疗(3 例患者接受 S1 治疗,1 例接受 FOLFOX 治疗)。在接受辅助化疗的4例患者中,3例为病理性II期,1例为III期。
245例患者(所有入组患者)的5年RFS率为90.0%(95%CI 85.5~93.2%),5年OS率为91.2%(95%CI,86.9~94.2)。病理分期IA、IB、II.和III期肿瘤患者的5年RFS生存率分别为93.3%(95%CI 88.2~96.2%)、88.8%(95%CI 72.9~95.6%)、73.2%(95%CI 53.4~85.6%)和87.5%(95%CI 38.7~98.1%)。病理分期IA、IB、II.和III.期肿瘤患者的5年OS率分别为93.0%(95%CI 88.2~96.2%)、91.6%(95%CI 76.1~97.2%)、79.7%(95%CI 60.3~90.4%)和87.5%(95%CI 38.7-98.1%)。在所有符合条件的患者中,LATG和LAPG在RFS(90.0% [95%CI 84.8~93.5%]和89.9% [77.2~95.6%])和OS(91.0% [95%CI 85.9~94.3%]和91.8% [79.7~96.9%])方面无显著差异。
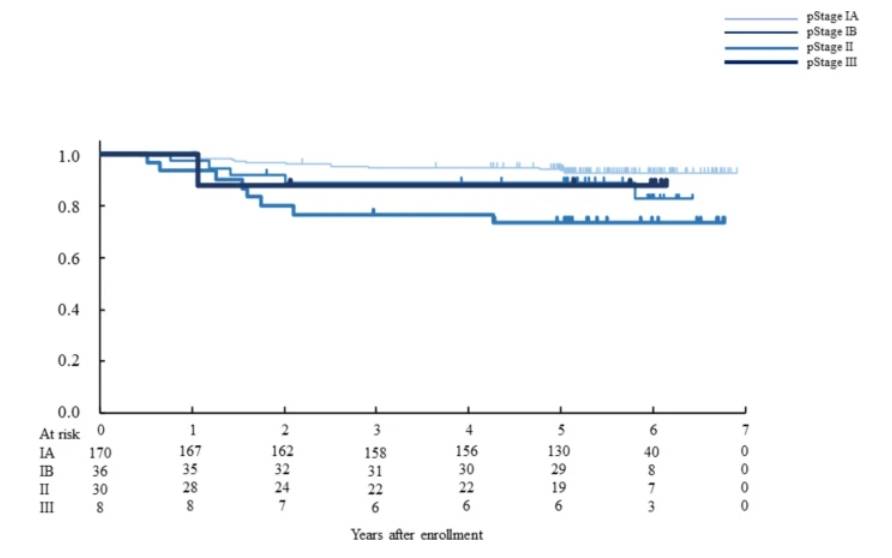
根据病理分期的无复发生存期。在所有符合条件的患者中,病理分期 IA、IB、II 和 III 期肿瘤患者的 5 年 RFS 生存率分别为 93.3%(95% CI 88.2~96.2%)、88.8%(95% CI 72.9~95.6%)、73.2%(95% CI 53.4~85.6%)和 87.5%(95% CI 38.7~98.1%)(此图)。pStage IA 和 II 之间存在显着差异 (p = 0.0018)
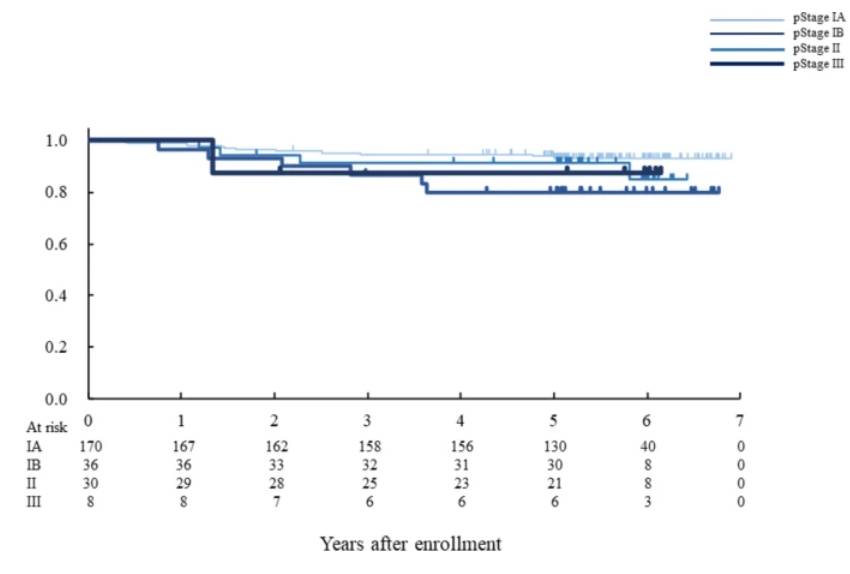
根据病理分期的总生存期。在所有符合条件的患者中,病理分期 IA、IB、II 和 III 期肿瘤患者的 5 年OS率分别为 93.0%(95% CI 88.2~96.2%)、91.6%(95% CI 76.1~97.2%)、79.7%(95% CI 60.3~90.4%)和 87.5%(95% CI 38.7~98.1%)。pStage IA 和 II 之间存在显着差异 (p = 0.0218)
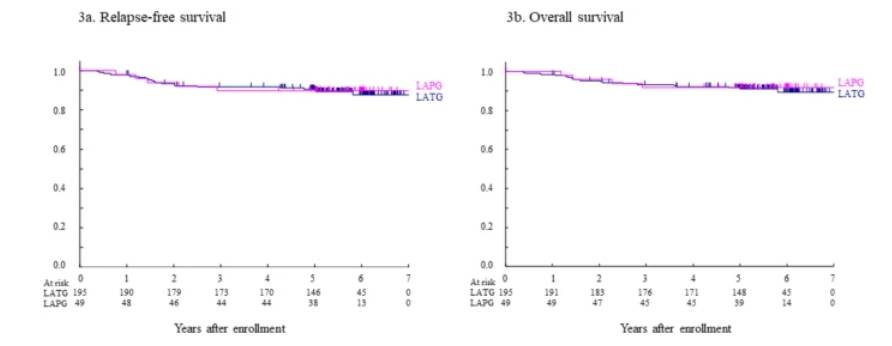
根据手术方法的无复发生存期 (a) 和总生存期 (b)。在所有符合条件的患者中,LATG 和 LAPG 的 RFS(90.0% (95% CI 84.8~93.5%) vs. 89.9% (77.2~95.6%),p = 0.8616)和 OS(91.0% (95% CI 85.9~94.3%) vs. 91.8% (79.7~96.9%),p = 0.7610)无显著差异
本研究表明,cStage I 期胃癌患者 LATG 和 LAPG 的长期结局和晚期术后并发症是可以接受的。本研究中 LATG 和 LAPG 的 5 年 OS 和 RFS 与之前研究的 OTG 和 OPG 相当。在本研究中,5年RFS率和OS率分别为90.0%和91.2%。在既往的一项研究中,胃上三分之一的病理性早期胃癌(pT1a/1b)患者OTG后的5年OS为94.6%[2]。该研究表明,无论病理性 I 期胃癌的手术方法(远端和全胃切除术)如何,两组之间的 OS 没有差异 (p = 0.893)。此外,先前使用倾向评分匹配分析的研究显示,根据病理分期,LATG 和 OTG 之间的 OS 没有显着差异(I 期,93% vs. 89.0%;II 期,85.8% vs. 77.5%;III 期,64.1% vs. 52.5%)。LATG组的5年OS率与本研究相当。同样,两组之间RFS差异无统计学意义(I.期,91.9% vs. 87.1%;II.期,73.1% vs. 73.5%;III期,45.9% vs. 48.6%)[3]。基于上述研究结果,我们可以综合假设本研究中 LATG 和 LAPG 的5年OS和RFS与OTG和 OPG 的5年OS和RFS兼容。
在本研究中,pStage III的RFS和OS比pStage II更有利。pStage II的5年OS为73.5%;本研究pStage II的OS并不比全国登记处差。pStage III 的人数仅为 8 名患者,无法得出任何预后良好的结论。此外,pStage III患者的数量太少,无法适当估计长期生存期。因此,在本研究中,比较pII期和III期之间的长期生存率具有挑战性。
本研究RFS和OS亚组分析显示,高龄、D2淋巴结清扫术和晚期病理N分期是cStage I人群常见的不良预后因素。既往一些研究也报道,无论肿瘤部位如何,高龄和病理N期都是早期胃癌的预后因素。 这两个变量通常被认为是 I 期胃癌的强预后因素。
结论
LATG和LAPG的长期结果是可以接受的,并且与之前的 OTG/OPG 结果相当,因此它被认为是 cStage I 近端胃癌的标准治疗方法之一。
1.Kunisaki C, Katai H, Sakuramoto S, Mizusawa J, Katayama H, Kadoya S, Yamada T, Kinoshita T, Yoshikawa T, Terashima M; Stomach Cancer Study Group of Japan Clinical Oncology Group. A nonrandomized controlled trial: long-term outcomes of LATG/LAPG for cStage I gastric cancer: Japan Clinical Oncology Group Study JCOG1401. Gastric Cancer. 2024 Jan;27(1):164-175. doi: 10.1007/s10120-023-01432-y. Epub 2023 Oct 25. PMID: 37875696.
2.Kinoshita T, Akimoto E, Yura M, Yoshida M. Survival outcomes of laparoscopic versus open total gastrectomy with nodal dissection for gastric cancer in a high-volume Japanese center: A propensity score-matched analysis. Ann Gastroenterol Surg. 2022 Jul 26;7(1):53-62. doi: 10.1002/ags3.12606. PMID: 36643368; PMCID: PMC9831884.
排版编辑:尹越越











 苏公网安备32059002004080号
苏公网安备32059002004080号


