2024年1月8日,国际知名期刊Nature Medicine全文刊登2期PANDA试验最新结果1。据悉,荷兰癌症研究所Myriam Chalabi担任该论文通讯作者。1月11日,欧洲内科肿瘤学会(ESMO)旗下平台ESMO Daily Reporter对PANDA试验内容进行重点报道2,强调新辅助阿替利珠单抗联合化疗使70%患者达到主要病理缓解(MPR),45%患者达到病理完全缓解(pCR)。重要的是,病理缓解与生存率显示出良好相关性,在中位随访47个月后,14例缓解的患者中13例未出现疾病复发。
免疫检查点抑制剂(ICI)进军围手术期治疗,治疗顺序仍待探索
胃/胃食管交界处(G/GEJ)肿瘤是癌症相关死亡的第四大常见原因,对于局部进展期G/GEJ腺癌患者而言,尽管围手术期化疗、放化疗可改善该类患者的生存,但其总体预后仍不佳,5年生存率不足50%。
FOLT4试验3证实,与当时的围手术期标准治疗ECF/ECX方案(表阿霉素+顺铂+5-氟尿嘧啶/卡培他滨)相比,围手术期FLOT方案(多西他赛+奥沙利铂+亚叶酸钙+5-氟尿嘧啶)可显著改善可切除性局部进展期G/GEJ腺癌患者的总生存期(OS:50个月vs.35个月)、无病生存期(DFS:30个月vs.18个月)。FLOT4-AIO试验4显示,与ECF/ECX方案相比,FLOT方案治疗的患者病理学完全缓解率(pCR)和临界完全缓解率更高,分别为16%vs.6%、21%vs.17%。
基于FLOT4试验和FLOT4-AIO试验,围手术期FLOT方案成为可切除局部进展期G/GEJ腺癌的标准治疗方案。
过去10年间,免疫检查点阻断(ICB)逐渐成为多种实体瘤的有效治疗手段。程序性死亡-受体-1/配体1(PD-1/L1)是经典的免疫检查点之一,根据既往数据,PD-L1在胃癌中表达水平上调,且PD-L1表达水平与胃癌患者的预后及生存呈负相关。
随机试验表明,与单纯化疗相比,晚期或转移性G/GEJ肿瘤患者接受抗PD-1/L1治疗联合化疗一线治疗的临床结局有所改善,许多相关治疗方案得以获批。KEYNOTE-0595、CheckMate 6496表明,相较其他PD-L1联合阳性评分(CPS)水平,PD-1/PD-L1单抗治疗在PD-L1 CPS为1-5的肿瘤患者中可发挥最大疗效,然而,随后CheckMate-5777试验表明,与安慰剂辅助治疗相比,Ⅱ-Ⅲ期G/GEJ肿瘤患者接受PD-1单抗辅助治疗后的DFS显著延长,无论PD-L1表达水平如何。
综上,抗PD-1/L1治疗在G/GEJ腺癌患者的确具有疗效,但其治疗获益与PD-L1表达水平之间尚无明确的相关性。决定抗PD-1/PD-L1治疗疗效的另有其他因素,预测性生物标志物亟待进一步探索。
新辅助ICB治疗在包括黑色素瘤、肺癌、膀胱癌和结直肠癌在内的多个肿瘤中显示出显著的病理学缓解疗效,同时肿瘤缓解与患者的生存率显著提高具有相关性。许多研究证实化疗联合ICB可增强其免疫活性作用,但如何排布化疗及免疫检查点抑制剂(ICI)的治疗顺序尚未存在定论。临床前实验表明,与同时/序贯抗PD-L1治疗相比,在化疗前给予抗PD-L1治疗,CD8+T细胞浸润(TCI)水平增加更明显,抗肿瘤反应有所提升。在一项早期三阴性乳腺癌相关Ⅱ期试验结果显示,在化疗前给予PD-1单抗治疗比在化疗同时联合PD-1单抗治疗的患者pCR更高。这些数据表明,化疗前进行PD-1单抗治疗可激活肿瘤免疫微环境(TME),从而增强抗肿瘤活性。
摒弃惯性思维:PANDA试验使用DOC化疗方案、调整治疗顺序
PANDA试验是一项在荷兰癌症研究所开展的单中心、开放标签、2期试验(NCT03448835),旨在探究新辅助PD-L1单抗阿替利珠单抗联合化疗(PD-L1单抗在前,化疗在后)治疗可切除局部进展期G/GEJ腺癌患者的安全性、有效性和免疫学相关性。作为一项探索性试验,该研究未进行正式的样本量计算,研究者预计纳入20例患者。这些患者接受一个周期的阿替利珠单抗单药治疗(1,200mg),随后接受四个周期的阿替利珠单抗(1,200mg)联合多西他赛(50mg/m2)+奥沙利铂(100mg/m2)+卡培他滨(850mg/m2)(DOC方案)治疗。在基线时、阿替利珠单抗单药治疗后、第一次联合治疗后经内镜检查获得肿瘤活检。最后一个治疗周期后6-9周行手术,从手术切除标本中获取病理组织。本研究的主要终点为安全性和可行性,次要终点包括经组织病理学退缩分级、TME变化和临床结局评估的疗效;病理学缓解定义为≤10%残留存活肿瘤(RVT),包括主要病理学缓解(MRP,≤10%RVT)和病理学完全缓解(pCR,0%RVT)。本试验的另一个重要终点为允许进行PD-L1抑制剂单药和PD-L1抑制剂随后联合化疗对于TME的影响,以及TME变化与临床反应的相关性。(注:临近病理学完全缓解/near-CR rates)定义为≥90%无存活肿瘤细胞)
患者基线特征
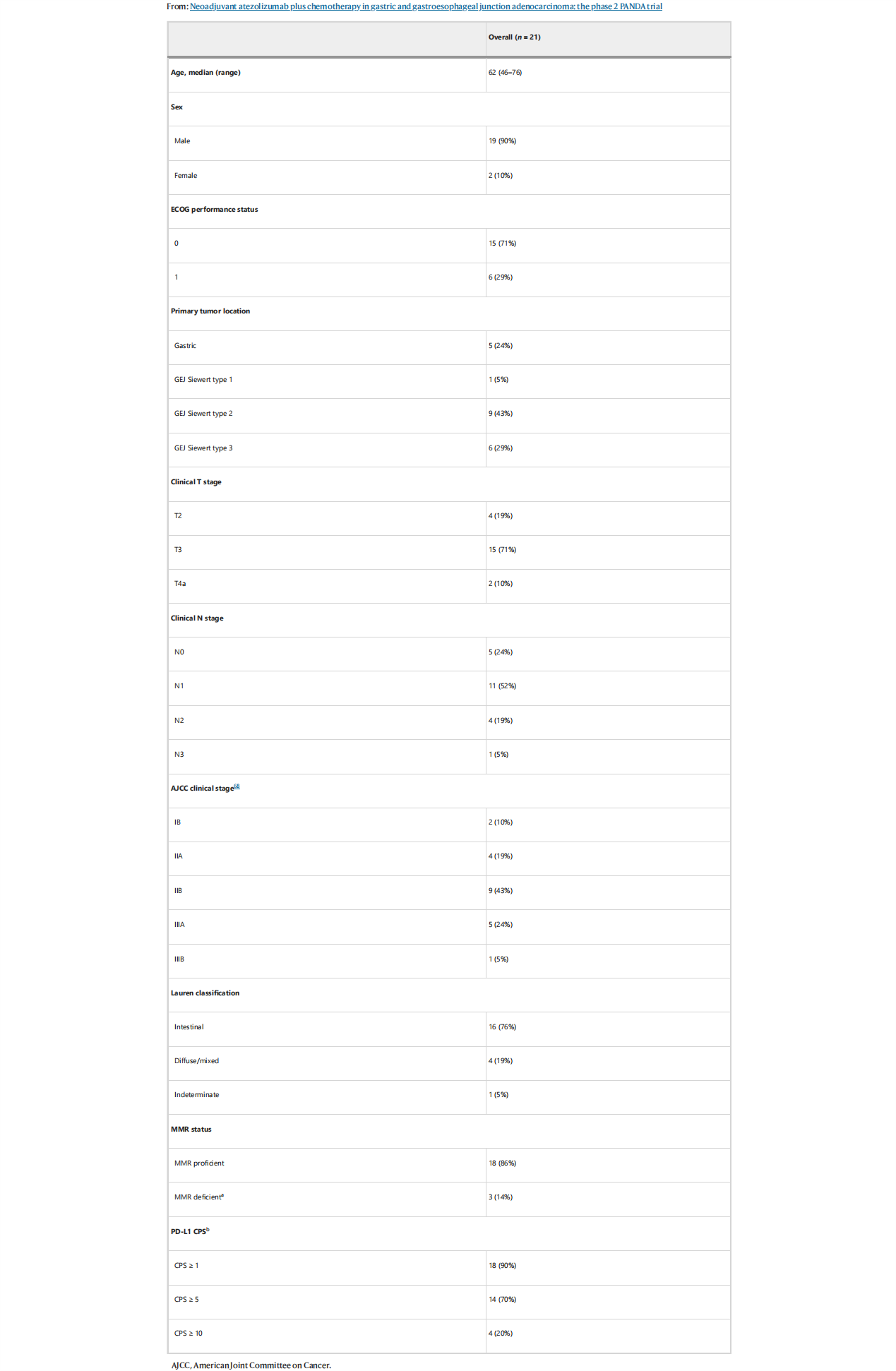
2018年4月12日至2021年5月14日,共有21例患者入组;患者中位年龄为62岁,21例患者中男性为19例(90%)。根据CT/FDG-PET CT扫描结合超声内镜对患者进行治疗前分期,21例患者中有17例(81%)cT3或cT4a,16例(76%)为cN+。3例为错配修复缺陷(dMMR),1例为EB病毒相关肿瘤(EBV+)。1例dMMR患者在在接受阿替利珠单抗单药治疗后不久死亡,死因为研究治疗无关的外部因素。最终,20例患者接受手术治疗,研究者在符合方案(PP)人群中评价主要及次要终点。
表1.患者基线特征
主要终点:安全性
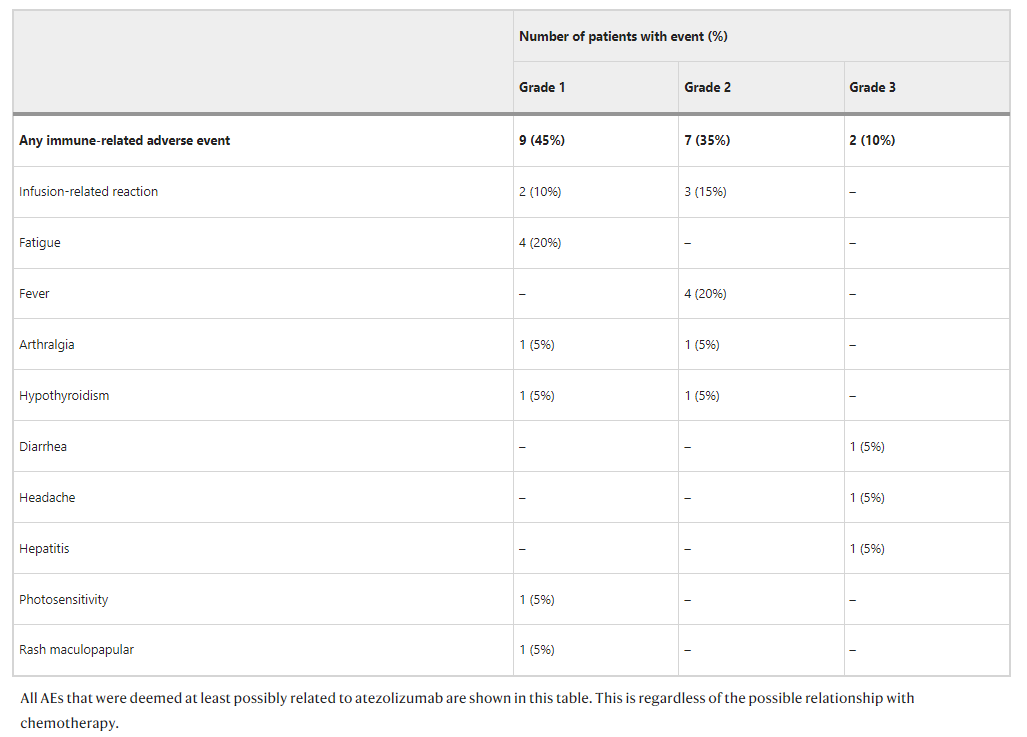
总体而言,该方案的耐受性良好,该研究达到了安全性和可行性的主要终点。20例患者中有11例(55%)发生任何级别的免疫相关不良事件(irAE),2例(10%)患者发生3类3及irAE(肝炎、头痛及腹泻)。未观察到4级或5级irAE。
1例患者因阿替利珠单抗单药治疗出现肝酶升高、头痛,怀疑为3级免疫相关性肝炎和脑膜炎,肝活检及脑脊液分析未能证实;使用高剂量类固醇和吗替麦考酚酯(MMF),上述AE完全缓解;患者停用阿替利珠单抗,并完成所有新辅助化疗。1例患者出现3级腹泻,支持治疗1周内症状完全缓解。1例患者未纳入PP人群,接受阿替利珠单抗单药治疗后出现3级衰弱,给予类固醇治疗;而后出现研究无关的死亡,AE随访中断。
20例患者均接受化疗。1例(5%)患者在80个周期(20例*四个周期)的1个(1%)周期中发生化疗剂量延迟,5例(25%)患者在80个周期的8个(10%)周期中减少剂量,2例(10%)患者在80个周期的3个(4%)周期中发生化疗药物豁免。4例(20%)患者中发生3级化疗相关AE,包括发热性中性粒细胞减少(15%)和腹泻(5%)。
表2.免疫相关不良事件
新辅助ICB联合化疗可带来高pCR
20例患者中有14例(70%)出现病理学缓解,均为MPR≤10%(肿瘤退缩分级/TRG 1或2),20例患者中有9例(45%)出现pCR(TRG 1)。18例错配修复完整(pMMR)肿瘤患者中有12例(67%)达到MPR,其中,7例(39%)为pCR。2例接受手术的dMMR肿瘤患者均达到pCR。2例HER-2阳性肿瘤患者的pCR和MPR均为1%RVT。1例患者原发肿瘤达到pCR,但淋巴结RVT<1%,因此被认为是MPR。值得注意的是,pCR并不局限于治疗前Ⅰ期和ⅡA期的患者,ⅡB、ⅢA甚至ⅢB期肿瘤患者中亦观察到pCR。
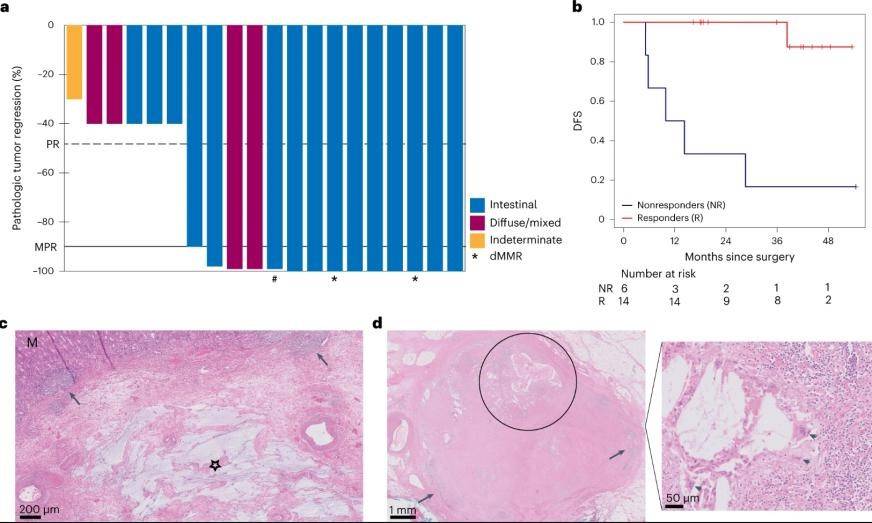
图1.新辅助ICB联合化疗的病理学结果
病理学缓解与结局的相关性
在本试验中,患者接受新辅助治疗后的临床结局与病理学缓解(次要终点)具有强相关性:相较于未缓解的患者,肿瘤缓解患者的DFS(P=0.0001)、OS(P=0.0006)明显延长。截止2023年4月24日,中位随访时间为47个月,14例pCR或MRP患者中有13例(93%)为无病生存。相比之下,6例未缓解患者中仅1例(16%)为无病生存,5例(83%)出现疾病复发。本试验未达到中位DFS终点,3年时的DFS为73%。未缓解的患者在术后中位随访10个月时出现疾病复发,其至死亡的复发后中位生存期为10个月。
循环肿瘤DNA(ctDNA)与缓解、DFS相关
基线时,20例患者中17例(85%)各肿瘤分期的患者可检测到ctDNA,其中,18例患者中17例(94.4%)为Ⅱ期及以上肿瘤。研究者在阿替利珠单抗单药治疗后、手术前、手术后(分子残留病灶/MRD)和随访期间的ctDNA状态进行了分析,ctDNA阳性率分别为75%(15/20例)、15%(3/20例)、10.5%(2/20例)和15%(3/20)。
在所有新辅助治疗周期后和手术前,11例肿瘤缓解的患者均达到ctDNA清除,6例未缓解的患者中3例仍为ctDNA阳性(P=0.029)。此外,未缓解的患者的ctDNA水平显著高于缓解的患者(P=0.0065)。这些数据表明,ctDNA与新辅助治疗的病理学缓解结果之间存在相关性。尽管术前时间点的ctDNA阳性/未清除与较差的DFS相关,但相关性并不显著,可能原因为样本量较小。当同时考虑病理学缓解、术前ctDNA状态时,ctDNA阳性的未缓解的患者比达到pCR的ctDNA阴性患者具有更高的复发风险。此外,MRD、各个随访时间点的ctDNA阳性与复发率100%具有相关性。
研究解读,利弊兼有
本试验证实了新辅助阿替利珠单抗联合化疗在G/GEJ腺癌中具有抗肿瘤活性,且安全性良好,70%患者达到MPR,45%患者达到pCR。同时,病理学缓解与生存率具有良好的相关性,在中位随访47个月后,14例缓解的患者中有13例未见疾病复发,而6例未缓解的患者中有5例出现复发并死亡。
在研究结果方面,首先,相较于先前的其他试验,本试验证实G/GEJ腺癌患者接受新辅助DOC化疗方案/放化疗(放疗联合DOC方案)的缓解与临床结局具有更明显的相关性,且对于接受新辅助免疫联合化疗治疗的G/GEJ腺癌患者而言,其与非小细胞肺癌、黑色素瘤、结肠癌、膀胱癌接受相同方案的疗效类似。其次,与先前的结直肠癌、胃食管癌相关研究一致的是,研究者观察到ctDNA与复发风险之间具有相关性;术前ctDNA状态与病理学缓解相关,这一结论突出ctDNA具有潜在的临床价值。
与既往研究进行比对时,本试验观察到患者的3年复发率为27%,而在FLOT4试验3中,患者接受FLOT方案后的预期3年复发率为50%。DANTE研究8的最新数据显示,患者接受围手术期FLOT方案联合或不联合阿替利珠单抗的pCR分别为24%vs.15%。3期MATTERHORN试验9中,围手术期FLOT方案联合PD-1单抗治疗患者的pCR和临近CR分别为19%和27%,而仅接受FLOT方案的患者pCR和临近CR分别为7%和14%。在ICONIC研究中,患者接受围手术期FLOT方案联合PD-L1单抗的MPR和pCR分别为21%和15%,但由于该试验提前终止,故预设的25%pCR不太可能实现。
该试验的局限性在于样本量较小、试验设计为单臂,由此导致该试验的概念验证性质。总而言之,PANDA试验证实,新辅助阿替利珠单抗联合化疗治疗G/GEJ腺癌患者表现出高pCR和优异的生存获益数据,这一结论值得未来在随机对照试验中加以验证。此外,根据阿替利珠单抗导致的TME显著变化,研究者认为在第一个周期内选择性豁免化疗可能与高缓解率具有相关性,但仍需进一步探讨。
1. Verschoor, Y. L. et al. Neoadjuvant atezolizumab plus chemotherapy in gastric and gastroesophageal junction adenocarcinoma: the phase 2 PANDA trial. Nat Med 1–12 (2024) doi:10.1038/s41591-023-02758-x.
2. ESMO. Neoadjuvant Atezolizumab Plus Chemotherapy Is Safe and Has Promising Activity in Patients with Gastric and Gastro-oesophageal Junction Adenocarcinoma. https://www.esmo.org/oncology-news/neoadjuvant-atezolizumab-plus-chemotherapy-is-safe-and-has-promising-activity-in-patients-with-gastric-and-gastro-oesophageal-junction-adenocarcinoma.
3. Al-Batran, S.-E. et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. The Lancet 393, 1948–1957 (2019).
4. Al-Batran, S.-E. et al. Histopathological regression after neoadjuvant docetaxel, oxaliplatin, fluorouracil, and leucovorin versus epirubicin, cisplatin, and fluorouracil or capecitabine in patients with resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4-AIO): results from the phase 2 part of a multicentre, open-label, randomised phase 2/3 trial. The Lancet Oncology 17, 1697–1708 (2016).
5. Pembrolizumab alone or in combination with chemotherapy as first-line therapy for patients with advanced gastric or gastroesophageal junction adenocarcinoma: results from the phase II nonrandomized KEYNOTE-059 study | Gastric Cancer. https://link.springer.com/article/10.1007/s10120-018-00909-5.
6. Janjigian, Y. Y. et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. The Lancet 398, 27–40 (2021).
7. Kelly, R. J. et al. Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. New England Journal of Medicine 384, 1191–1203 (2021).
8. Lorenzen, S. et al. Perioperative Atezolizumab Plus Fluorouracil, Leucovorin, Oxaliplatin, and Docetaxel for Resectable Esophagogastric Cancer: Interim Results From the Randomized, Multicenter, Phase II/III DANTE/IKF-s633 Trial. JCO JCO.23.00975 (2023) doi:10.1200/JCO.23.00975.
9. Janjigian, Y. Y. et al. LBA73 Pathological complete response (pCR) to durvalumab plus 5-fluorouracil, leucovorin, oxaliplatin and docetaxel (FLOT) in resectable gastric and gastroesophageal junction cancer (GC/GEJC): Interim results of the global, phase III MATTERHORN study. Annals of Oncology 34, S1315–S1316 (2023).
排版编辑:肿瘤资讯-胡一帆











 苏公网安备32059002004080号
苏公网安备32059002004080号


