鉴于靶向治疗在晚期肺癌领域的成功,靶向治疗正逐步向新辅助治疗进一步推进。 阿来替尼已被推荐用于晚期间变性淋巴瘤激酶(ALK)+非小细胞肺癌(NSCLC)的一线治疗。迄今为止,阿来替尼新辅助治疗仅在少数ALK重排的局部晚期肺腺癌病例中有所报道。Anticancer Drugs报告了两例新辅助阿来替尼治疗伴有ALK重排的局部晚期肺腺癌的病例[1]。新辅助阿来替尼可能适用于局部晚期疾病的完全切除。阿来替尼新辅助治疗的持续时间和安全性仍需进一步研究。
背景
新辅助化疗使可手术局部晚期NSCLC的5年无复发生存率提高了5%[2]。鉴于靶向治疗在晚期肺癌领域的成功,靶向治疗逐渐被推向辅助治疗甚至新辅助治疗。ALK是晚期NSCLC的重要治疗靶点。ALK融合突变占NSCLC的2%-7%,其融合伴侣主要是棘皮动物微管相关蛋白4(EML4)[3]。ALK-酪氨酸激酶抑制剂(TKI)在ALK融合NSCLC患者围手术期治疗中的探索非常值得期待。与克唑替尼相比,第二代TKI阿来替尼在晚期ALK+NSCLC患者的治疗管理中具有巨大的里程碑意义[4]。目前,有关阿来替尼在新辅助治疗中的疗效和安全性的报道很少[5-7]。在此,研究者报告了两例新辅助阿来替尼治疗伴有ALK重排的局部晚期肺腺癌的疗效和安全性,并回顾了相关文献。
病例1
64岁男性,无吸烟史,因咳嗽2个月,加重伴血痰就诊。胸部CT检查显示右下肺肿块伴右肺门和纵膈淋巴结肿大,伴同侧上肺结节(图1a-c)。纤维支气管镜检查显示右肺下叶的基底段和背段有肿瘤。苏木精-伊红和免疫组织化学显示低分化癌(图2a,B),细胞角蛋白7(CK7)、NapsinA和甲状腺转录因子-1(TTF-1)阳性(图3a-c)。还通过单克隆抗体(D5F3,Ventana-Roche Diagnostics,曼海姆,德国)的免疫组织化学评估ALK融合状态为阳性(图3d)。脑增强MRI未见颅内转移。PET-CT显示右下肺肿块,右肺门和纵隔淋巴结肿大,18F-氟代脱氧葡萄糖摄取活性升高。综合病理和影像学评估证实为IIIB期(cT3N2M0)。经包括呼吸科、胸外科、放疗科和病理科的多学科小组(MDT)讨论并征得患者同意后,给予阿来替尼600mg,每日两次。
用药后44天,患者出现呼吸困难明显加重。随后进行胸部增强CT,显示右肺肿瘤明显消退,根据实体瘤疗效评价标准(RECIST)第1.1版,肿瘤达到部分缓解(PR),然而,两个肺发生间质性肺炎,主要特征是快速和双侧广泛的毛玻璃样阴影(GGO)(图1d-f)。在迅速排除微生物感染后,确定了药物诱导的间质性肺病。MDT团队再次讨论病情后,立即因3级肺炎暂停阿来替尼治疗。甲泼尼龙240mg/d,连用3d,后减为80mg/d,连用3d。还需要在包含高流量氧疗的呼吸ICU病房进行密切的病情监测。甲泼尼龙治疗6天后,通过重复胸部CT扫描可以看到间质性肺炎显著改善(图1g-i)。继续口服泼尼松20 mg/天2周后,MDT再次讨论患者病情,并达成共识,同意行胸腔镜下右下叶切除术并淋巴结清扫术。由于右肺下叶动脉背段分支与背段支气管粘连,术中发生出血。总失血量约600 ml,但未输血。病理学评价提示肺泡上皮和细支气管增生,以间质纤维组织增生为标志,伴多发组织细胞和淋巴细胞浸润,符合靶向治疗改变(图2c、d)。即使在广泛的提取后也没有发现残留的肿瘤组织。在清扫的淋巴结中也未观察到肿瘤成分。病理学评估为病理学完全缓解(pCR)。鉴于使用阿来替尼后出现的不良事件,该患者术后至今接受塞瑞替尼辅助治疗。
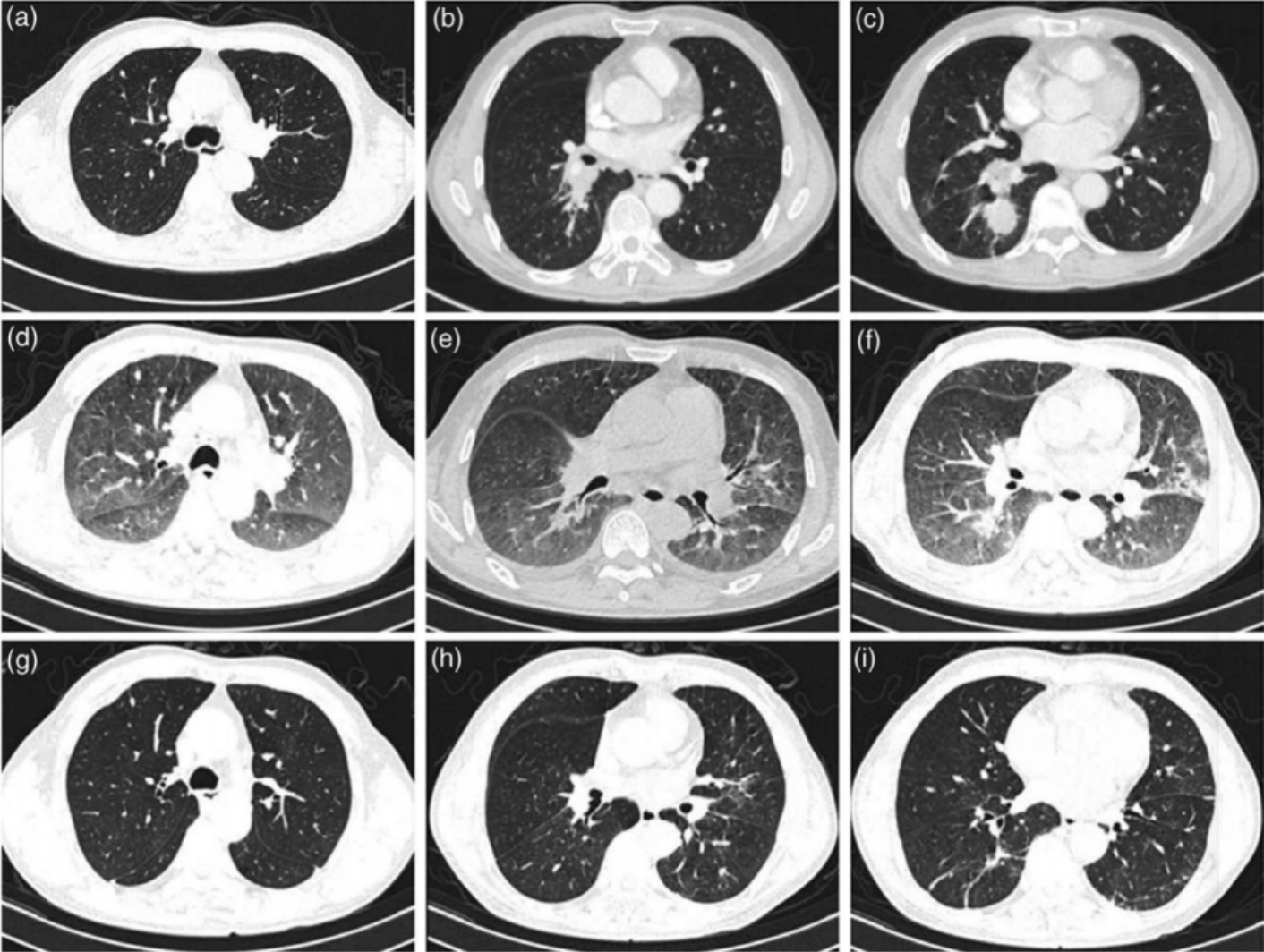 图1. 病例1的CT肺窗
图1. 病例1的CT肺窗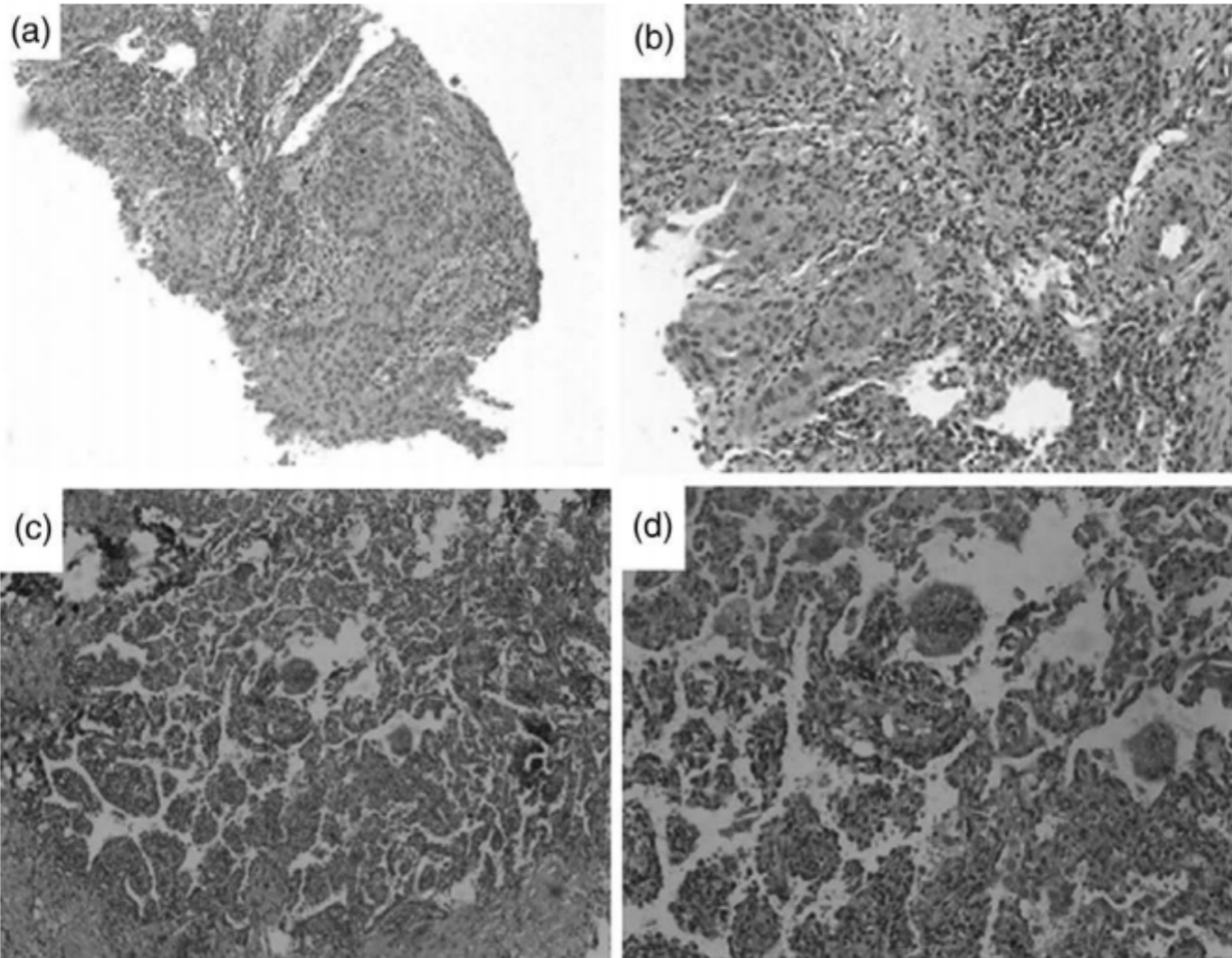 图2. 病例1的纤维支气管镜(a,b)和胸腔镜肺叶切除术(c,d)标本的HE染色
图2. 病例1的纤维支气管镜(a,b)和胸腔镜肺叶切除术(c,d)标本的HE染色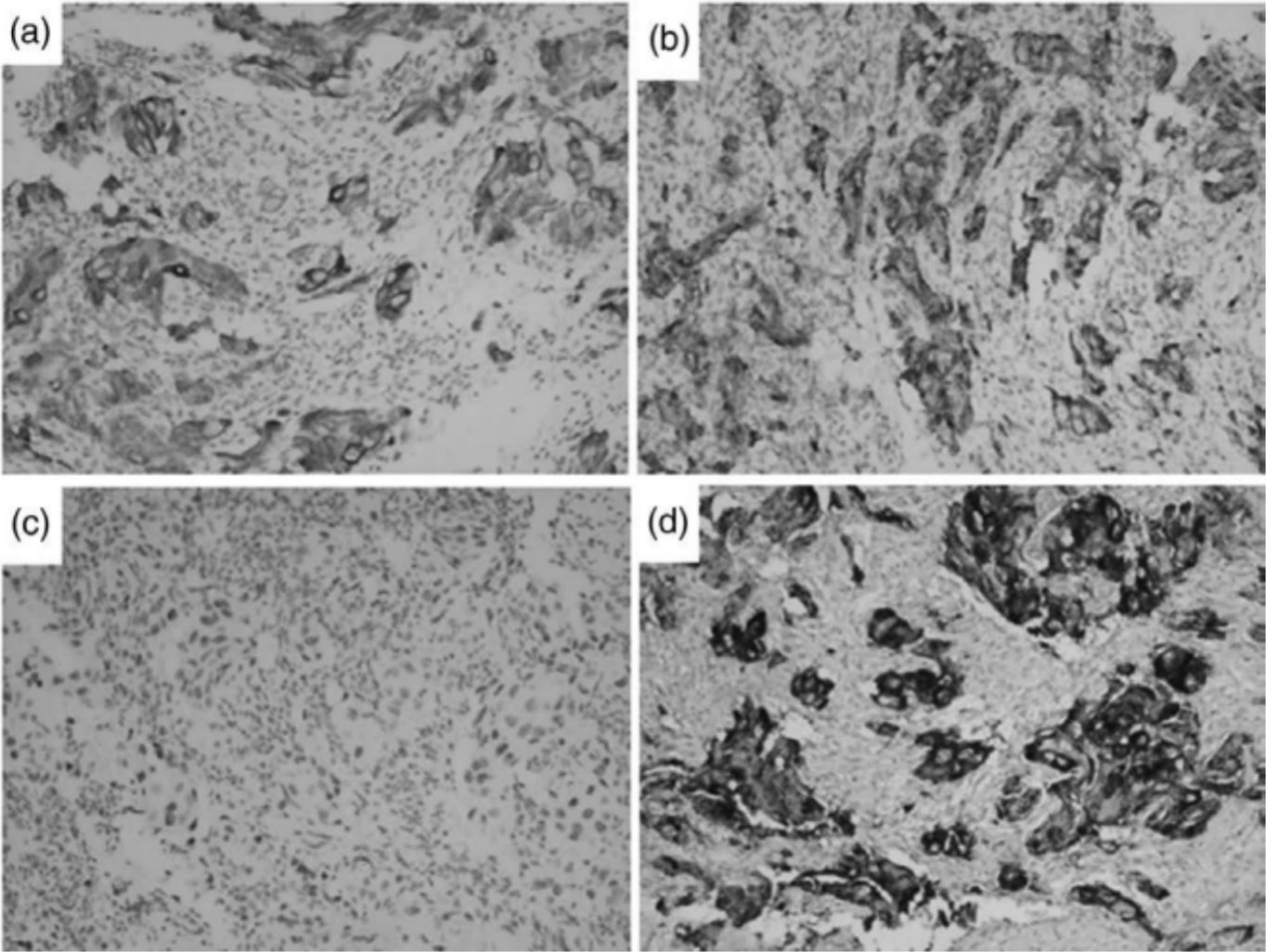 图3. 病例1的免疫组化(IHC)标本
图3. 病例1的免疫组化(IHC)标本
病例2
66岁男性,有10包年吸烟史,因双腿肿胀接受常规体检。胸部CT扫描示右上肺门附近占位性病变,右肺门及纵隔多发肿大淋巴结(图4a-c)。因纤维支气管镜检查未见明显异常,故对肺门附近占位性病变行CT引导下经皮穿刺活检(PCNB)。病理学评价提示低分化腺癌(图5a、图B),免疫组织化学染色显示CK7和TTF-1阳性(图5c、图5d)。进一步腹部增强CT、头部磁共振增强和骨扫描显示无远处转移,分期为IIIB(cT4N2M0)。对术后组织的石蜡切片进行处理,用于二代测序(NGS)。在等待NGS结果期间,进行了1个周期的培美曲塞(700 mg)联合奈达铂(100 mg)化疗。NGS检测结果显示存在EML4-ALK融合突变。随后,患者从2021年3月12日开始接受阿来替尼600mg新辅助治疗,每日两次。2021年6月18日胸部增强CT示右肺门占位明显回缩(图4d-f),评价PR,患者未见不良反应。患者接受阿来替尼治疗109天后(2021年3月12日-2021年6月29日),行胸腔镜右肺上叶切除术及淋巴结活检,术中出血少。病理评估提示浸润性肺腺癌(残留多灶性分布,最大直径5mm),周围广泛凝固性坏死,间质大量组织细胞反应,胆固醇结晶沉积,多核巨细胞反应(图5e,f)。支气管边缘及淋巴结未见转移。病理学评估结果为主要病理学缓解(MPR)。术后患者继续服用阿来替尼。
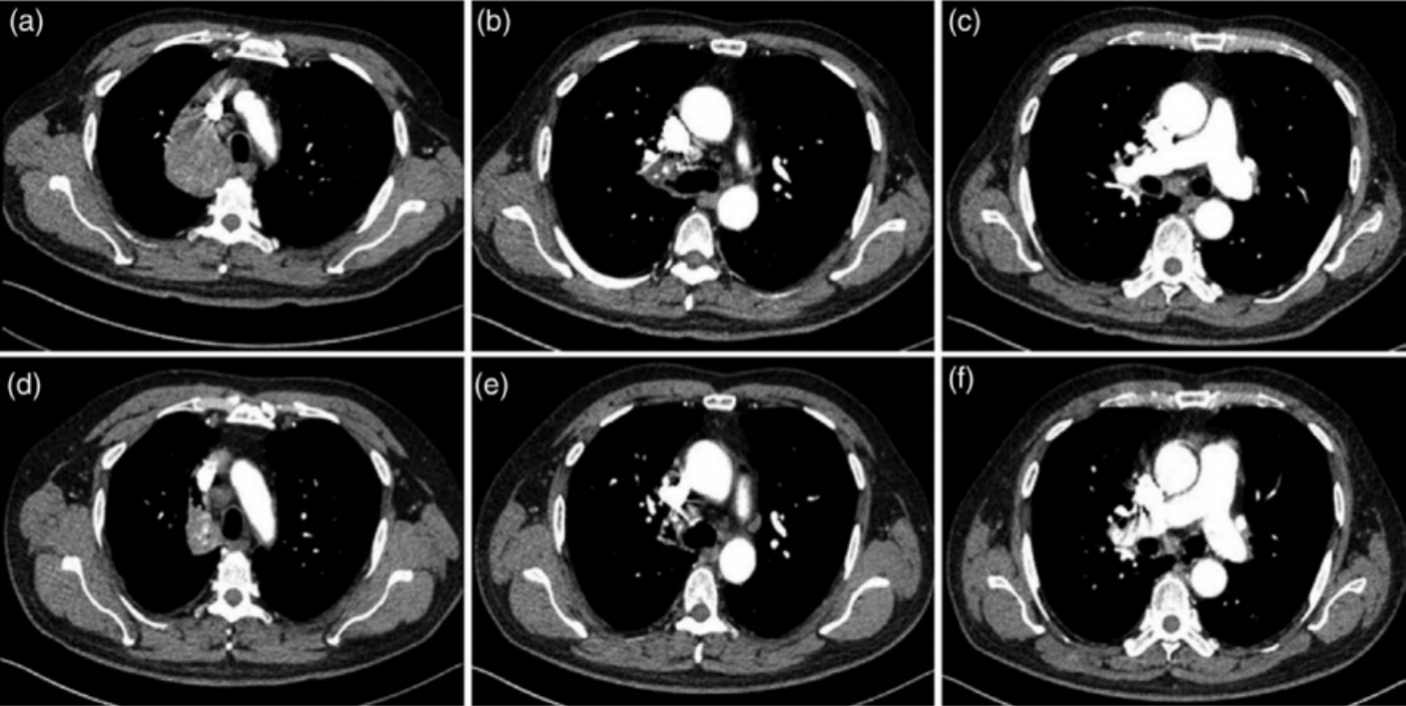 图4. 病例2的CT纵膈窗
图4. 病例2的CT纵膈窗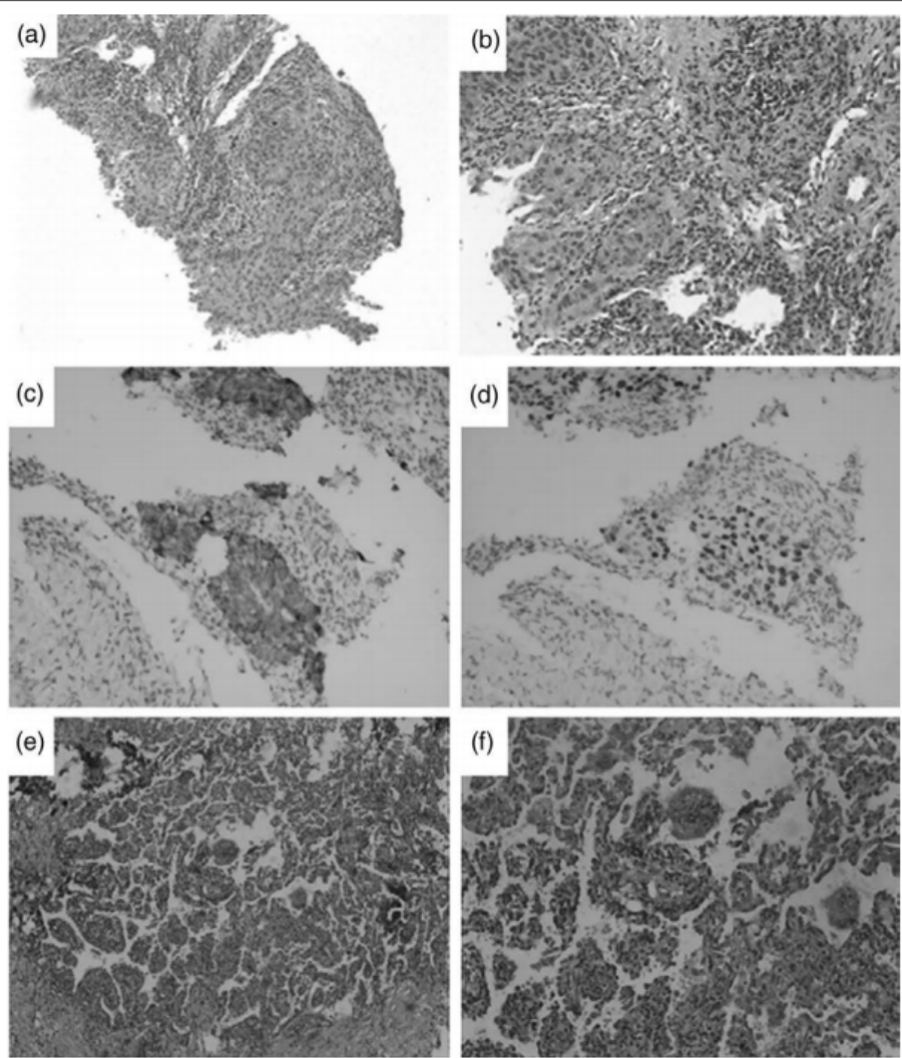 图5. 病例2经皮穿刺活检(PCNB)标本的HE染色(a,b),免疫组化染色(c,d)和胸腔镜下肺叶切除术标本(e,f)
图5. 病例2经皮穿刺活检(PCNB)标本的HE染色(a,b),免疫组化染色(c,d)和胸腔镜下肺叶切除术标本(e,f)
讨论
我们在此报告了两例ALK阳性患者使用阿来替尼进行新辅助治疗的病例。虽然第一例患者出现了3级治疗相关不良反应,但两例患者均成功接受了手术。更引人注目的是,在接受阿来替尼新辅助疗法后出现间质性肺炎的患者,在病理评估中达到了完全缓解,而第二例患者接受了更长时间的新辅助治疗,没有出现治疗相关不良反应,但获得了MPR。结合这两个病例的病历和之前的报道[5-7],新辅助阿来替尼治疗在临床上是可行的。
Ⅲ期NSCLC是一种异质性较高的肿瘤,临床表现多样。目前,尚无统一的治疗方案。ALK-TKI作为新辅助疗法在ALK阳性癌症中的应用尚不明确。表皮生长因子受体(EGFR)-TKI新辅助治疗的结果为ALK阳性局部晚期NSCLC患者提供了参考。虽然克唑替尼用于ALK阳性可切除NSCLC的新辅助治疗可能可行且耐受性良好,但一项研究的最新结果显示孤立性脑结节的发生率较高[8]。2022年世界肺癌大会(WCLC)公布了NAUTIKA1研究中ALK阳性NSCLC患者阿来替尼新辅助治疗队列的数据,结果显示完成阿来替尼新辅助治疗的5例患者R0切除率为100%,无延误和严重手术并发症[9]。探索阿来替尼在Ⅲ期ALK阳性NSCLC患者新辅助联合辅助治疗中应用的ALNEO研究显示,1例患者在接受阿来替尼新辅助治疗后达到了影像学PR。病理评估显示该患者达到了MPR,且患者耐受性良好[10]。我们报告中的两名患者接受了不同时间段的阿来替尼新辅助治疗,根据影像学评估达到了PR,并成功接受了手术。
在NAUTIKA1研究和ALNEO研究中,阿来替尼的新辅助治疗时间均为8周。尽管上述临床研究和病例报告显示,阿来替尼8周的新辅助治疗可能具有良好的耐受性,但也有报告显示,在晚期NSCLC中,阿来替尼介导的间质性肺炎最早在治疗开始后33天发生,最晚在治疗开始后12个月发生[11]。国际ALEX试验和18项研究的荟萃分析发现,接受阿来替尼治疗的患者DI-ILD发生率(0.7% vs 3.3%,1.62% vs 2.68%)低于接受克唑替尼治疗的患者[12,13]。组织粘连是靶向新辅助治疗的另一个常见问题。Yue等[7]的病例报告显示,阿来替尼新辅助治疗45天后,由于严重的组织粘连导致的高手术风险,没有进行第4R组纵隔淋巴结切除术。在Zhang等发表的病例中[6],在中度组织粘连的情况下成功进行了肺叶切除和全身淋巴结切除,在两个周期的阿来替尼治疗后,仅有7%的残存肿瘤细胞存活,实现了MPR。在我们的报告中,尽管阿来替尼的治疗时间较短,但第一例患者出现了间质性肺炎,属于3级药物相关不良反应,而第二例患者阿来替尼的治疗时间较长,未出现任何不良反应。同样,在手术过程中,第一名患者明显发现了组织粘连,但第二名患者却没有发现。此外,更有趣的是,虽然第一例患者接受新辅助治疗的时间较短,但病理评估结果为pCR,而第二例患者接受新辅助治疗的时间较长,病理评估结果为 MPR。
结论
我们报告了两例阿来替尼用于新辅助治疗的病例,以评估其疗效和安全性。在局部晚期疾病中,新辅助阿来替尼可能是可行的,可以实现完全切除。对于ALK阳性的III期NSCLC,阿来替尼新辅助治疗的疗程和安全性仍需进一步研究。
1. Wang Z, Wu R, Li C, Cheng K, Di Y, Lv T, Liu H, Song Y. Neoadjuvant alectinib in locally advanced lung adenocarcinoma with anaplastic lymphoma kinase rearrangement: case series and literature review. Anticancer Drugs. 2023 Nov 1;34(10):1069-1075. doi: 10.1097/CAD.0000000000001507.
2. Anon. Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet 2014; 383:1561–1571.
3. Soda M, Choi YL, Enomoto M, Takada S, Yamashita Y, Ishikawa S, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature 2007; 448:561–566.
4. Peters S, Camidge DR, Shaw AT, Gadgeel S, Ahn JS, Kim D-W, et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med 2017; 377:829–838.
5. Gu R, Shi Z, Duan T, Song M. Feasibility and safety of neoadjuvant alectinib in pulmonary invasive mucinous adenocarcinoma with ALK rearrangement: case report and literature review. Onco Targets Ther 2021; 14:5107–5113.
6. Zhang C, Yan LX, Jiang BY, Wu YL, Zhong WZ. Feasibility and safety of neoadjuvant alectinib in a patient with ALK-positive locally advanced NSCLC. J Thorac Oncol 2020; 15:e95–e99.
7. Yue P, Zhang S, Zhou L, Xiang J, Zhao S, Chen X, et al. Perioperative alectinib in a patient with locally advanced anaplastic lymphoma kinase positive non-small cell lung cancer (NSCLC): a case report. Transl Cancer Res 2021; 10:3856–3863.
8. Zhang C, Li SL, Nie Q, Dong S, Shao Y, Yang XN, et al. Neoadjuvant crizotinib in resectable locally advanced non-small cell lung cancer with ALK rearrangement. J Thorac Oncol 2019; 14:726–731.
9. Lee J, Sepesi B, Toloza EM, Lin J, Pass HI, Johnson BE, et al. EP02. 04-005 Phase II NAUTIKA1 study of targeted therapies in stage II-III NSCLC: preliminary data of neoadjuvant alectinib for ALK+ NSCLC. J Thorac Oncol 2022; 17:S233–S234.
10. Leonetti A, Minari R, Boni L,et al. Phase II, open-label, single-arm, multicenter study to assess the activity and safety of alectinib as neoadjuvant treatment in surgically resectable stage III ALK positive NSCLC: ALNEO trial. Clin Lung Cancer 2021; 22:473–477.
11. Myall NJ, Lei AQ, Wakelee HA. Safety of lorlatinib following alectinibinduced pneumonitis in two patients with ALK-rearranged non-small cell lung cancer: a case series. Transl Lung Cancer Res 2021; 10:487–495.
12. Camidge DR, Dziadziuszko R, Peters S, Mok T, Noe J, Nowicka M, et al. Updated efficacy and safety data and impact of the EML4-ALK fusion variant on the efficacy of alectinib in untreated ALK-positive advanced nonsmall cell lung cancer in the global phase III ALEX study. J Thorac Oncol 2019; 14:1233–1243.
13. Suh CH, Kim KW, Pyo J, Hatabu H, Nishino M. The incidence of ALK inhibitor-related pneumonitis in advanced non-small-cell lung cancer patients: a systematic review and meta-analysis. Lung Cancer 2019; 132:79–86.
排版编辑:肿瘤资讯-olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


