伴有间变性淋巴瘤激酶(ALK)重排的非小细胞肺癌(NSCLC)对ALK抑制剂有良好的反应。然而,ALK融合突变携带约90种不同的融合伴侣。不同ALK融合的患者可能对不同代的ALK抑制剂有不同的反应。
Frontiers in Oncology报告了一例”对阿来替尼治疗敏感的新型PPFIA1-ALK、ALK-C2orf91(基因间)双融合晚期肺腺癌患者”[1],扩展了ALK阳性NSCLC中的ALK融合伴侣谱,具有重要的临床参考价值。
ALK基因重排是NSCLC中最重要的驱动基因突变之一,发生率为3%-7%[2]。棘皮动物微管相关蛋白样4(EML4)-ALK是最常见的融合变体,占融合伴侣的80%以上。随着二代DNA测序覆盖范围的不断扩大,在NSCLC中发现了90多种罕见的ALK融合亚型,如驱动蛋白家族成员5B(KIF5B)-ALK和纹状体蛋白基因(STRN)-ALK[3]。第一代至第三代ALK酪氨酸激酶抑制剂(TKI),包括克唑替尼、阿来替尼和塞瑞替尼,已为患者带来了显著的疗效和耐受性[4-6]。但对于新发现的融合变体,尤其是缺失EML4-ALK融合突变的变异,有必要评估ALK-TKI在一线甚至是后线治疗中的临床疗效,有助于在面对多样化的罕见融合靶点时,推断可能的新治疗措施。在本研究中,一例患有PPFIA1-ALK和ALK-C2orf91(基因间)双融合变异的晚期肺腺癌患者对一线阿来替尼治疗敏感。
病例展示
一名46岁的不吸烟中国男性,无遗传病家族史,2022年6月因咳嗽1个多月,气促约10天到另一家医院就诊。CT显示液气胸、压迫性肺不张(约80%塌陷)和右肺肿块,以及左肺多发结节(图1A)。患者接受胸腔引流,在胸腔积液中发现恶性细胞。随后,患者来我院接受进一步治疗。超声引导下经皮肺穿刺活检病理结果示异型腺管浸润生长(图2A),病变多为肺腺癌,免疫组化染色甲状腺CK7、TTF-1、Napsin A强阳性表达,CK5/6、P40、P60阴性。骨骼扫描、脑部CT扫描和腹部系统、泌尿系统和心血管系统超声检查未发现转移性疾病的证据。因此,患者被诊断为右肺腺癌伴胸膜转移(cT4N0M1a,IVa期)。
为了识别可靶向突变,采用基于捕获的二代DNA测序技术对肿瘤活检标本进行测序,测序面板包含73个癌症相关基因(北京吉因加科技有限公司)。该序列的平均有效覆盖深度为2,032×。在组织中发现非互易ALK融合PPFIA1-ALK(P2:A20)(丰度,10%)和ALK-C2orf91(A19,基因间)(丰度,13%)(图3)。未检测到其他基因突变。免疫组织化学染色显示,使用Ventana D5F3时,肿瘤的ALK表达呈阳性(图2B)。因此,根据指南和临床研究,结合患者意愿,于2022年7月15日接受阿来替尼(600 mg,每日2次)一线治疗。
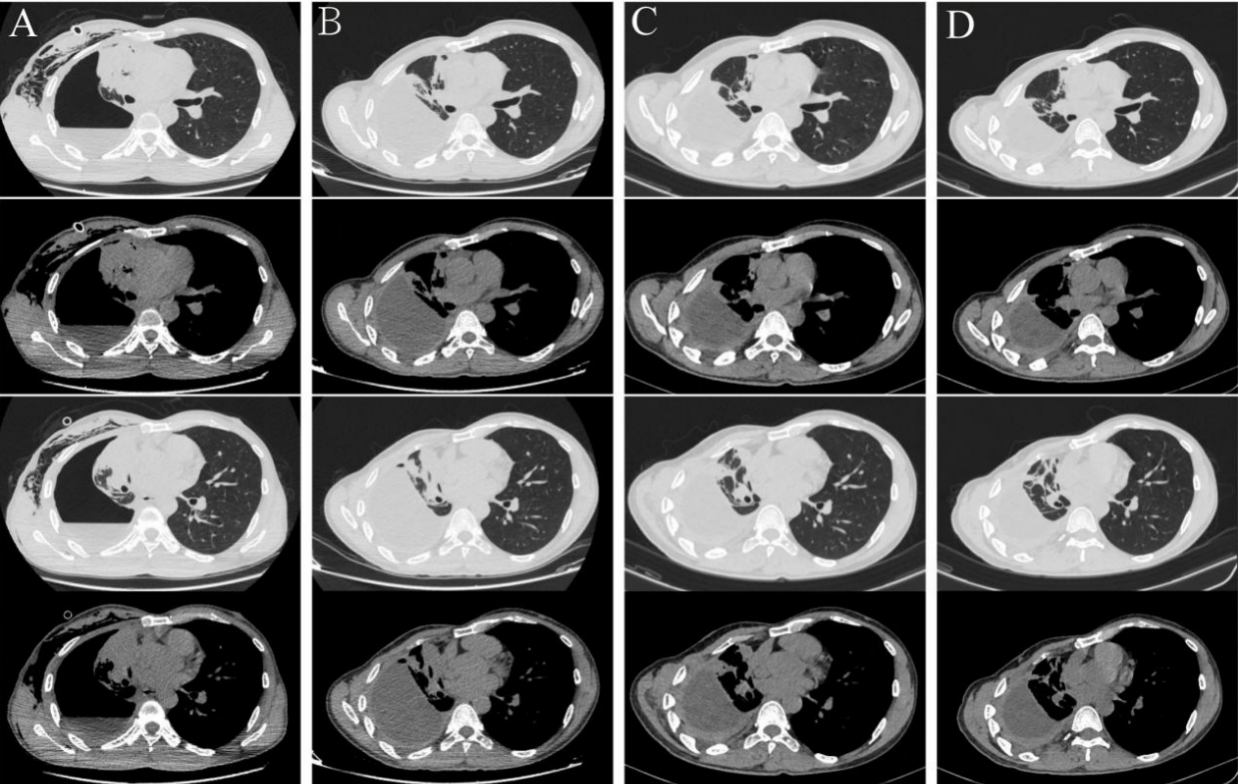 图1. 不同治疗阶段肺部病变的动态成像。(A)诊断时肺部病变。(B)经阿来替尼靶向治疗2个月后,右肺肿瘤明显缩小,达到部分缓解(PR)。(C)阿来替尼靶向治疗9个月后,右肺肿瘤持续缩小。(D)经阿来替尼靶向治疗12个月后,右肺肿瘤趋于稳定。
图1. 不同治疗阶段肺部病变的动态成像。(A)诊断时肺部病变。(B)经阿来替尼靶向治疗2个月后,右肺肿瘤明显缩小,达到部分缓解(PR)。(C)阿来替尼靶向治疗9个月后,右肺肿瘤持续缩小。(D)经阿来替尼靶向治疗12个月后,右肺肿瘤趋于稳定。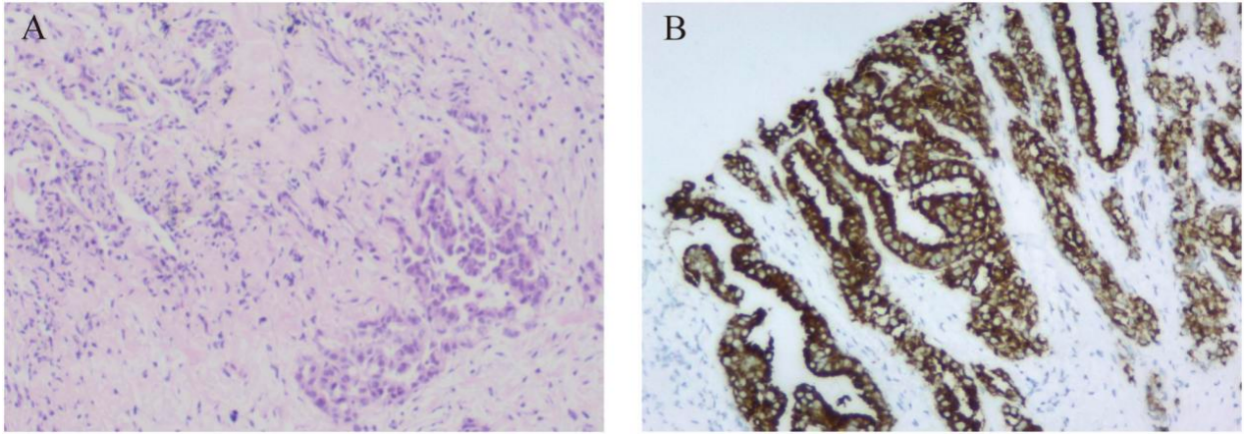 图2. 患者的病理检查。(A)肺组织活检标本(HE染色,放大倍数×100)。(B)免疫组化显示ALK(D5F3 Ventana)阳性表达。
图2. 患者的病理检查。(A)肺组织活检标本(HE染色,放大倍数×100)。(B)免疫组化显示ALK(D5F3 Ventana)阳性表达。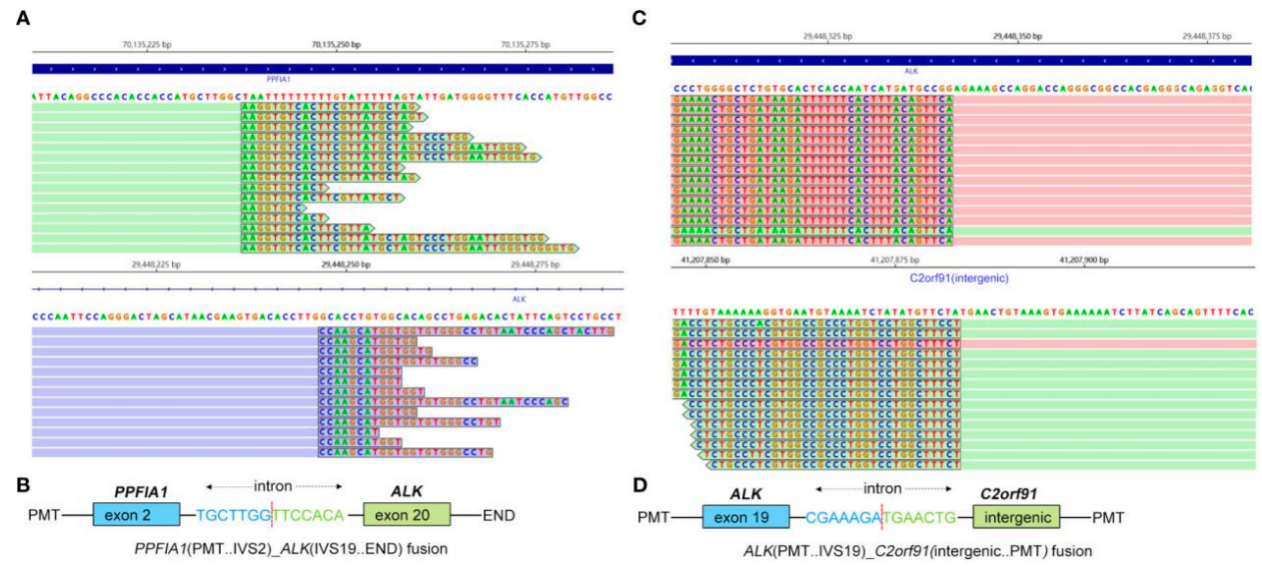 图3.通过二代测序鉴定PPFIA1-ALK和ALK-C2orf91(基因间)双融合变体。 (A)PPFIA1-ALK的测序读数通过Integrative Genomics Viewer(IGV)可视化。 (B)基因组DNA序列的示意性结构显示PPFIA1-ALK融合点。(C)ALK-C2orf91(基因间)的测序读数通过IGV可视化。(D)基因组DNA序列的示意性结构显示了ALK-C2orf91(基因间)融合点。
图3.通过二代测序鉴定PPFIA1-ALK和ALK-C2orf91(基因间)双融合变体。 (A)PPFIA1-ALK的测序读数通过Integrative Genomics Viewer(IGV)可视化。 (B)基因组DNA序列的示意性结构显示PPFIA1-ALK融合点。(C)ALK-C2orf91(基因间)的测序读数通过IGV可视化。(D)基因组DNA序列的示意性结构显示了ALK-C2orf91(基因间)融合点。
阿来替尼治疗2个月后,随访CT扫描发现右肺肿瘤显著缩小,因此根据实体瘤疗效评价标准[RECIST]第1.1版获得部分缓解(图1B)。9个月和12个月时的随访CT扫描显示右肺肿瘤缩小,病情趋于稳定(图1C、D)。在本研究的截止日期,患者已接受阿来替尼治疗12个月,未主诉不适,也未出现不良反应。
讨论
这是首例描述对阿来替尼敏感的新型PPFIA1-ALK和ALK-C2orf91(基因间)双融合肺腺癌患者。据报道,NSCLC患者存在多种ALK融合类型,其中不同的融合伴侣和不同的断点变异可能会影响患者对ALK-TKIs的反应[7,8]。之前的报道称,HIP1-ALK (H21:A20)和HIP1-ALK (H30:A20)对克唑替尼反应良好[9,10],而HIP1-ALK (H19:A20)对克唑替尼表现出耐药性,并伴有胸腔积液进展[8]。因此,确定不同的ALK融合对不同ALK抑制剂的疗效对于个性化治疗决策至关重要。
据我们所知,PPFIA1-ALK融合在肺癌中尚未见报道。PPFIA1是位于11q13区域的推定侵袭抑制基因,而ALK位于2号染色体的短臂。据报道,PPFIA1的扩增和过表达与乳腺癌的不良预后有关[11]。在本病例中,PPFIA1基因的第2号外显子与ALK基因的第20号外显子重排,形成了一个新的融合基因PPFIA1-ALK。虽然没有直接证据支持PPFIA1-ALK是一种驱动突变,但考虑到PPFIA1在肺组织中的高表达[12],PPFIA1-ALK重排有可能是一种驱动突变。
根据全球ALEX研究,在未经治疗的EML4-ALK融合NSCLC中,无论EML4-ALK变异情况如何,阿来替尼的无进展生存期(PFS)优于克唑替尼[13]。对于3′-ALK融合的患者,5′-ALK融合的保留被定义为非互易融合,这预示着一线克唑替尼治疗的PFS更差[14]。因此,在本病例中,作为5′-ALK的ALK-C2orf91(A19: 基因间)和作为3′-ALK的PPFIA1-ALK(P2:A20)被定义为非互易ALK融合。Zeng报告了1例一线吉非替尼耐药后发生非互易ALK融合的NSCLC患者,该患者对阿来替尼有反应,PFS超过26个月。与既往报告相似,本病例中的患者也对阿来替尼敏感,并已接受阿来替尼治疗12个月。
结论
总之,本病例是一种罕见的新型非互易PPFIA1-ALK和ALK-C2orf91(基因间)双融合突变,对一线阿来替尼治疗敏感。
1. Yan L, Zheng J, Pan Q, Liang Y, Yu P, Chen Q. Novel PPFIA1-ALK, ALK-C2orf91(intergenic) double-fusion responded well to alectinib in an advanced lung adenocarcinoma patient: a case report. Front Oncol. 2023 Aug 29;13:1264820. doi: 10.3389/fonc.2023.1264820.
2. Gainor JF, Varghese AM, Ou SH, et al. ALK rearrangements are mutually exclusive with mutations in EGFR or KRAS: an analysis of 1,683 patients with non-small cell lung cancer. Clin Cancer Res (2013) 19:4273–81. doi: 10.1158/1078-0432.CCR-13-0318.
3. Ou SI.VW zhuM nagasaka catalog of 5' Fusion partners in ALK-positive NSCLC circa 2020. JTO Clin Res Rep (2020) 1:100015. doi: 10.1016/j.jtocrr.2020.100015.
4. Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med (2014) 371:2167–77. doi: 10.1056/NEJMoa1408440.
5. Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet (2017) 389:917–29. doi: 10.1016/S0140-6736(17)30123-X.
6. Peters S, Camidge DR, Shaw AT, et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med (2017) 377:829–38. doi: 10.1056/NEJMoa1704795.
7. Yoshida T, Oya Y, Tanaka K, et al. Differential crizotinib response duration among ALK fusion variants in ALK-positive non-small-cell lung cancer. J Clin Oncol (2016) 34:3383–9. doi: 10.1200/JCO.2015.65.8732.
8. Li M, Tang Q, Chen S, Wang Y. A novel HIP1-ALK fusion variant in lung adenocarcinoma showing resistance to Crizotinib. Lung Cancer (2021) 151:98–100. doi: 10.1016/j.lungcan.2020.11.014.
9. Hong M, Kim RN, Song JY, et al. HIP1-ALK, a novel fusion protein identified in lung adenocarcinoma. J Thorac Oncol (2014) 9:419–22. doi: 10.1097/JTO.0000000000000061.
10. Ou SH, Klempner SJ, Greenbowe JR, et al. Identification of a novel HIP1-ALK fusion variant in Non-Small-Cell Lung Cancer (NSCLC) and discovery of ALK I1171 (I1171N/S) mutations in two ALK-rearranged NSCLC patients with resistance to Alectinib. J Thorac Oncol (2014) 9:1821–5. doi: 10.1097/JTO.0000000000000368.
11. Alfarsi LH, El Ansari R, Craze ML, et al. PPFIA1 expression associates with poor response to endocrine treatment in luminal breast cancer. BMC Cancer (2020) 20:425. doi: 10.1186/s12885-020-06939-6.
12. Fagerberg L, Hallstrom BM, Oksvold P, et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Mol Cell Proteomics (2014) 13:397–406. doi: 10.1074/mcp.M113.035600.
13. Camidge DR, Dziadziuszko R, Peters S, et al. Updated efficacy and safety data and impact of the EML4-ALK fusion variant on the efficacy of alectinib in untreated ALK-positive advanced non-small cell lung cancer in the global phase III ALEX study. J Thorac Oncol (2019) 14:1233–43. doi: 10.1016/j.jtho.2019.03.007.
14. Zhang Y, Zeng L, Zhou C, et al. Detection of nonreciprocal/reciprocal ALK translocation as poor predictive marker in patients with first-line crizotinib-treated ALK-rearranged NSCLC. J Thorac Oncol (2020) 15:1027–36. doi: 10.1016/j.jtho.2020.02.007.
排版编辑:肿瘤资讯-olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


