三阴性乳腺癌(TNBC)约占全部乳腺癌的10%~20%,具有发病年龄小、侵袭性高、预后差等特点。TNBC对内分泌治疗和传统抗人表皮生长因子受体2(HER2)靶向治疗不敏感,既往化疗是其标准治疗选择。但随着医学发展,人们逐渐认识到TNBC是一类具有高度异质性的混合型乳腺癌,寻找其精准治疗的靶点和更有效的治疗方式成为临床努力的方向,针对免疫检查点的免疫治疗药物和针对不同靶点的靶向治疗药物的出现,如程序性细胞死亡蛋白1/程序性细胞死亡配体1(PD-1/PD-L1)抑制剂、多聚腺苷二磷酸核糖聚合酶(PARP)抑制剂、靶向HER2或靶向人滋养细胞表面抗原-2(Trop-2)抗体偶联药物(ADC),正在改变TNBC的临床实践[1]。
在新开发的多种靶向药物中,以单克隆抗体和细胞毒性药物为基础的ADC,具有高特异性靶向能力和强效杀伤肿瘤细胞的作用,可大幅度降低传统化疗带来的毒副反应[2]。临床应关注启用ADC的合适时机,以及ADC治疗获益患者群体分层等问题,有利于优化晚期TNBC精准治疗策略。
「精准、分类而治」是晚期TNBC治疗的必然趋势
TNBC的远处转移和复发风险高于其他类型乳腺癌,30%~40%的TNBC可发生转移[3],多数在诊断后1~2年内复发,患者5年存活率仅30%[2],其治疗机会及时间窗的局限性较强,临床亟需更多化疗以外的治疗手段,以改善患者预后和生存。
随着组学研究的发展和对TNBC分子分型的深入研究,临床逐渐认识到TNBC并非一种单一性肿瘤,而是一类具有高度异质性的混合型肿瘤,不同患者的肿瘤生物学行为和药物敏感性存在显著差异。寻找不同分型的关键治疗靶点、开发靶向药物,根据每1例TNBC患者独特而复杂的肿瘤分子特征和生物学特性制订个体化精准治疗方案,已成为晚期TNBC治疗的发展方向[1]。针对不同靶点的靶向治疗和针对免疫检查点的免疫治疗已逐渐应用于晚期TNBC治疗,并取得了一定的临床效果。
与其他类型乳腺癌相比,TNBC肿瘤微环境中的肿瘤浸润淋巴细胞和PD-1/PD-L1表达水平更高,提示患者更有可能从PD-1/PD-L1抑制剂治疗中获益[3]。KEYNOTE-355研究证实,在肿瘤表达PD-L1且合并阳性评分(CPS)≥10的TNBC患者中,PD-1抑制剂帕博利珠单抗联合化疗相比单纯化疗可显著提高中位无进展生存期(PFS,9.7个月 vs 5.6个月,HR:0.65,P=0.0012)[4]。
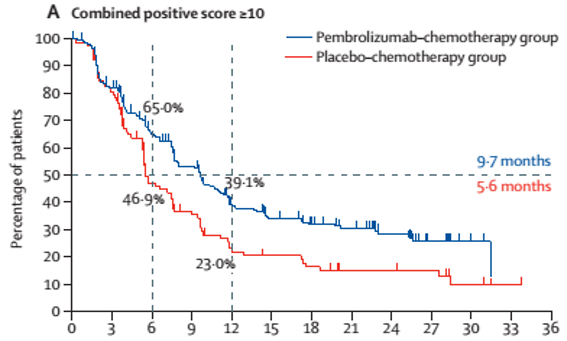 图1:PD-1抑制剂+化疗显著提高CPS≥10分TNBC的PFS[4]
图1:PD-1抑制剂+化疗显著提高CPS≥10分TNBC的PFS[4]
TNBC患者具有较高的BRCA1/2突变率,PARP抑制剂能够阻断DNA损伤修复,导致BRCA1/2缺陷的肿瘤细胞「合成致死」[1]。EMBRACA试验亚组分析显示,对于携带BRCA1/2胚系突变的晚期TNBC,PARP抑制剂talazoparib治疗后的PFS优于单纯化疗(HR:0.60,95%CI:0.41~0.87)[5]。
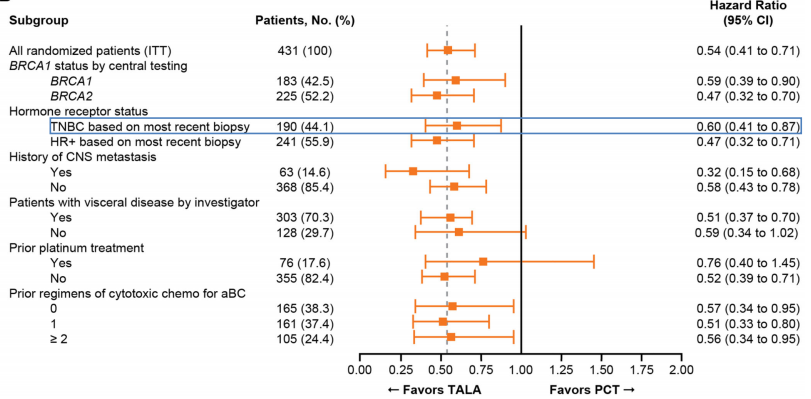 图2:PARP抑制剂显著延长TNBC亚组PFS[5]
图2:PARP抑制剂显著延长TNBC亚组PFS[5]
由于缺乏HER2过表达/ERBB2扩增,HER2阴性肿瘤历来根据激素受体(HR)的表达进行分类和治疗,但实际上约三分之一的TNBC表现为HER2低表达[6],使得这部分患者成为潜在的可靶向治疗人群。基于此,关于德曲妥珠单抗(T-DXd)治疗HER2低表达晚期乳腺癌的DESTINY-Breast04研究,成为了近年来临床关注的焦点。
化疗仍是晚期TNBC一线标准治疗
由于雌激素受体(ER)、孕激素受体(PR)和HER2均呈阴性,TNBC对内分泌治疗及传统抗HER2靶向治疗不敏感[1]。《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2023》推荐仅需要使肿瘤迅速缩小或症状迅速缓解的TNBC患者推荐选择联合化疗,以耐受性和生活质量作为优先考虑因素的患者首选单药化疗[7]。因此,化疗仍是TNBC的一线标准治疗方案[7],上述新型靶向/免疫治疗药物也多致力于探索一线联合化疗或二线单药/联合治疗晚期TNBC的效果。
ADC为晚期TNBC二线治疗提供新选择
如前所述,DESTINY-Breast04(NCT03734029)是一项关于T-DXd治疗HER2低表达晚期乳腺癌的随机、开放标签、多中心、Ⅲ期临床研究,纳入557例既往接受过1~2线化疗的HER2低表达晚期乳腺癌患者,2:1随机分配至T-DXd组(5.4mg/kg,Q3W)或医生选择化疗组(TPC)。主要终点为盲法独立中心审查(BICR)评估的HR+队列PFS;关键次要终点为BICR评估的所有患者PFS,以及HR+队列和所有患者的总生存期(OS)[8]。
该研究于2022年ASCO年会公布的数据表明,对于HR-/HER2低表达的晚期乳腺癌患者,T-DXd组的中位PFS(8.5个月 vs 2.9个月,HR=0.46)和中位OS(18.2个月 vs 8.3个月,HR=0.48)均优于TPC组[9,10]。
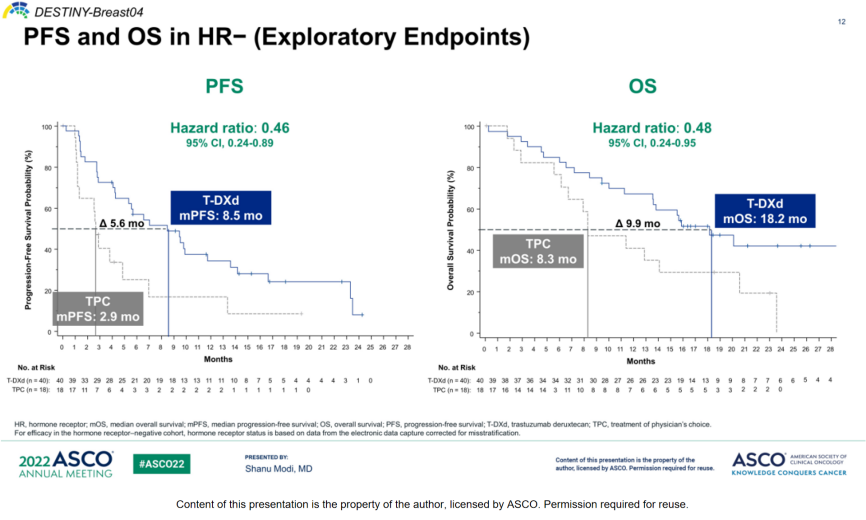 图3:DESTINY-Breast04 HR-队列分析结果[10]
图3:DESTINY-Breast04 HR-队列分析结果[10]
戈沙妥珠单抗(SG)是一种靶向Trop-2的ADC。随机、Ⅲ期研究——ASCENT纳入529例转移性TNBC,随机分组接受SG或TPC治疗。结果显示,在既往接受过≥2线化疗的晚期TNBC患者中,SG组和TPC组中位 PFS 分别为 5.6 个月和 1.7 个月(HR=0.41,P<0.001),中位 OS 分别为 12.1 个月和 6.7 个月(HR=0.48,P<0.001)[11]。2023年ESMO年会上,一项回顾性队列研究纳入230例晚期TNBC患者,描述了真实世界SG治疗的临床疗效。其随访7.2个月的数据表明,SG为晚期TNBC患者2线及以上治疗带来一定程度的生存获益[12]。
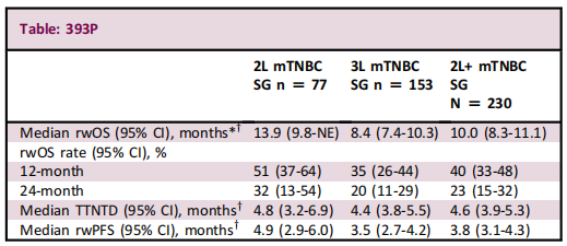 图4:真实世界SG临床疗效[12]
图4:真实世界SG临床疗效[12]
另一项系统回顾性荟萃分析纳入ASCENT研究和TROPiCS-02研究中999例患者数据,比较SG与化疗在临床试验中的安全性。结果表明,SG治疗组≥3级的中性粒细胞减少、白细胞减少、贫血和其他非血液学不良事件的风险高于化疗,但在3~4级疲劳、所有级别恶心、发热性中性粒细胞减少和因不良事件停止治疗方面与化疗无显著差异[13]。
总结
晚期TNBC恶性程度高、预后差,化疗是其一线标准治疗,在此基础上开发新型靶向/免疫治疗药物以实现精准、分类治疗是未来的必然趋势。ADC新药的开发以及HER2低表达概念的提出为晚期TNBC提供了新的治疗选择,《NCCN临床实践指南:乳腺癌(2023.V4)》推荐SG用于晚期TNBC的二线治疗,以及T-DXd用于无BRCA1/2胚系突变的HER2低表达晚期TNBC的二线治疗[14],为临床优化TNBC治疗策略提供了依据。相信随着临床研究的进展,未来会有更多的新型药物加入晚期TNBC精准治疗队伍。
声明:本文材料由阿斯利康提供支持,仅供医疗卫生专业人士参考
审批编号:CN-125953
[1] 肖玉铃,等.三阴性乳腺癌精准治疗研究的新进展与未来展望[J].中国癌症杂志,2022,32(8):668-679.
[2] 夏云霞,等.晚期三阴型乳腺癌精准治疗药物应用进展[J].山东医药,2023,63(12):96-102.
[3] 吕玉珠,等.精准医学时代背景下三阴性乳腺癌治疗进展[J].医学综述,2021,27(16):3199-3203.
[4] Cortes J, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet. 2020;396(10265):1817-1828.
[5] Litton JK, et al. Talazoparib in Patients with Advanced Breast Cancer and a Germline BRCA Mutation. N Engl J Med. 2018;379(8):753-763.
[6] Tarantino P, et al. ESMO expert consensus statements (ECS) on the definition, diagnosis, and management of HER2-low breast cancer. Ann Oncol. 2023;34(8):645-659.
[7] 中国临床肿瘤学会指南工作委员会.乳腺癌诊疗指南 2023[M].人民卫生出版社,北京,2023.
[8] Shanu Modi, et al. Trastuzumab Deruxtecan (T-DXd) Versus Treatment of Physician’s Choice (TPC) in Patients With HER2-Low Unresectable and/or Metastatic Breast Cancer: Updated Survival Results of the Randomized, Phase 3 DESTINY-Breast04 Study. 2023 ESMO, abstract 376O.
[9] Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, Tsurutani J, Ueno NT, Prat A, Chae YS, Lee KS, Niikura N, Park YH, Xu B, Wang X, Gil-Gil M, Li W, Pierga JY, Im SA, Moore HCF, Rugo HS, Yerushalmi R, Zagouri F, Gombos A, Kim SB, Liu Q, Luo T, Saura C, Schmid P, Sun T, Gambhire D, Yung L, Wang Y, Singh J, Vitazka P, Meinhardt G, Harbeck N, Cameron DA; DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20.
[10] Shanu Modi, et al. Trastuzumab deruxtecan (T-DXd) vs treatment of physician's choice in patients with HER2-low unresectable and/or metastatic breast cancer: Results of DESTINY-Breast04, a randomized, phase 3 study. 2022 ASCO LBA3.
[11] Bardia A, Hurvitz SA, Tolaney SM, et al. Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021;384(16):1529-1541.
[12] K. Kalinsky, et al. Real-world (RW) use patterns, effectiveness, and tolerability of sacituzumab govitecan (SG) for second-line (2L) and later treatment of metastatic triple-negative breast cancer (mTNBC). Annals of Oncology (2023) 34 (suppl_2): S334-S390. 10.1016/annonc/annonc1299. https://oncologypro.esmo.org/meeting-resources/esmo-congress/real-world-rw-use-patterns-effectiveness-and-tolerability-of-sacituzumab-govitecan-sg-for-second-line-2l-and-later-treatment-of-metastatic
[13] A. Rizzo, et al. Sacituzumab govitecan versus chemotherapy for metastatic breast cancer: A meta-analysis on safety outcomes. Annals of Oncology (2023) 34 (suppl_2): S334-S390. 10.1016/annonc/annonc1299. https://oncologypro.esmo.org/meeting-resources/esmo-congress/sacituzumab-govitecan-versus-chemotherapy-for-metastatic-breast-cancer-a-meta-analysis-on-safety-outcomes
[14] William J, et al. NCCN Clinical Practice Guidelines in Oncology:Breast Cancer(Version 4.2023).
排版编辑:肿瘤资讯-高惠











 苏公网安备32059002004080号
苏公网安备32059002004080号


