2023年欧洲内科肿瘤学会(ESMO)大会上,来自意大利米兰国家癌症研究所Filippo Pietrantonio口头汇报了全球开放标签、3期试验CodeBreak 300的最新结果(NCT05198934),该研究旨在探索960mg sotorasib+panitumumab vs.240mg sotorasib+panitumumab vs.标准方案(曲氟尿苷替匹嘧啶或瑞戈非尼)治疗KRAS G12C突变难治性转移性结直肠癌(mCRC)的疗效及安全性,结果表明,上述两个剂量的sotorasib+panitumumab均较标准治疗表现出更优的无进展生存期(PFS)获益。今年12月7日,国际顶尖期刊New England Journal of Medicine(NEJM)在线刊登了该研究全文。据悉,该文章通讯作者为美国希望之城综合癌症中心Dr.Marwan G. Fakih1。
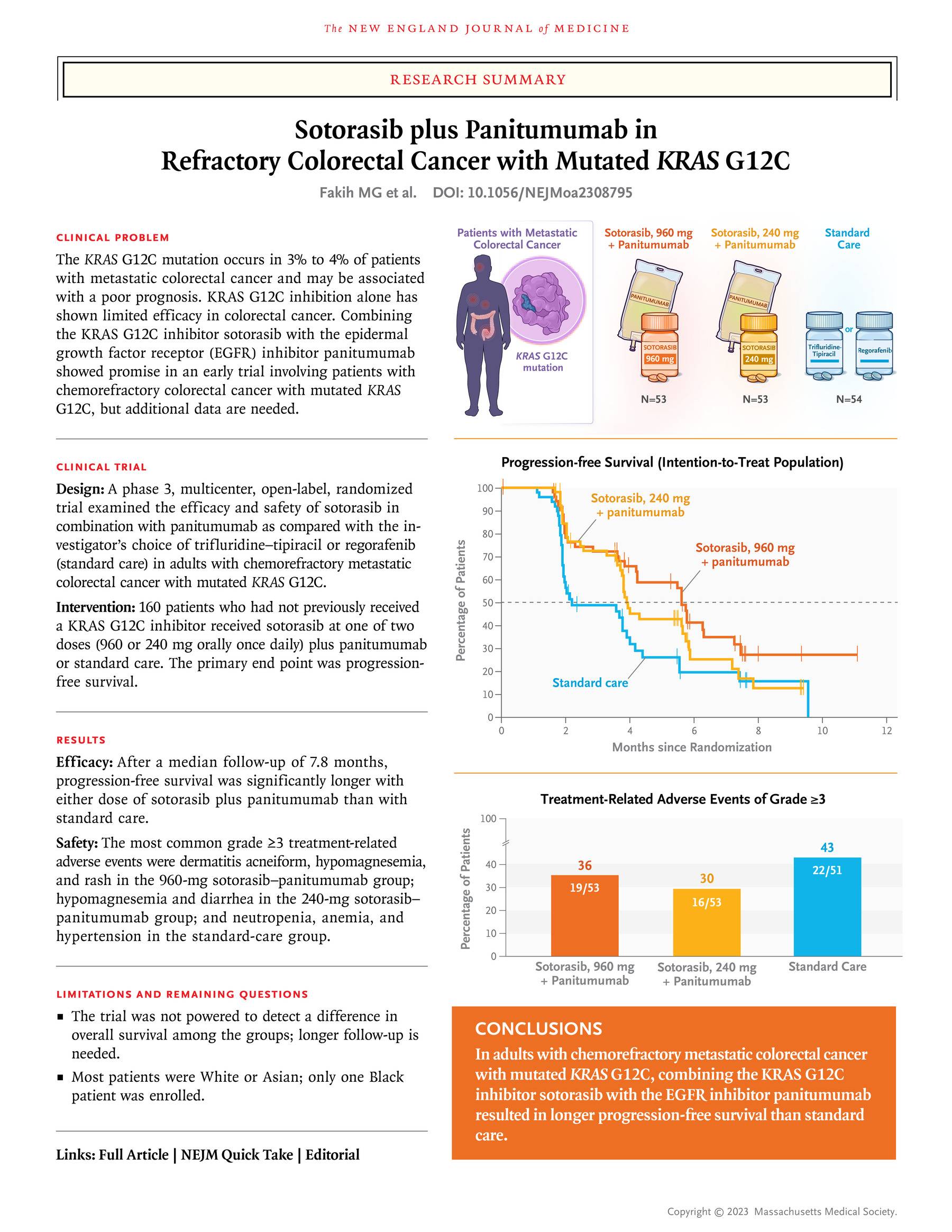
图1.研究概览(来自NEJM)
“小众却凶险”,KRAS抑制剂单药易耐药
驱动突变KRAS G12C在mCRC患者中占比3-4%,且与患者预后不良相关。初始治疗(氟尿嘧啶为基础的化疗联合/不联合贝伐珠单抗)难治的晚期mCRC标准治疗为曲氟尿苷替匹嘧啶(TAS-102)或瑞戈非尼,该标准治疗方案可带来有效的疗效,其中客观缓解率(ORR)可达1%-2%,中位PFS≤2.0个月;尽管如此,该方案的毒性作用仍有待改善。
尽管KRAS G12C抑制剂sotorasib、adagrasib单药在KRAS G12C突变非小细胞肺癌患者中治疗效果较好,但KRAS G12C抑制剂单药治疗在结直肠癌患者中的疗效有限。原因是KRAS G12C抑制剂治疗将诱导表皮生长因子受体(EGFR)通路上游重新激活,从而出现KRAS G12C选择性耐药,且临床前模型证实KRAS G12C联合EGFR双重抑制具有协同作用。
CodeBreak 101支持KRAS+EGFR双抑制,CodeBreak 300“再续前缘”
CodeBreak 101 单臂1b期试验表明,sotorasib+panitumumab治疗KRAS G12C突变化疗难治性mCRC患者缓解率达到30%,而sotorasib单药治疗的缓解率仅为9.7%。
过去几年中,研究者把表征靶向治疗剂量与疗效、安全性之间的相关性作为研究重点,从而调整剂量选择,旨在达到疗效最大化、毒性最小化的目标。推荐2期剂量(RP2D)和较低剂量(lower dose)水平之间的比较是剂量选择过程中的重要一环。sotorasib的RP2D为960mg,每日一次;基于非线性药代动力学,sotorasib的较低剂量240mg每日一次正在接受测试。
在此,研究者进行了全球多中心Ⅲ期试验CodeBreak 300,旨在评估两种不同剂量的sotorasib(960mg和240mg)联合panitumumab对比研究者选择的标准方案(TAS-102或瑞戈非尼)在携带KRAS G12C突变难治性mCRC中的疗效及安全性。
在这项3期、多中心、开放标签、随机对照试验中,研究者纳入了既往未接受过KRAS G12C抑制剂治疗的KRA G12C突变mCRC成年患者,且至少接受过一种系统治疗后疾病进展或复发。
入组患者按照1:1:1随机分配至接受960mg每日一次的sotorasib联合panitumumab治疗(960mg sotorasib-panitumumab组)、240mg每日一次的sotorasib联合panitumumab治疗(240mg sotorasib-panitumumab组)、研究者选择的TAS-102或瑞戈非尼(标准治疗组)。研究者基于既往是否接受抗血管生成治疗、自初次诊断转移至随机化的时间、东部协作组体能状态(ECOG)评分进行分层。治疗持续直至出现疾病进展、不可耐受的毒性、开始另一种抗肿瘤治疗、撤回知情同意或死亡。
该研究的主要终点为无进展生存期(PFS),次要终点为总生存期(OS)、客观缓解、缓解持续时间、至缓解时间、疾病控制(完全缓解+部分缓解+疾病稳定≥7周)、安全性、生活质量和药代动力学。
本试验计划招募153例患者,预计将发生约90例进展/死亡事件,假设疾病进展或死亡的风险比(HR)为0.4,则提供90%的效能检测两个剂量的sotorasib-panitumumab组相较治疗标准组的优效性。研究者使用分层对数秩检验来检测PFS,使用Kaplan-Meier方法来评估OS。
无论是960mg还是240mg,PFS均较标准治疗有所改善
结果显示,2022年4月19日至2023年3月14日期间,本试验筛选了12个国家76个医学中心的219例患者,来自欧洲(65.6%)、亚洲(22.5%)、北美(10.6%)和其他地区(1.2%)的160例患者入组,960mg sotorasib-panitumumab组有53例,240mg sotorasib-panitumumab组有53例,标准治疗组有54例(TAS-102治疗为37例,瑞戈非尼治疗为14例,3例未接受指定治疗)。截止2023年6月15日,疾病进展/死亡风险为91例,故进行首次数据分析。
三组患者基线水平时的人口统计学和临床特征总体较为平衡。总体而言,患者的中位年龄为62.0岁;50.6%为女性患者;ECOG PS 0/1/2分别为60.0%、36.9%和3.1%;15.0%既往接受过一种治疗,85.0%既往接受过两种及以上治疗。右半结肠原发肿瘤在960mg sotorasib-panitumumab组(45.3%)的比例高于240mg sotorasib-panitumumab组(32.1%)、标准治疗组(29.6%)的比例。
在数据截止时,中位随访时间为7.8个月。960mg sotorasib-panitumumab组、240mg sotorasib-panitumumab组和标准治疗组的中位持续治疗时间为5.8个月、4.1个月和2.2个月。
PFS数据
在主要终点方面,与标准治疗组相比,960mg sotorasib-panitumumab组、240mg sotorasib-panitumumab组的患者PFS显著延长,经盲态独立中央审查评估的两个剂量组PFS分别为5.6个月和3.9个月,标准治疗组为2.2个月。与标准治疗组相比,960mg sotorasib-panitumumab组、240mg sotorasib-panitumumab组的风险比(HR)分别为0.49、0.58。研究者评估的预设亚组分析结果与主要分析结果一致。
肿瘤缓解
经盲态独立中央审查评估,960mg sotorasib-panitumumab组、240mg sotorasib-panitumumab组的客观缓解率(ORR)分别为26.4%和5.7%,标准治疗组的ORR为0%。其中,960mg sotorasib-panitumumab组中有1例(1.9%)达到完全缓解。这与研究者评估的客观缓解分析结果类似。
960mg sotorasib-panitumumab组的中位缓解持续时间为4.4个月,而其他治疗组因缓解不足而未进行评估。
OS数据
数据截止时,OS数据尚不成熟,55例(34.4%)患者死亡。与标准治疗组相比,960mg sotorasib-panitumumab组的HR为0.77,240mg sotorasib-panitumumab组的HR为0.91。
安全性
960mg sotorasib-panitumumab组的53例患者中有50例(94.3%)发生治疗相关不良事件,240mg sotorasib-panitumumab组的53例患者中有51例(96.2%)发生治疗相关不良事件,标准治疗组则为42/51例(82.4%)。两个剂量的sotorasib-panitumumab组中最为常见的不良事件为低镁血症(960mg组为28.3%;240mg组为30.2%)、皮疹(960mg组为28.3%;240mg组为24.5%)、痤疮样皮疹(960mg组为22.6%;240mg组为37.7%)。标准治疗组中,最为常见的治疗相关不良事件为中性粒细胞减少症(31.4%)、恶心(29.4%)。
960mg组、240mg组和标准治疗组的≥3级治疗相关不良事件发生率分别为35.8%、30.2%和43.1%。960mg组最为常见(≥5%)的≥3级治疗相关不良事件痤包括疮样皮疹(11.3%)、低镁血症(5.7%)和皮疹(5.7%);240mg组则包括低镁血症(7.5%)和腹泻(5.7%);标准治疗组包括中性粒细胞减少(23.5%)贫血(5.9%)和高血压(5.9%)。三个治疗组治疗相关严重不良事件发生率分别为5.7%、0%和7.8%;导致停药的治疗相关不良事件发生率分别为3.8%、1.9%和2.0%。
值得强调的是,本试验还重点关注了肝毒性,三个治疗组中任何级别的肝毒性不良事件发生率分别为11.3%、5.7%和7.8%。
药代动力学
结果显示,sotorasib和panitumumab的药代动力学特性与既往研究一致,且两种剂量水平的sotorasib观察到的暴露量相似。sotorasib和panitumumab之前未观察到存在药代动力学药物相互作用。
基于此,研究者得出结论,960mg sotorasib+panitumumab和240mg sotorasib+ panitumumab均可延长PFS,相比标准治疗提高肿瘤缓解率,且不良事件符合预期,未发现新的安全性问题。
百花齐放,诸多KRAS G12C突变mCRC问题值得探讨
改善不良预后
mCRC患者中KRAS G12C突变亚型占比较低,故该试验中无法检测到OS的差异。与标准治疗相比,sotorasib+panitumumab可显著延长KRAS G12C突变化疗难治性mCRC的PFS,同时,在标准治疗组疗效符合预期的背景下,两个剂量的sotorasib+panitumumab组ORR均高于标准治疗组。这些结果对于改善mCRC KRAS G12C突变相关不良预后结局至关重要。
原发肿瘤部位影响
在960mg组中,患者的缓解率(26.4%)和中位PFS(5.6个月)似乎与1b期CodeBreak 100试验中观察到的960mg sotorasib+panitumumab疗效结果较为一致。 在CodeBreak 300试验中,KRAS G12C突变化疗难治性mCRC患者的确证性缓解率为30.0%,中位PFS为5.7个月;960mg sotorasib+panitumumab组的PFS数据不受原发肿瘤部位的影响。这些结果与先前在BRAF V600E突变mCRC患者中观察到的BRAF-EGFR双重阻断结果相似。
960mg剂量或更优
尽管两个剂量水平的sotorasib暴露量相似,但组织和细胞水平的差异可能会影响靶向治疗结果。Optimus项目是来自美国食品药品监督管理局(FDA)肿瘤卓越中心(OCE)的一项举措,旨在确定最大限度提高疗效及安全性的分子靶向药物潜在剂量水平。该项目前强调,评估至少两个药物剂量并阐明不同剂量对于疗效及安全性的影响至关重要。尽管本试验尚不能对于两个剂量组之间进行相互比较,但就所有疗效终点而言,960mg剂量似乎比240mg剂量表现出更显著的临床获益,且不增加毒性。在晚期背景下,mCRC高负荷肿瘤相关症状发生缓解的潜力更大,故960mg组患者缓解率更高。因此,上述结果支持960mg剂量更有利。较低剂量240mg的疗效可能与原发性/继发性耐药机制有关,但仍需经过试验进一步探究。目前,已有研究证实KRAC G12C扩增可继发KRAS突变,潜在的耐药机制仍是未来研究的重点。
皮肤毒性或可预防
两个剂量sotorasib+panitumumab组之间的安全性总体一致,未发现新的安全性信号。sotorasib+panitumumab组合治疗的不良事件与基于EGFR单抗治疗的预期不良事件总体一致。EGFR抑制剂治疗相关不良事件为皮肤毒性,本试验强烈建议对皮肤相关毒性作用进行预防性治疗,sotorasib+panitumumab治疗似乎并未加重这类毒性作用,且优于panitumumab单药治疗。
利弊兼有
该试验的局限性体现在:①其试验目的及初衷均不是为了检验各个治疗组之间的OS显著差异,因此,仍需更长时间的随访以确定治疗干预对于OS的影响。②入组人群主要为欧美人群和亚洲人群,其他人群不具代表性。
该试验的优点体现在:①这是一项国际3期随机主动对照试验;涉及KRAS G12C抑制剂的具体两个剂量,两个剂量组均可直接与标准治疗组进行比较。②尽管与SUNLIGHT、FRESCO-2试验的人群类似,CodeBreak 300试验入组了化疗难治性mCRC,但更为重要的是,该试验基于生物标志物进行人群筛选,入组了KRAS G12C突变的mCRC患者群体。
1. Fakih, M. G. et al. Sotorasib plus Panitumumab in Refractory Colorectal Cancer with Mutated KRAS G12C. New England Journal of Medicine 389, 2125–2139 (2023).
排版编辑:肿瘤资讯-Astrid











 苏公网安备32059002004080号
苏公网安备32059002004080号


