多重荧光免疫组化技术(mIHC)基于酪氨信号放大原理,可以在一张FFPE组织切片中进行多种标志物染色,通过各标志物的在细胞上的单表达或者共表达,识别不同细胞亚群,结合人工智能软件,将病理医生的局部判读转为客观算法,扩展到全片的定量计算,统计各个组织区域中细胞类型、密度,空间位置关系等信息。该技术有三大技术突破,分别解决了染色环节的抗体来源冲突的问题,可实现7-9种标志物的染色;解决了扫描成像环节的串色干扰问题,提高了图片的信噪比;还解决图像分析环节的定量分析标准化的问题。
多重荧光免疫组化技术在临床科研,基础科研,药物研发等方面都有比较广泛的应用。
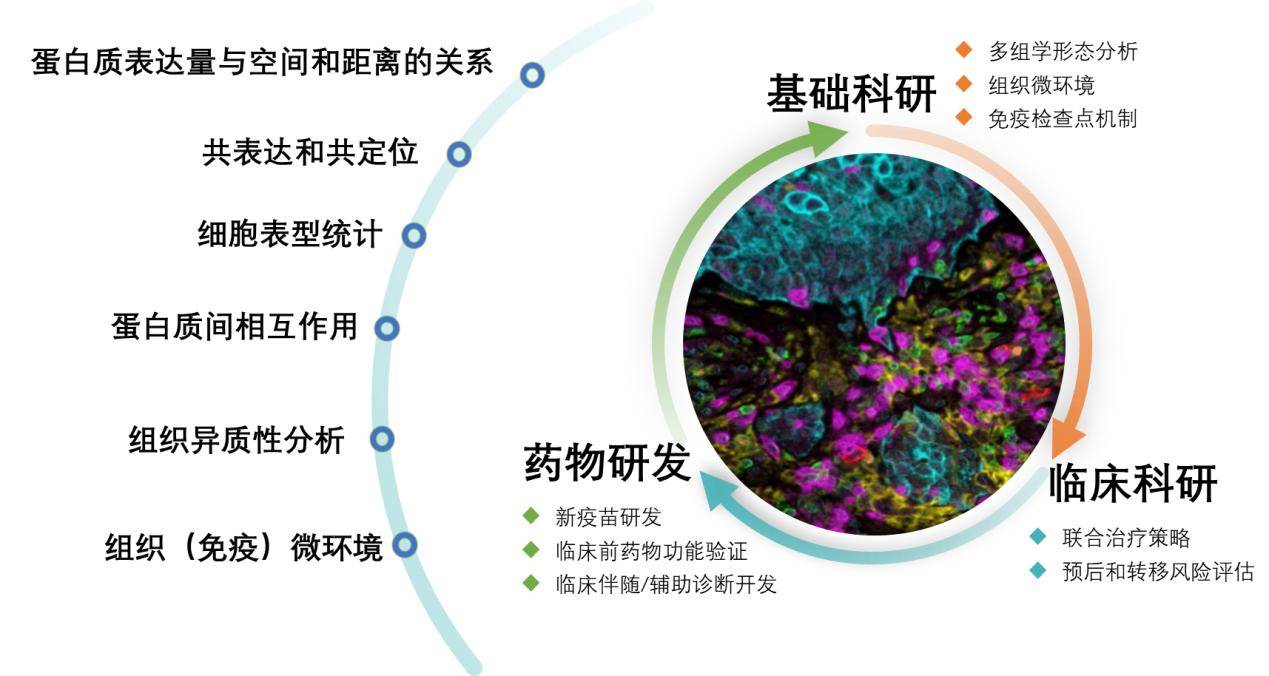
在临床的应用主要为
1、肿瘤免疫治疗预测:可以评估肿瘤微环境中多个免疫相关标志物的表达,帮助预测肿瘤对免疫治疗的响应。通过检测PD-1、PD-L1、CD8、CD20、CD23等标志物的表达情况,可以考察肿瘤微环境浸润类型,三级淋巴结构(TLS)的分布状态,从而预测免疫检查点抑制剂治疗的疗效。
2、肿瘤亚型鉴定:可以同时评估多个肿瘤标志物的表达,帮助鉴定肿瘤的亚型,这对于指导个体化治疗和预后评估非常重要。
3、临床试验和伴随诊断测试:可以用于临床试验和伴随诊断测试,帮助筛选适合特定治疗的患者。通过评估多个标志物的表达情况,可以更准确地选择患者,并预测治疗的疗效。
4、疾病诊断和分型:可以用于疾病的早期诊断和分型。通过同时检测多个生物标志物,可以提供更全面和准确的诊断信息,有助于指导治疗决策。
5、药物研发和药物靶点鉴定:多重检测可以用于药物研发和药物靶点鉴定。通过评估多个标志物的表达和相互作用,可以帮助确定药物的作用机制和靶点,从而指导药物研发过程。
在科研中的应用中
多重荧光免疫组化(mIHC)可与其他多组学(包括单细胞测序、空间转录组测序、蛋白质组学、微生物组学等)的分析结果相互验证。具体如下:
在单细胞测序中
1、细胞亚型的鉴定:针对单细胞测序鉴定出的亚型,mIHC可以通过标记多个标志物,帮助确定细胞亚型的存在与否;
2、细胞亚型表达的位置区域;
3、细胞亚型在不同组别的占比或浸润情况;
4、细胞通讯的验证:通过不同的细胞类型以及受配体靶标的组合,可进一步验证细胞通讯的存在与否,以及细胞通讯强度在不同组别间的差异情况;
5、基因的表达高低:针对发现的靶点(或靶点组合)在实验组和对照组的差异,可通过mIHC来进一步验证。
在空间转录组测序中,由于空间转录组的分辨率有限,也可通过mIHC进一步验证
1、验证不同细胞亚型间的空间位置关系、以及与肿瘤的位置关系。
2、细胞亚型在不同的组别间的密度与数目以及浸润情况的差异。
在蛋白质组学中
1、针对筛选出的差异蛋白可在组织中进行定位,并可在组织原位上比较表达的差异;
2、可通过文献筛选出与疾病相关的差异的细胞亚型,可在蛋白质组学前或者后进行分析,增加数据的多样性及全面性。
在微生物组学中
1、无论是真菌或者是细菌的测序,均可以在测序前通过文献查找与相应疾病相关的细胞类型或者生物标志物的变化,通过mIHC对数据进行进一步验证,对数据进行全面的补充。
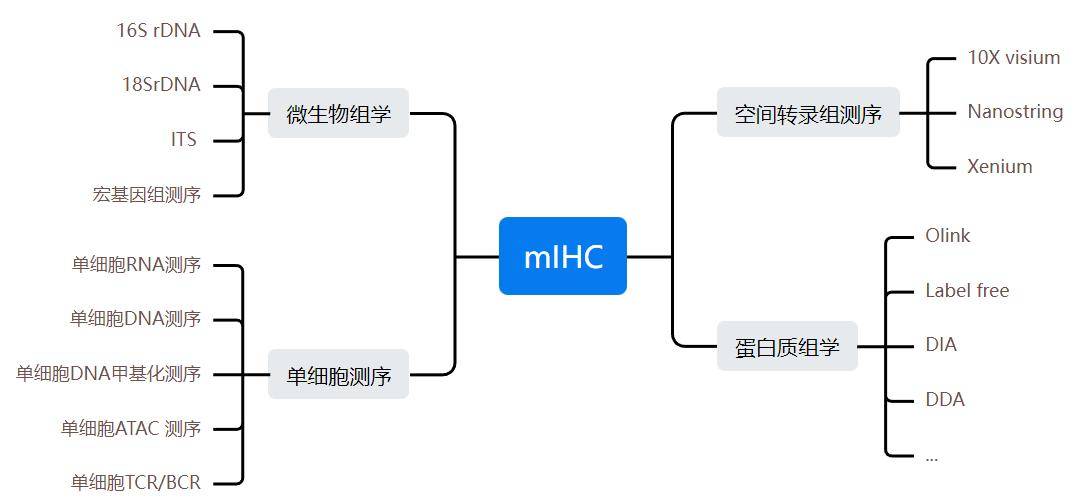
以下是一些多重荧光免疫组化分析(mIHC)赋能多组学的文献的案例分享
应用场景一:单细胞+mIHC

文章标题:The heterogeneous immune landscape between lungadenocarcinoma and squamous carcinoma revealed bysingle-cell RNA sequencing[1]
发表期刊:Signal Transduction and Targeted Therapy
影响因子:IF=38.104
发表时间:2022年8月
研究背景:
对非小细胞肺癌(NSCLC)患者免疫治疗策略的选择和临床反应的预测至关重要。本研究用单细胞RNA测序(scRNA-seq)技术及多重荧光免疫组化技术(mIHC)对肺腺癌(LUAD)和肺鳞状细胞癌(LUSC)这两种主要非小细胞肺癌亚型之间的不同免疫特征进行了描绘。
研究内容:
在这里,研究对来自19例NSCLC患者的40个肿瘤样本和匹配的邻近正常组织的72475个免疫细胞进行了scRNA-seq,并绘制了系统的免疫细胞转录组图谱。基于癌症基因组图谱(TCGA)的不同细胞组成、差异表达基因(DEGs)、细胞-细胞相互作用、伪时间轨迹、转录组因子和预后因素的联合分析,揭示了细胞毒性和效应T细胞和NK细胞以及不同功能巨噬细胞(Mφ)亚型在LUAD和LUSC之间免疫微环境异质性中的核心作用。在LUAD和LUSC中,Mφ的优势亚型分别为FABP4-Mφ和SPP1-Mφ。重要的是,发现了一个新的淋巴细胞相关的Mφ簇,将其命名为SELENOP-Mφ,并进一步确定了其在两种类型中的抗肿瘤作用,特别是在LUAD中。研究对免疫异质性的全面描述和Mφ簇的定义有助于在临床实践中为肺癌患者设计个性化的治疗方案。
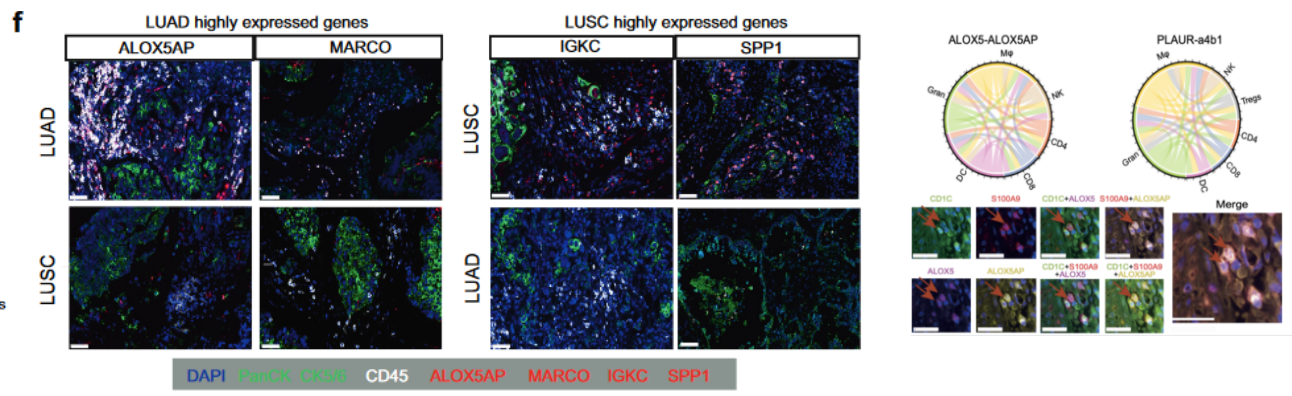
通过mIHC发现LUAD中的免疫调节信号相互作用比LUSC更丰富,经过数据分析,发现了一个新的亚群。为肿瘤微环境(TME)中肺癌临床工作流程的未来治疗靶点开发铺平道路。
应用场景二:单细胞+空间转录组+ mIHC

文章标题:Identification of a tumour immune barrier in the HCCmicroenvironment that determines the efficacy of immunotherapy[2]
发表期刊:Journal of Hepatology
影响因子:IF=30
发表时间:2023年
研究背景:肿瘤微环境(TME)是癌症进展和治疗结果的重要中介。在多种癌症中,TME亚型与患者对免疫治疗的反应相关。大多数先前的研究都集中在不同细胞成分在TME中与免疫治疗疗效相关的作用。但是,具体的结构
TME及其在免疫治疗疗效中的作用在很大程度上仍然未知。
研究内容:
研究人员将空间转录组学(ST),单细胞RNA测序(scRNA-seq)和抗PD -1治疗的肝细胞癌(hepatocellular carcinoma,HCC)患者的多重荧光免疫组化(mIHC)结合起来,揭示了与免疫治疗疗效相关的TME中的特定空间结构。研究结果揭示了肿瘤免疫屏障(tumour immune barrier,TIB)结构,这是一个由位于肿瘤边界附近的SPP1+巨噬细胞和癌症相关成纤维细胞(cancer-associated fibroblasts,CAFs)组成的空间生态位,与免疫检查点封锁(immune checkpoint blockade,ICB)治疗的有效性有关。
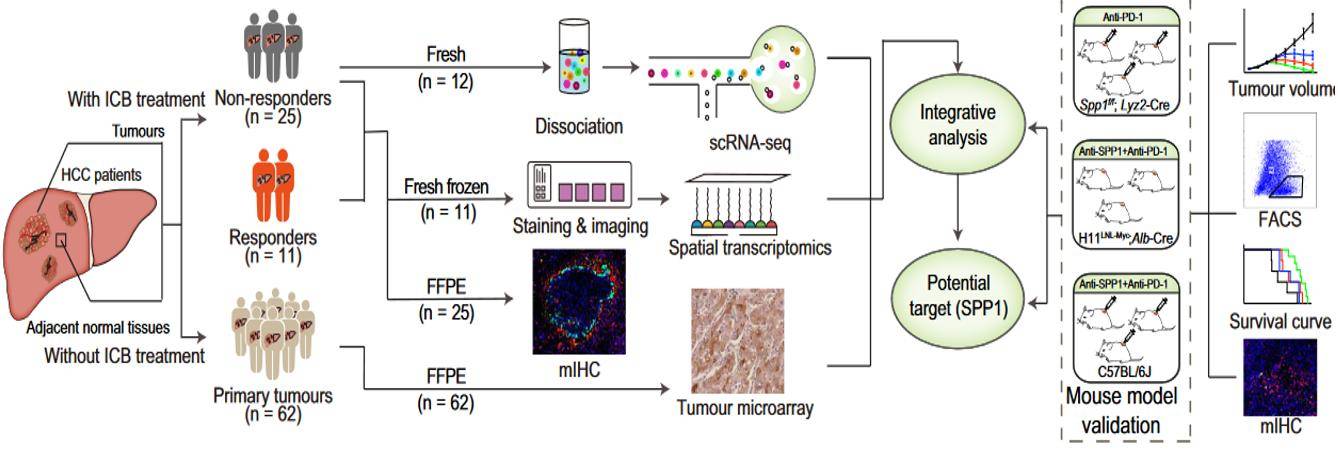
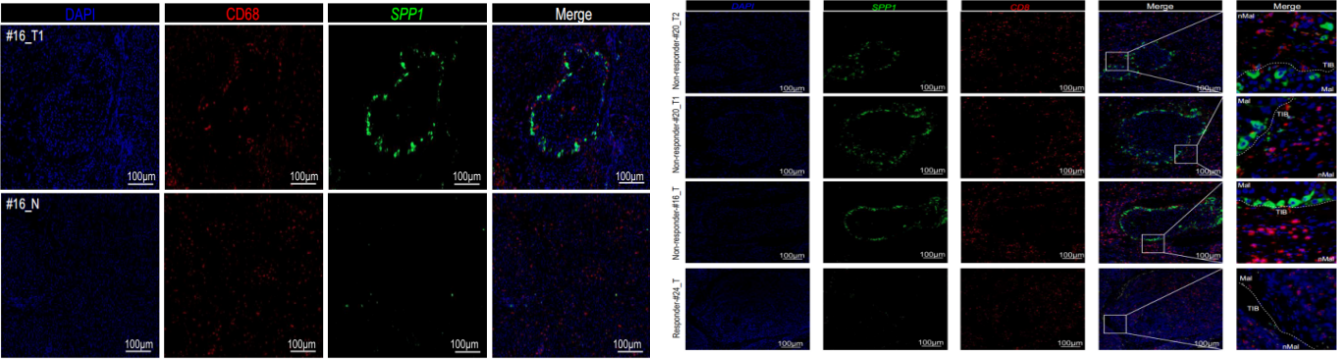
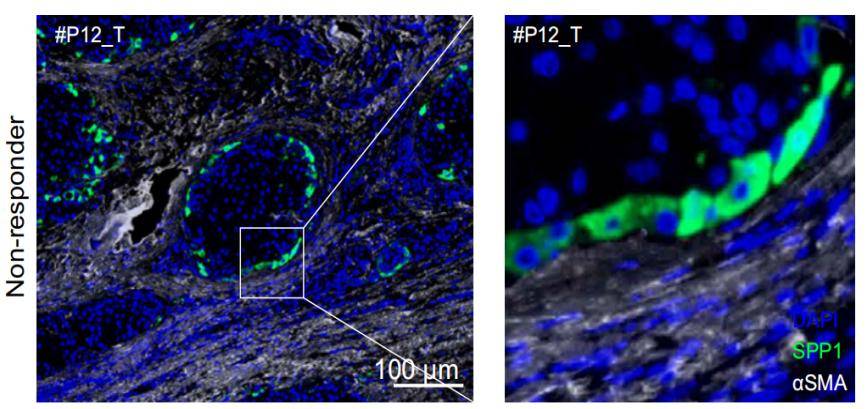
通过mIHC的染色结果显示 免疫治疗无响应的患者肿瘤周围存在TIB结构,进而对免疫疗效进行更加精准的评估
应用场景三:蛋白质组(OLINK)+mIHC

文章标题:A Randomized Trial of Combined PD-L1 and CTLA-4 Inhibition with Targeted Low-Dose or Hypofractionated Radiation for Patients with Metastatic Colorectal Cancer[3]
发表期刊:Clinical cancer research
影响因子:IF=11.5
发表时间:2021年
研究背景:关于PD-L1/CTLA-4联合阻断治疗的不同辐射剂量的安全性、有效性和免疫影响,缺乏前瞻性的人体数据。
研究内容:该文章进行了一项多中心II期研究,将转移性微卫星稳定的结直肠癌患者随机分配到不同的辐射剂量治疗组(重复低剂量分次照射法(LDFRT)或低分次照射法(HFRT))中,并伴随PD-L1 / CTLA-4抑制剂治疗,主要终点是放疗区域外的响应。研究中使用了多种研究方法,包括多重荧光免疫组化(mIHC),Olink(肿瘤-免疫Panel 和 炎症Panel)进行细胞相关样品的分析。特别是结合Olink高通量蛋白定量的功能和多重免疫荧光空间定位的功能,来检测治疗过程中循环系统和肿瘤微环境的变化。
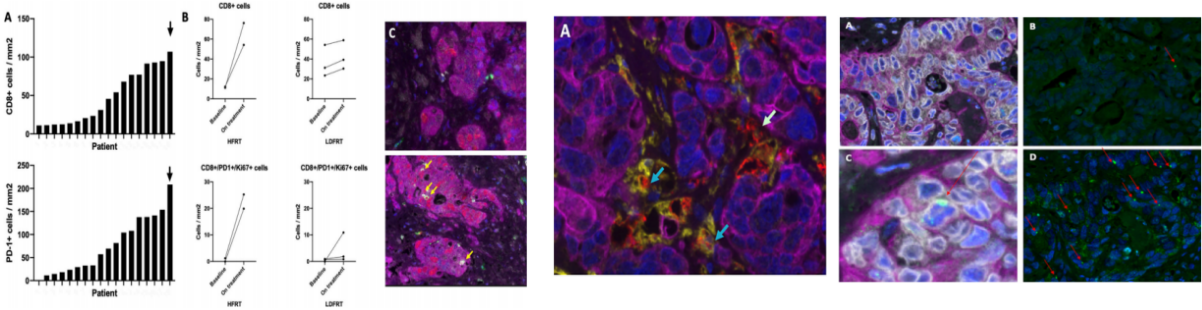
通过mIHC,作者发现在经过HFRT治疗的患者,其CD8+单阳和CD8+ / PD-1+ / Ki-67+三阳性细胞的数量有了显著提升,其巨噬细胞中M1/M2的比值都出现了下降,而经过LDFRT治疗的3位患者其对应M 1/M2比值都出现了上升。利用Olink联合多重荧光免疫组化对于肿瘤微环境在治疗前后的变化做了更全面的评估,结合可以更好的为疗效评估服务。
应用场景四:宏基因组+mIHC

文章标题:Multi-kingdom gut microbiota analyses definebacterial-fungal interplay and microbial markers of pan-cancer immunotherapy across cohorts[4]
期刊:cell host & microbe
影响因子IF=31.316
发表时间:2023年11月
研究背景:
肿瘤免疫检查点抑制剂是癌症治疗领域的一项重大突破,但令人遗憾的是,只有极少数癌症患者对这种治疗方法产生积极反应。最近几年,研究已经证明肠道细菌的种类和数量可以影响癌症患者对免疫检查点抑制剂(ICB)的疗效。然而,由于肠道细菌谱在不同地理位置和人群中存在较大的差异,先前的研究结果并不一致。为解决这一问题,研究人员进行了综合分析,试图确定哪些细菌能够在不同研究中普遍用于预测免疫检查点抑制剂的应答,但结果并不令人满意。此外,真菌在维护宿主免疫系统和稳定肠道内环境方面扮演着重要角色,但其与免疫检查点抑制剂的应答关系尚不明确。
研究内容:
这项研究汇集了来自不同国家和不同肿瘤类型的9个宏基因组队列,对包括真菌和细菌在内的微生物组进行了全面分析,并成功筛选到用于预测免疫检查点抑制剂应答的真菌和细菌标志物。通过构建随机森林模型,研究人员能够相对准确地预测肿瘤患者对免疫检查点抑制剂的应答情况,而真菌表现出更优异的预测效能,甚至超过了细菌。此外,当结合细菌和真菌的标志物进行预测时,效果最佳。研究发现,在接受ICI治疗之前,与PD-1阻断非应答者相比,PD-1阻断应答者通常表现出较高水平的耗竭型CD8 T细胞,且这些细胞表达较高水平的PD-1和/或CTLA-4。
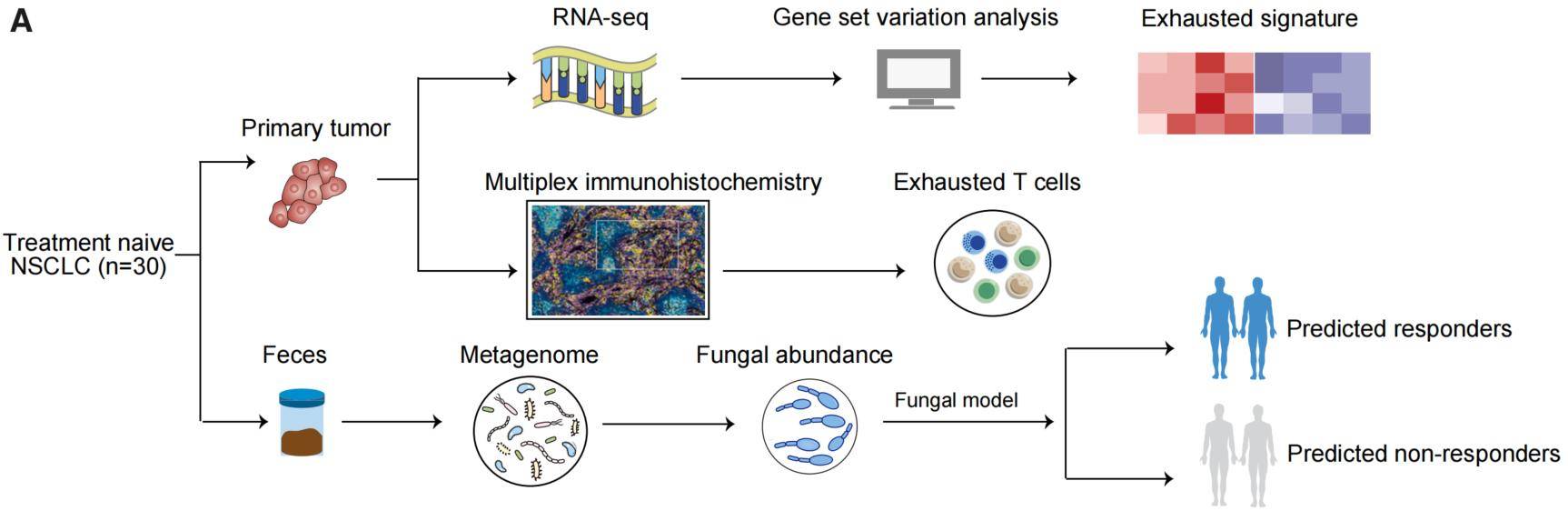
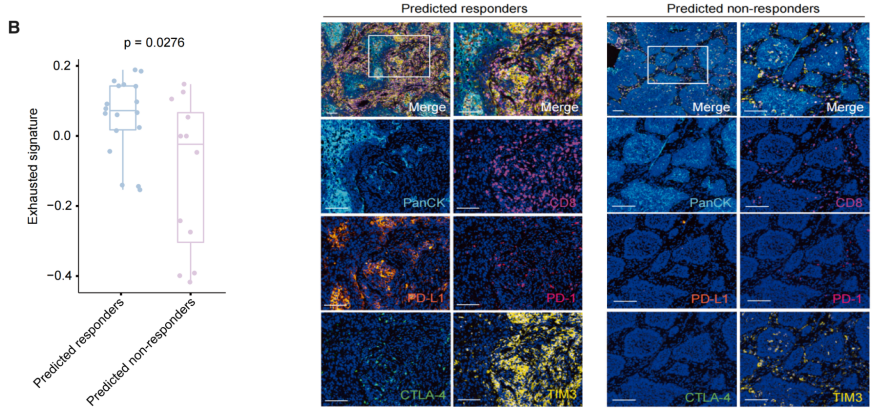
通过mIHC,发现真菌标记预测的响应者比非响应者表达更高的耗竭标志物(PD-1,PD-L1,CTLA-4和TIM-3),肿瘤微环境的免疫特征与已发表文献结论一致,进一步证实真菌是ICI反应的强力预测因子。
小结
阔然生物以多重荧光免疫组化为核心技术壁垒,布局了仪器设备、试剂、软件和服务的肿瘤微环境检测整体解决方案,依托于自主研发Kreep染色试剂、Krast自动染色机、KR-HT5高通量荧光病理切片扫描仪、KRIAS医学病理影像分析系统,可以针对不同癌种及组织类型进行检测方案定制。利用已有的研究成果,选取感兴趣的靶标,实现3-9色的高通量免疫荧光定量分析,进行组织微环境的研究;也可以针对客户已有的时空组学数据得到的靶标进行验证。
围绕多组学(包括单细胞测序、空间转录组测序、微生物组学、蛋白质组学等)技术结合多重荧光免疫组化技术在定量、原位等方面的优势进一步深入探索肿瘤微环境中细胞的异质性以及变化,以期为更精准的诊断、预后评估、治疗提供新方向。
[1] Signal Transduct Target Ther. 2022;7(1):289.
[2] J Hepatol. 2023;78(4):770-782.
[3] Clin Cancer Res. 2021;27(9):2470-2480.
[4] Cell Host Microbe. 2023;31(11):1930-1943.e4.

排版编辑:xiaodong











 苏公网安备32059002004080号
苏公网安备32059002004080号


