肝内胆管癌早期诊断困难,即便是接受了根治性手术切除,患者术后出现复发的风险依然较高,如何有效预测术后复发风险是重要临床问题。目前,基于人工智能的放射组学分析已越来越多地应用于肿瘤诊断、分期和评估。本期分享的这项研究采集我国不同区域中心的大量肝内胆管癌数据,并通过基于人工智能的CT放射组学方法预测其根治性切除术后1年内早期复发风险1。
胆管癌包括胆道系统中的多种恶性肿瘤,在解剖学上可分为肝内胆管癌、肝门周围胆管癌和远端胆管癌2,肝内胆管癌(ICC)的发病率呈上升趋势3。与肝外胆管癌不同,ICC很少引起黄疸,并且早期通常无症状4,这使得ICC的早期诊断变得困难。因此,只有约30%~40%的患者可以接受根治性手术切除5。此外,40%~80%的患者出现复发,其中44%在术后第一年被发现6。术前准确评估ICC患者的复发风险将有助于改善ICC患者的临床管理和预后。由于ICC的高度异质性,目前的AJCC第8版TNM分期系统仍然存在许多局限性7-9,这促使临床医生寻求更有效的预测工具。
动态增强CT通常用于ICC的检测和评估。然而传统上,诊断和预后评估很大程度上取决于医生对图像的个人评估,这不可避免地具有较强的主观性并且难以进行定量比较10。放射组学是一门将人工智能与影像分析相结合的综合学科,已越来越多地应用于肿瘤诊断、分期和评估等肿瘤学实践中11,12。然而,由于ICC是一种罕见肿瘤,以往的研究大多是单中心的,报告的病例数相对较少13,14。因此,需要进行多中心、大样本的研究。在这项研究中,研究者收集我国不同区域中心的大量ICC数据,并开发了一个术前模型,用于通过基于人工智能的CT放射组学方法预测ICC根治性切除术后1年内早期复发的风险。
研究结果
患者特征
该多中心研究纳入了我国八家医院在2008年1月至2020年12月期间接受根治手术切除的ICC患者。纳入标准包括(1)手术前1个月内进行了增强CT检查;(2)术后病理证实为ICC。排除标准为(1)没有术前CT数据;(2)之前接受过其他ICC治疗(包括介入治疗和消融等);(3)其他恶性肿瘤的病史;(4)失访,以及术后1年内是否发生复发未知的患者。共有311例病例被纳入该研究(图1)。患者被分成三个队列,其中队列1以8:2随机分为训练集(n = 140)和内部验证集(n = 36),而队列2(n = 74)和队列3(n = 61)分别作为两个独立的外部验证队列。
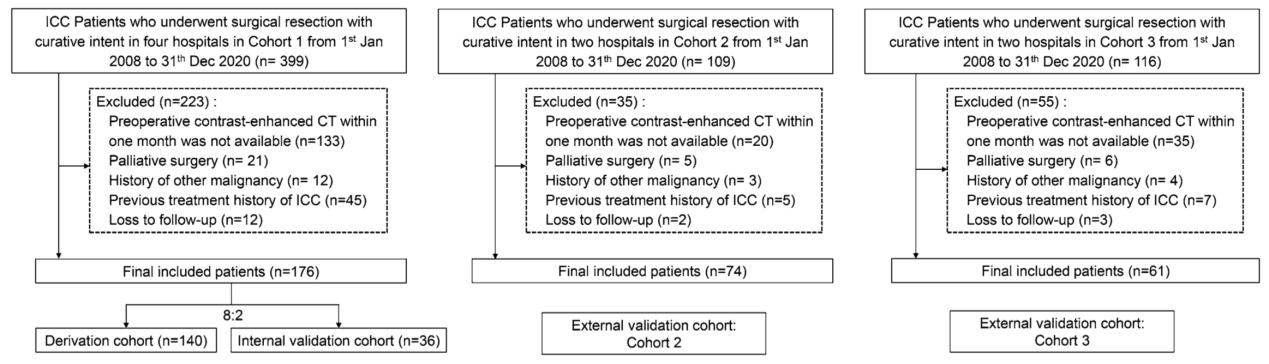 图1 患者纳入流程图
图1 患者纳入流程图
在所纳入的患者中,胆囊结石的发生率在队列3中相对更常见(65.6%),伴有相对较高的胆红素水平。其余临床特征在各中心之间没有统计学差异。大多数患者(87.1%)接受了R0切除术,各队列之间没有显著差异。中位随访时间为50周(IQR:28~106周),中位无复发生存时间约为45~50周,四个队列中的早期复发率没有差异(范围从47.2%到54.1%)。
临床特征选择及放射组学模型构建
在6296个放射组学特征中,有528个被认为不可靠并被排除,剩余特征通过mRMR算法排名留取了前100个特征。在经过递归特征消除以及交叉验证后最终保留了15个放射组学特征。采用LightGBM算法进行放射组学模型开发,在模型开发队列、内部验证队列和两个外部验证队列中,AUC值分别为0.877(95% CI 0.816-0.938)、0.780(95% CI 0.627-0.934)、0.751(95% CI 0.636-0.866)和0.739(95% CI 0.611-0.866)。
联合放射组学模型的构建及验证
单变量和多变量分析表明,CA19-9(>1000 U/ml)、血管侵犯和肿瘤边缘与早期复发独立相关,方差膨胀因子分别为1.8、1.7和1.5,表明这些变量之间没有多重共线性关系。于是研究者继续通过使用LightGBM算法结合以上三个临床特征,开发了组合放射组学模型。
如ROC曲线所示(图2 A-D),联合放射组学模型在模型开发队列、内部验证队列和两个外部验证队列中分别取得了最高的AUC值,分别为0.974(95% CI 0.946-1.000)、0.882(95% CI 0.672-0.962)、0.871(95% CI 0.786-0.955)和0.878(95% CI 0.797-0.960),且四个队列中的校准曲线显示出良好的一致性(图3 A-D),Hosmer-Lemeshow检验表明模型预测的复发概率与实际复发概率之间没有显著差异(p = 0.988、0.541、0.241和0.330),支持了该模型的准确性表现。
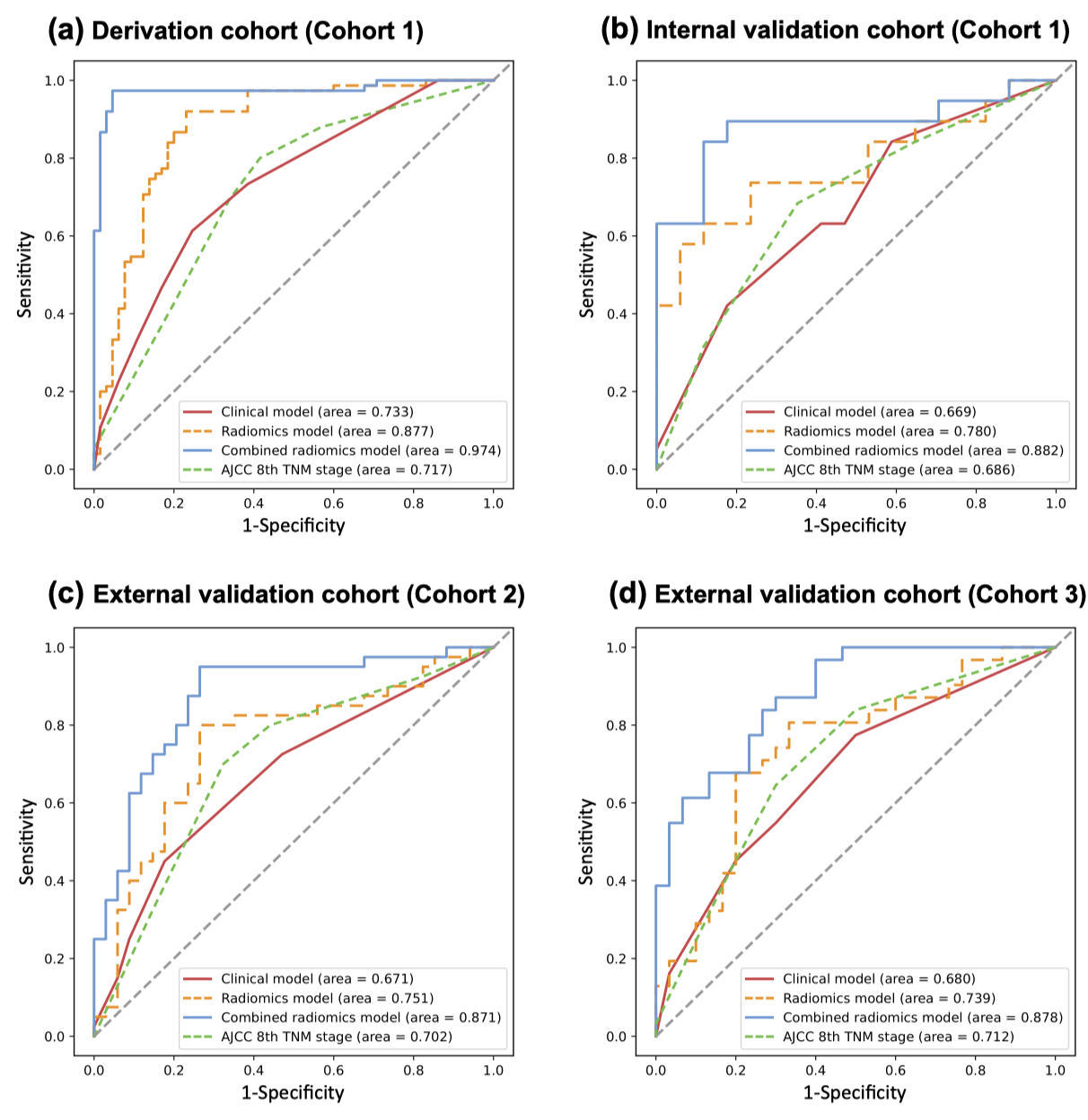 图2 不同模型之间ROC曲线的比较
图2 不同模型之间ROC曲线的比较
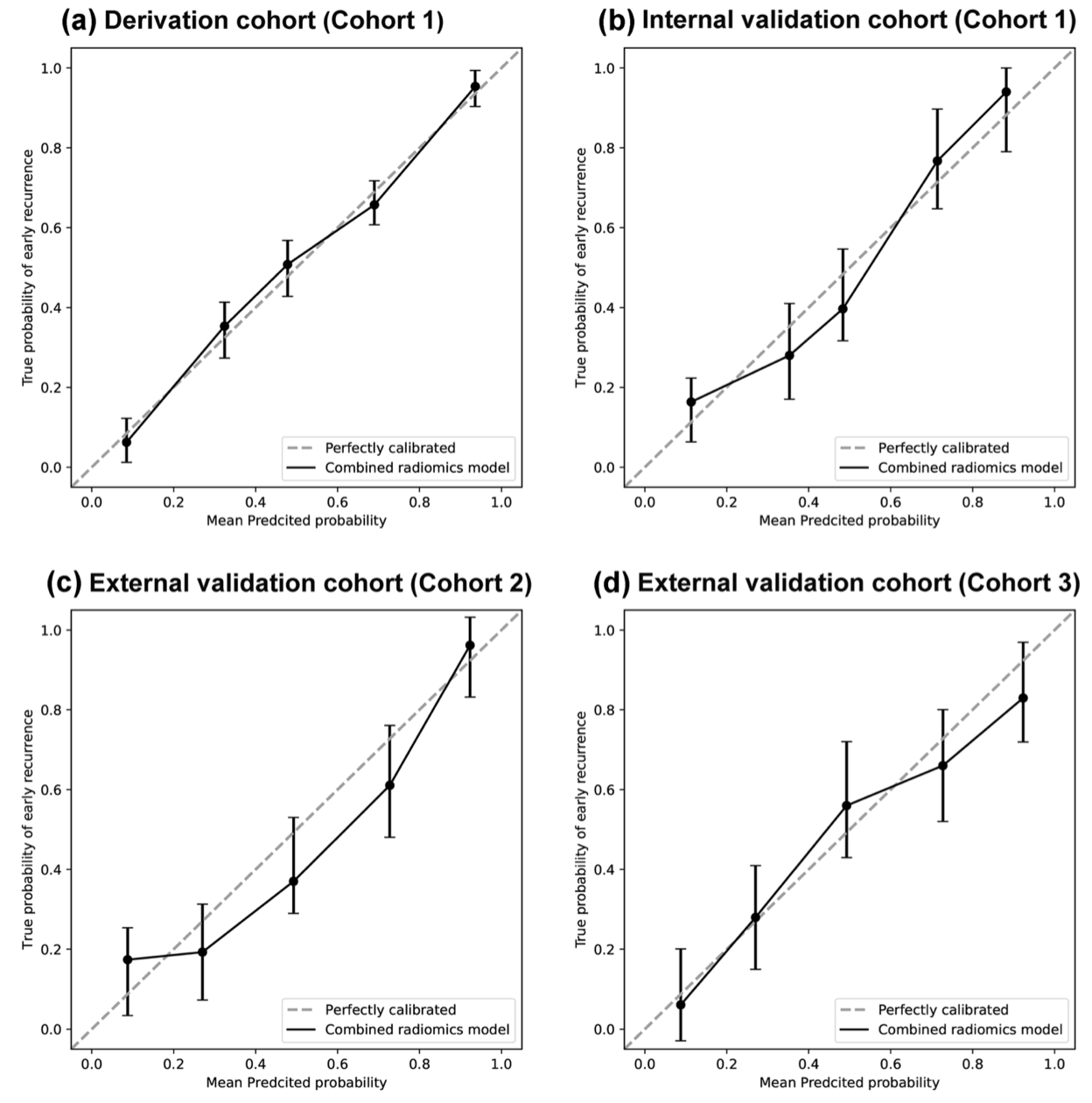 图3各个队列的校准曲线
图3各个队列的校准曲线
此外,三个验证队列中每个ROC曲线的比较也表明联合放射组学模型具有良好的稳定性和可重复性。随后,研究者还将联合放射组学模型与AJCC第8版TNM系统进行比较,结果显示在内部和外部验证队列中,联合放射组学模型的性能更好(图4)。联合放射组学模型的平均灵敏度在所有队列中平均可达到94.6%。
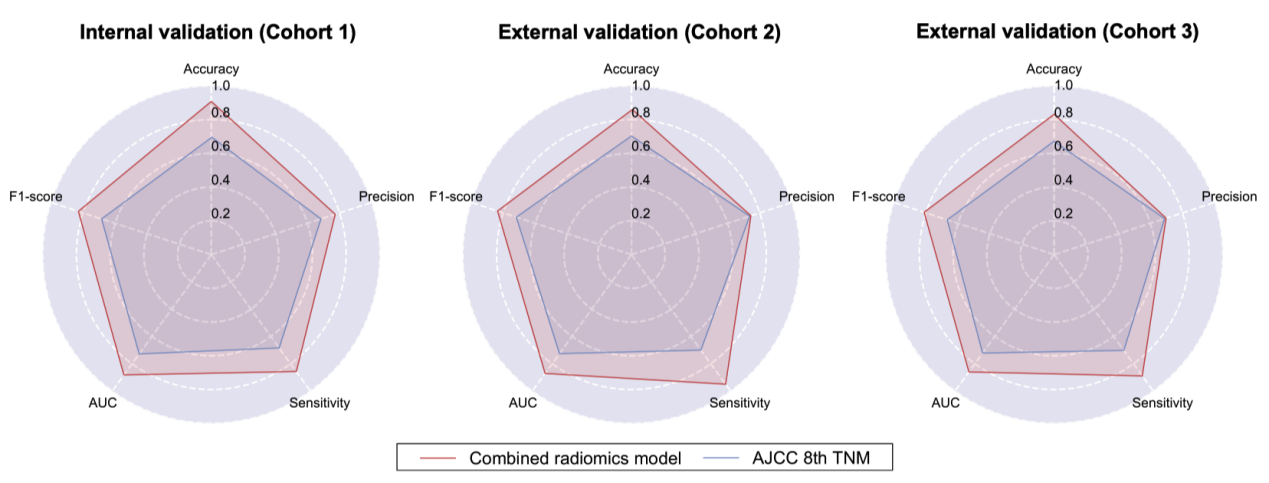 图4 联合放射组学模型和AJCC第8版TNM分期预测性能的可视化雷达图
图4 联合放射组学模型和AJCC第8版TNM分期预测性能的可视化雷达图
在临床应用方面,如图5所示,它可帮助临床医生术前识别高风险早期复发的一部分患者,并制定更好的治疗和随访计划,如早期联合新辅助化疗或缩短随访间隔,这将有助于降低早期复发的风险,改善患者的预后。
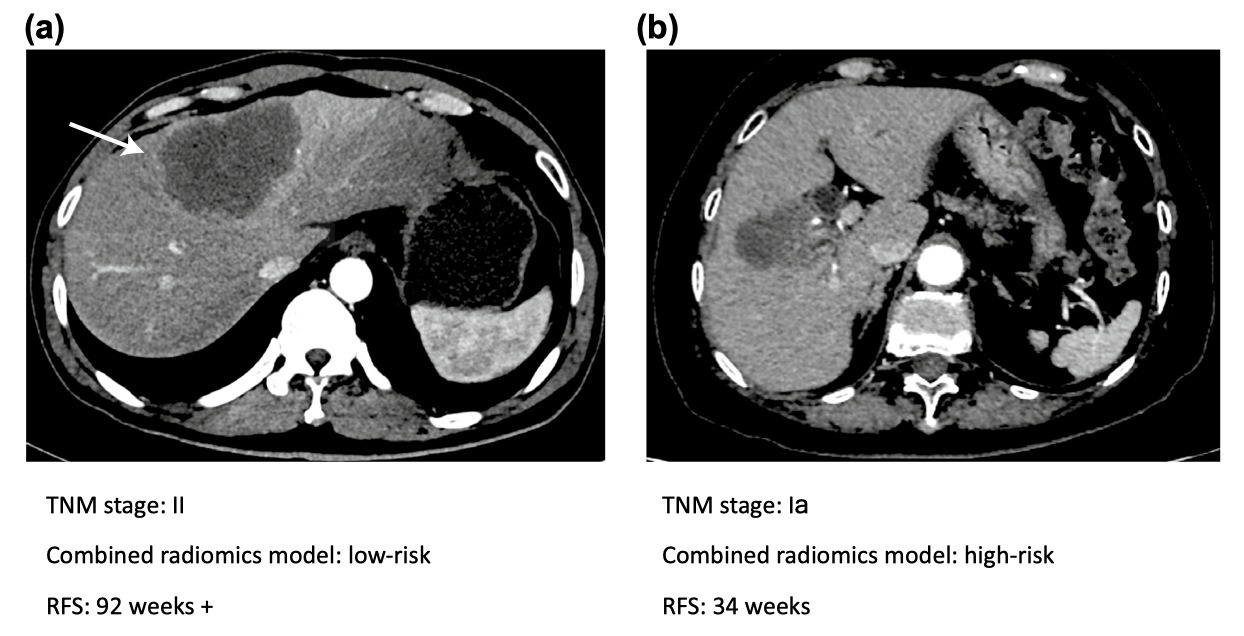 图5 ICC的代表性增强CT图像示例。
图5 ICC的代表性增强CT图像示例。
(a)一例48岁男性动脉期的CT图像显示,肝段IV有7.9cm×4.8cm的结节性病变,瘤周动脉增强(箭头)。术后病理显示血管浸润阳性,该患者的TNM分期为II期。使用联合放射组学模型,该患者被分为低风险患者,直到最后一次随访(92周),其都未复发。(b)一例74岁女性动脉期的CT图像显示肝V/VIII段有4.3cm×2.6cm的结节性病变,但没有明显的动脉增强。术后病理显示血管浸润阴性,TNM分期为Ia期。然而,使用联合放射组学模型,该患者被分为高危患者,肿瘤在术后34周复发。
研究讨论
在这项多中心研究中,研究者构建了一种使用LightGBM机器学习算法的联合放射组学模型,用于预测胆总管癌根治切除后的早期复发风险。该研究在单变量和多因素回归分析之后,最终选择了三个临床特征:CA19-9(> 1000 U/ml)、肿瘤血管侵犯和肿瘤边缘。后两个变量与既往的研究一致,被认为是术后复发的独立风险因素之一15,而CA19-9是否可以作为用于预测复发的独立风险因素目前仍存在争议。
使用这个强大的模型,所有队列中共有149例患者被确定为高复发风险,占实际早期复发患者的94.6%,只有5.1%的患者被该模型漏诊。
该研究同样存在一定缺陷。首先,该研究选择了CT图像进行分析,然而MR在肝胆疾病中也引起了越来越多的关注,特别是MRCP和MR特定序列16,17。其次,本研究选择了非对比和动脉期基础图像进行分析,理论上,与全相CT图像模型相比,可能会降低一定的预测性能。第三,考虑到图像分割的准确性,研究者采用手动分割,但这不可避免地需要更多时间。随着人工智能技术的发展,引入自动分割可能进一步提高未来的实际临床应用。第四,研究仅评估了311例中国ICC患者,无法评估不同种族患者,需要国际多中心的进一步验证来验证主要发现。
1.Song, Y. et al. Artificial intelligence CT radiomics to predict early recurrence of intrahepatic cholangiocarcinoma: a multicenter study. Hepatol Int 17, 1016-1027, doi:10.1007/s12072-023-10487-z (2023).
2.Bridgewater, J. et al. Guidelines for the diagnosis and management of intrahepatic cholangiocarcinoma. J Hepatol 60, 1268-1289, doi:10.1016/j.jhep.2014.01.021 (2014).
3.Saha, S. K., Zhu, A. X., Fuchs, C. S. & Brooks, G. A. Forty-Year Trends in Cholangiocarcinoma Incidence in the U.S.: Intrahepatic Disease on the Rise. Oncologist 21, 594-599, doi:10.1634/theoncologist.2015-0446 (2016).
4.Endo, I. et al. Intrahepatic cholangiocarcinoma: rising frequency, improved survival, and determinants of outcome after resection. Ann Surg 248, 84-96, doi:10.1097/SLA.0b013e318176c4d3 (2008).
5.Weber, S. M. et al. Intrahepatic cholangiocarcinoma: resectability, recurrence pattern, and outcomes. J Am Coll Surg 193, 384-391, doi:10.1016/s1072-7515(01)01016-x (2001).
6.Zhang, X. F. et al. Early versus late recurrence of intrahepatic cholangiocarcinoma after resection with curative intent. Br J Surg 105, 848-856, doi:10.1002/bjs.10676 (2018).
7.Mavros, M. N., Economopoulos, K. P., Alexiou, V. G. & Pawlik, T. M. Treatment and Prognosis for Patients With Intrahepatic Cholangiocarcinoma: Systematic Review and Meta-analysis. JAMA Surg 149, 565-574, doi:10.1001/jamasurg.2013.5137 (2014).
8.Lee, A. J. & Chun, Y. S. Intrahepatic cholangiocarcinoma: the AJCC/UICC 8th edition updates. Chin Clin Oncol 7, 52, doi:10.21037/cco.2018.07.03 (2018).
9.Sirica, A. E. et al. Intrahepatic Cholangiocarcinoma: Continuing Challenges and Translational Advances. Hepatology 69, 1803-1815, doi:10.1002/hep.30289 (2019).
10.Lambin, P. et al. Radiomics: extracting more information from medical images using advanced feature analysis. Eur J Cancer 48, 441-446, doi:10.1016/j.ejca.2011.11.036 (2012).
11.Huang, Y. Q. et al. Development and Validation of a Radiomics Nomogram for Preoperative Prediction of Lymph Node Metastasis in Colorectal Cancer. J Clin Oncol 34, 2157-2164, doi:10.1200/jco.2015.65.9128 (2016).
12.Nie, K. et al. Rectal Cancer: Assessment of Neoadjuvant Chemoradiation Outcome based on Radiomics of Multiparametric MRI. Clin Cancer Res 22, 5256-5264, doi:10.1158/1078-0432.Ccr-15-2997 (2016).
13.Liang, W. et al. Novel Nomogram for Preoperative Prediction of Early Recurrence in Intrahepatic Cholangiocarcinoma. Front Oncol 8, 360, doi:10.3389/fonc.2018.00360 (2018).
14.Zhu, Y. et al. Radiomics-based model for predicting early recurrence of intrahepatic mass-forming cholangiocarcinoma after curative tumor resection. Sci Rep 11, 18347, doi:10.1038/s41598-021-97796-1 (2021).
15.Wang, Y. et al. Prognostic nomogram for intrahepatic cholangiocarcinoma after partial hepatectomy. J Clin Oncol 31, 1188-1195, doi:10.1200/jco.2012.41.5984 (2013).
16.Jhaveri, K. S. & Hosseini-Nik, H. MRI of cholangiocarcinoma. J Magn Reson Imaging 42, 1165-1179, doi:10.1002/jmri.24810 (2015).
17.Zou, X. et al. Volumetric Apparent Diffusion Coefficient Histogram Analysis in Differentiating Intrahepatic Mass-Forming Cholangiocarcinoma From Hepatocellular Carcinoma. J Magn Reson Imaging 49, 975-983, doi:10.1002/jmri.26253 (2019).
*材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-125304
有效期至:2024/12/5
排版编辑:肿瘤资讯-小葛











 苏公网安备32059002004080号
苏公网安备32059002004080号


