
原发性中枢神经系统(CNS)肿瘤是儿童癌症的第二大病因,约占所有儿童癌症诊断的四分之一[1-3],目前以手术和放/化疗为主要治疗手段,但仍有术后复发和放/化疗后长期影响神经认知功能的局限性。神经营养酪氨酸受体激酶(NTRK)基因融合已被证实为原发性中枢神经系统肿瘤(CNS)的致癌驱动基因之一,在成人原发性CNS中的发生率约2%[4-6],在儿童高级别胶质瘤(HGG)和低级别胶质瘤(LGG)中的发生率则分别高达5.3%和2.5%[6],尤其好发于3岁以下和非脑干HGG患儿[7-9]。
拉罗替尼(Larotrectinib)是一种高选择性TRK抑制剂,已获批用于治疗携带NTRK融合基因的成人和儿童实体瘤患者。既往的临床研究证实,拉罗替尼对伴脑转移的NTRK融合原发性实体瘤具有抗肿瘤活性,那么拉罗替尼治疗NTRK融合突变的原发性CNS肿瘤效果如何?在今年的美国神经肿瘤学会(SNO)年会上,一项关于《拉罗替尼对TRK融合阳性的原发性CNS肿瘤的疗效和安全性》的研究[10]更新了长期随访数据[11],进一步明确了拉罗替尼有良好的血脑屏障穿透性且安全性良好。此外,今年的SNO年会上还公布了一项探索拉罗替尼在大样本人群中长期有效性和安全性的真实世界研究(ON-TRK),以期为TRK融合肿瘤患者的治疗决策提供参考。本文特邀北京同仁医院医院张伟令教授就这两项研究进行解读,以飨读者。
专家解读
首都医科大学附属北京同仁医院儿科
主任医师 副教授 硕士生导师
中国抗癌协会小儿血液肿瘤分会委员
北京抗癌协会小儿血液肿瘤分会委员
中国研究型医院学会儿科肿瘤专业委员会常委
中华医学会儿科学分会精准医学委员会委员
北京医学会儿科分会委员
中国优生科学协会罕见病及精准医学组委员
妇幼健康研究会儿科能力建设专委会委员
北京医学会罕见病分会委员
国家远程医疗与互联网医学中心肿瘤专家委员会副主任委员
当代中医药发展研究中心基层中医药工作委员会委员
中国生物医学工程学会靶向治疗技术分会儿童肿瘤精准治疗专委会常委
世界华人医师儿科协会血液与肿瘤专家委员会委员
北京市儿童血液病恶性肿瘤专家委员会委员
国家自然基金评审专家库成员
研究速览:拉罗替尼对TRK融合阳性的原发性CNS肿瘤的疗效和安全性
研究方法
本研究数据来自2项临床试验,分别为SCOUT研究(I/II期,NCT02637687)和NAVIGATE研究(II期,NCT02576431),受试者均为TRK融合阳性的原发性CNS患者。对于成人和儿童患者,拉罗替尼的给药剂量分别为每次100 mg(每日2次)和每次100 mg/m2(不超过100 mg,每日2次),持续服用直至疾病进展、撤回知情、出现不可接受的毒副反应或无临床获益。主要研究终点为研究者根据RANO或RECIST v1.1评估的客观缓解率(ORR),次要终点为反应持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)、安全性。
研究结果
截至2022年7月,共41例TRK融合的原发性CNS肿瘤患者纳入分析,其中HGG为25例(61%),LGG为9例(22%),其他类型为7例(17%),中位年龄为11岁(范围1-79),有35例患者(85%)既往接受过全身治疗(图1)。值得注意的是,在全部患者中,检测出30个独特的NTRK融合基因伴侣,其中大多数和NTRK2有关(n=28,68%,图2)。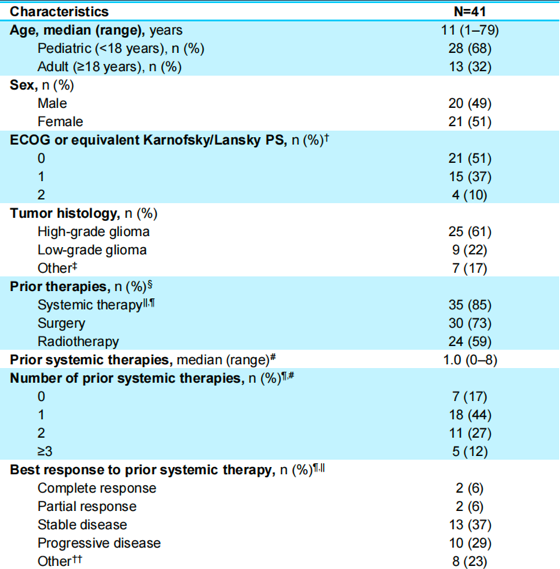
图1 患者基线特征
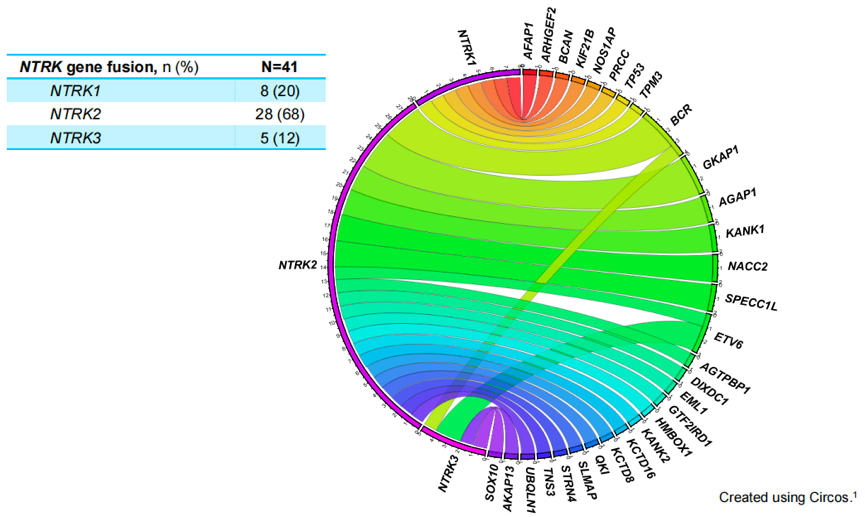
图2 NTRK融合基因伴侣分布
在全部41例可评价疗效的患者中, 28例儿童经RANO评估的总体ORR为29%(95% CI:13~49)、24周DCR为71%(95% CI:37~69),其中14例儿童HGG的ORR为14%(95% CI:2~43)、24周DCR为71%(95% CI:42~92),7例儿童LGG的ORR为57%(95% CI:18~90)、24周DCR为100%(95% CI:59~100,图3);13例成人经RANO评估的总体ORR为8%(95% CI:0~36)、24周DCR为15%(95% CI:2~45,图4)。
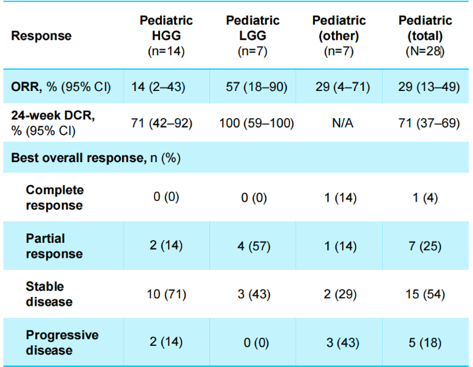
图3 儿童经RANO评估的ORR、24周DCR
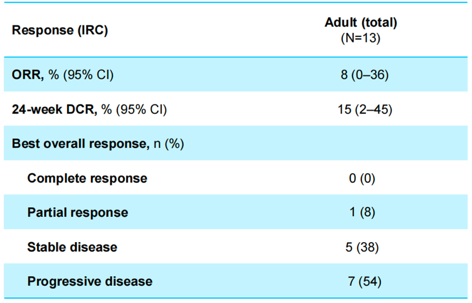
图4 成人经RANO评估的ORR、24周DCR
对于所有患者,治疗持续时间从1到50+个月不等,中位缓解时间为1.9个月(范围 1.0~3.7个月),儿童和成人的中位缓解持续时间分别为12.2个月(中位随访27.3个月)和11.1个月(中位随访时间未评估);在数据截止时,仍有13例患者(32%)在接受治疗,共有15例患者(37%)接受治疗超过24个月(图5)。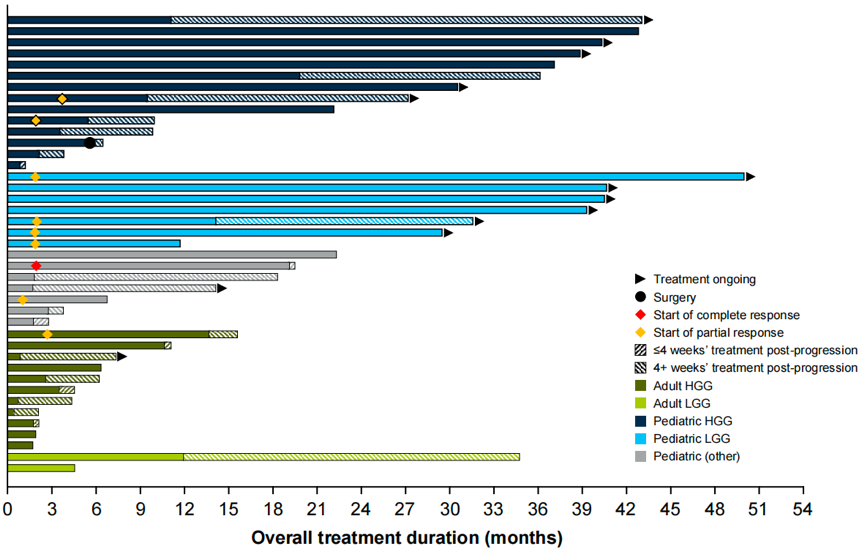
图5 所有患者的治疗持续时间
对于儿童和成人患者,中位 PFS 分别为19.1个月(95% CI:95.6~NE)和2.6个月(95% CI:1.6~12.0),中位OS分别为未达到(95% CI:33.6~NE)和16.9个月(95% CI:2.9~22.4);对于HGG和LGG患儿,中位PFS分别为15.5个月(95% CI:3.6~37.3)和未达到(95% CI:14.1~NE),中位OS均未达到(95% CI分别为:10.8~NE,NE~NE,图6) 。治疗相关不良事件(TRAE)多为1级或2级,没有患者因TRAE导致治疗中断。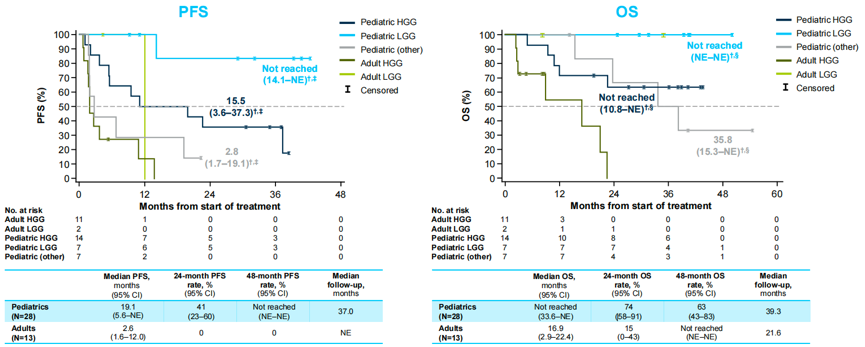
图6 儿童和成人患者的PFS和OS
研究速览:探索拉罗替尼治疗TRK融合阳性实体瘤的非干预性真实世界研究(ON-TRK)
由于TRK融合阳性肿瘤相对罕见且迄今为止接受治疗的患者数量相对较少,因此需要拉罗替尼在更大人群中开展真实世界研究,来进一步证实拉罗替尼的长期有效性和安全性。在2023 SNO大会上,一项探索拉罗替尼治疗TRK融合阳性实体瘤的非干预性真实世界研究(ON-TRK)公布了研究设计,旨在明确拉罗曲替尼在局部晚期或转移性TRK融合阳性实体瘤患者中的安全性和有效性。这项开放标签、全球、多队列、前瞻性研究计划纳入300例患者,分为≥18岁成人和<18岁儿童2组人群,覆盖CNS肿瘤、头颈肿瘤、肺部肿瘤、软组织肉瘤、胃肠道肿瘤、黑色素瘤、儿童肿瘤等多个类型的瘤种。
专家解读
中枢神经系统(CNS)肿瘤约占所有恶性肿瘤的3%,但在儿童和青少年中分别是第二、第三常见的肿瘤类型[12,13]。目前,手术仍是首选治疗方法,但对于部分恶性程度较高的肿瘤(如2年PFS率仅约20%的HGG[14,15]),可能会由于患病部位特殊而无法手术,或因无法切除干净而复发。此外,放/化疗也是CNS肿瘤的主要治疗方法之一,但化疗的毒副作用和放疗对神经功能的影响也导致了临床进行治疗决策时具有局限性[16,17]。因此,临床迫切需要能够穿透血脑屏障且有效安全的治疗方法,例如极具针对性的靶向治疗。
TRK受体主要在神经元组织中表达,与细胞增殖、分化、代谢、凋亡等密切相关,在神经系统的正常发育和功能中发挥着重要作用[18-21]。当编码酪氨酸激酶结构域的NTRK基因的3'区域通过染色体内或染色体间重排与融合伴侣基因的5'端框内连接时,就会发生NTRK基因融合,由此产生的融合癌基因会导致保留酪氨酸激酶结构域的嵌合蛋白表达,并驱动下游信号传导[22]。
拉罗替尼(Larotrectinib)是一种新型的口服小分子药物,具有高选择性且不限癌种,对TRK具有较好的抑制作用,主要用于携带NTRK基因融合的儿童和成人实体瘤的治疗。由于拉罗替尼不限癌种,全球诸多研究者对其开展了系列研究来明确其在各个癌种中的有效性和安全性。其中,一项既往在非CNS实体瘤患者的整合数据集分析显示,无论年龄和肿瘤类型如何,研究者评估的持久ORR均为79%;其中12例脑转移患者的ORR为75%,3例基线可测量的脑转移肿瘤体积缩小率分别为14%、46%和100%,揭示了拉罗替尼良好的血脑屏障穿透性[23]。而且,截至研究数据截止日,有69%的患者仍在接受治疗或已经接受了治愈性手术治疗,体现了拉罗替尼的抗肿瘤活性强且持久[23]。
本研究的结果进一步证实了拉罗替尼在穿透血脑屏障方面的能力,为原发性CNS肿瘤患者带来新的治愈希望。在本研究中,几乎所有的完全缓解(CR)和部分缓解(PR)都发生在儿童患者,因此对于这部分患儿而言,拉罗替尼是一种极具价值的治疗选择,或可延迟或避免放疗和化疗带来的不良影响,甚至可作为辅助治疗为患儿保留神经功能,并避免这些患儿进行可能导致神经衰弱的完整肿瘤切除术或侵入性手术。此外,本研究有71%的患儿疾病控制至少持续了24周,进一步证实了拉罗替尼的疗效不仅快速,而且持久。
不过,鉴于本次分析中纳入的患者数量(尤其是成人)较少,目前很难就成人和儿童患者之间观察到的疗效得出有差异的结论。儿童脑肿瘤以胶质瘤和胚胎性肿瘤为主,与成人患者的病理分布有所不同,且儿童神经胶质瘤与成人神经胶质瘤在生物驱动因素、DNA拷贝数和潜在遗传改变等分子因素上亦有不同[8,9,24,25]。此外,如IDH、H3.3 和 TP53等TRK融合阳性神经胶质瘤伴随突变的频率,似乎会随着年龄的增长而增加[26]。虽然这些潜在的混杂因素可能导致成人和儿童患者对拉罗替尼的反应存在差异,但仍需要未来扩大人群来进一步明确。
本研究中还观察到一个有比较意思的现象。既往在大多数实体瘤中,基因融合事件似乎在NTRK1和NTRK3中更常见,而在NTRK2中相对少见[22,27-29]。但在脑肿瘤中,本研究却提示NTRK2基因融合是最常见的类型。值得注意的是,BCR、NACC2、SPECC1L、AGAP1和GKAP1是该研究中确定的复发性NTRK2融合伴侣。目前尚不清楚特定的融合伴侣是否会影响拉罗替尼的疗效,未来可以开展相关研究来进一步证实。
综上所述,拉罗替尼对TRK融合阳性原发性中枢神经系统肿瘤有效,在低级别/高级别神经胶质瘤以及非胶质瘤患者中均观察到了肿瘤缓解和持续的疾病控制,且耐受性良好。基于既往和现有的临床数据,《NCCN儿童中枢神经系统肿瘤指南(2023年v1版)》推荐拉罗替尼作为NTRK基因融合阳性的复发或进展性CNS儿童肿瘤患者的优选治疗方案,2021年发布的《加拿大儿童患者TRK融合肿瘤的生物标志物检测和治疗共识》中也建议不可手术或存在远处转移的NTRK基因融合阳性的高级别神经胶质瘤患儿考虑使用拉罗替尼一线治疗[30]。此外,在2023 SNO大会上公布的大型真实世界研究(ON-TRK),也将进一步证实拉罗曲替尼在TRK融合阳性实体瘤患者中的长期有消息和安全性。相信随着未来越来越多的研究开展,拉罗替尼将造福更多TRK融合肿瘤患者。
[1] Siegel RL, et al. Cancer statistics, 2020. CA Cancer J Clin 2020 Jan;70(1):7-30.
[2] Ramadeep SA, et al. Age-incidence patterns of primary CNS tumors in children, adolescents, and adults in England. Neuro Oncol. 2009 Aug;11(4):403-13.
[3] Lacour B, et al. Incidence of childhood cancer in France: National Children Cancer Registries, 2000-2004. Eur J Cancer Prev. 2010 May;19(3):173-81.
[4] Ferguson SD, Zhou S, Huse JT, et al. Targetable gene fusions associate with the IDH wild-type astrocytic lineage in adult gliomas. J Neuropathol Exp Neurol. 2018;77(6):437–442.
[5] Gatalica Z, Xiu J, Swensen J, Vranic S. Molecular characterization of cancers with NTRK gene fusions. Mod Pathol. 2019;32(1):147–153.
[6] Okamura R, Boichard A, Kato S, Sicklick JK, Bazhenova L, Kurzrock R. Analysis of NTRK alterations in pan-cancer adult and pediatric malignancies: implications for NTRK-targeted therapeutics. JCO Precis Oncol. 2018; 2018. PO.18.00183.
[7] Wu G, Diaz AK, Paugh BS, et al. The genomic landscape of diffuse in trinsic pontine glioma and pediatric non-brainstem high-grade glioma. Nat Genet. 2014;46(5):444–450.
[8] Guerreiro Stucklin AS, Ryall S, Fukuoka K, et al. Alterations in ALK/ ROS1/NTRK/MET drive a group of infantile hemispheric gliomas. Nat Commun. 2019;10(1):4343.
[9] Clarke M, Mackay A, Ismer B, et al. Infant high-grade gliomas comprise multiple subgroups characterized by novel targetable gene fusions and favorable outcomes. Cancer Discov. 2020;10(7):942–963.
[10] François Doz et al. Efficacy and safety of larotrectinib in TRK fusion-positive primary central nervous system tumors. Neuro-Oncology. 24(6), 997-1007, 2022.
[11] 2023 SNO. Abstract待补充.
[12] American Cancer Society. Cancer Facts & Figures 2019. American Cancer Society. Atlanta, GA.
[13] Irvine L, et al. Public Health England, 2018. Accessed May 14, 2020.
[14] Gottardo NG, et al. Chemotherapy for malignant brain tumors of childhood. J Child Neurol. 2008 Oct;23(10):1149-59.
[15] Baker SJ, et al. Pediatric gliomas as neurodevelopmental disorders. Glia. 2016 Jun;64(6):879-95.
[16] Lafay-Cousin L, Strother D. Current treatment approaches for infants with malignant central nervous system tumors. Oncologist. 2009;14(4):433–444.
[17] El-Ayadi M, Ansari M, Sturm D, et al. High-grade glioma in very young children: a rare and particular patient population. Oncotarget. 2017;8(38):64564–64578.
[18] Amatu A, Sartore-Bianchi A, Siena S. NTRK gene fusions as novel targets of cancer therapy across multiple tumour types. ESMO Open. 2016;1(2):e000023.
[19] Cocco E, Scaltriti M, Drilon A. NTRK fusion-positive cancers and TRK inhibitor therapy. Nat Rev Clin Oncol. 2018;15(12):731–747.
[20] Reichardt LF. Neurotrophin-regulated signalling pathways. Philos Trans R Soc Lond B Biol Sci. 2006;361(1473):1545–1564.
[21] Huang EJ, Reichardt LF. Neurotrophins: roles in neuronal development and function. Annu Rev Neurosci. 2001;24:677–736.
[22] Vaishnavi A, Le AT, Doebele RC. TRKing down an old oncogene in a new era of targeted therapy. Cancer Discov. 2015;5(1):25–34.
[23] Hong DS, DuBois SG, Kummar S, et al. Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol. 2020;21(4):531–540.
[24] Jones C, Karajannis MA, Jones DTW, et al. Pediatric high-grade glioma: biologically and clinically in need of new thinking. Neuro Oncol. 2017;19(2):153–161.
[25] Ryall S, Tabori U, Hawkins C. Pediatric low-grade glioma in the era of molecular diagnostics. Acta Neuropathol Commun. 2020;8(1):30.
[26] Torre M, Vasudevaraja V, Serrano J, et al. Molecular and clinicopathologic features of gliomas harboring NTRK fusions. Acta Neuropathol Commun. 2020;8(1):107.
[27] Drilon A, Laetsch TW, Kummar S, et al. Efficacy of larotrectinib in TRK fusion-positive cancers in adults and children. N Engl J Med. 2018;378(8):731–739.
[28] Kummar S, Lassen UN. TRK inhibition: a new tumor-agnostic treatment strategy. Target Oncol. 2018;13(5):545–556.
[29] Stransky N, Cerami E, Schalm S, Kim JL, Lengauer C. The landscape of kinase fusions in cancer. Nat Commun. 2014;5:4846.
[30] 中国抗癌协会小儿肿瘤专业委员会, 中国研究型医院学会儿童肿瘤专业委员会. 《拉罗替尼治疗TRK融合儿童肿瘤中国专家共识》.











 苏公网安备32059002004080号
苏公网安备32059002004080号


