多重荧光免疫组化(mIHC)技术,是下—代病理(NGP)技术的典型代表。基于酪胺信号放大原理,可以在一张FFPE组织切片中进行多种标志物染色,通过各种标志物在细胞上的单表达或者共表达,识别不同细胞亚群;结合智能分析软件,统计各个组织区域中细胞类型、 密度、空间位置关系等信息。目前,mIHC是研究的热点技术,受到诺贝尔生理学奖得主、 免疫学家James P.Alison教授等众多学者的青睐,在肺癌、肝癌、 肾癌等多癌种领域都发表了重磅成果。
2022年,《中国肺癌杂志》的《基于分子标志的非小细胞肺癌术后复发预测专家共识》指出,多重荧光免疫组化技术已经成为肿瘤微环境的重要研究手段之一,肿瘤微环境相关免疫细胞可能与NSCLC患者术后复发相关,但尚需更多研究以明确其预测复发的意义。因此,我们就来盘点下2023年发表的肺癌mIHC经典文献。
预后评估


研究背景
通过空间表型研究恶性肿瘤细胞与肿瘤相关免疫细胞之间的相互作用,对于识别肿瘤进展、复发或转归的可能因素至关重要。
研究解读
一项研究设计了5个多重荧光免疫组化(mIHC)检测panel,涉及23种标志物,刻画了225例I-III期原发性非小细胞肺癌(NSCLC)患者的肿瘤微环境,探究免疫细胞分布模式对NSCLCs预后的影响。研究结果显示了两种细胞分布模式:一种主要与免疫保护细胞有关的非混合模式,另一种主要与免疫抑制细胞有关的混合模式。距离分析表明,表达免疫检查点的T细胞比其他细胞更接近恶性细胞。结合细胞分布模式和细胞距离,确定了与炎症和非炎症肿瘤相关的四种分布模式,且细胞分布模式和距离与患者的生存率有关。
该研究表明空间表型研究可以更好地了解肿瘤微环境及患者预后,为诊疗新策略的提出奠定了基础。
免疫耐药研究

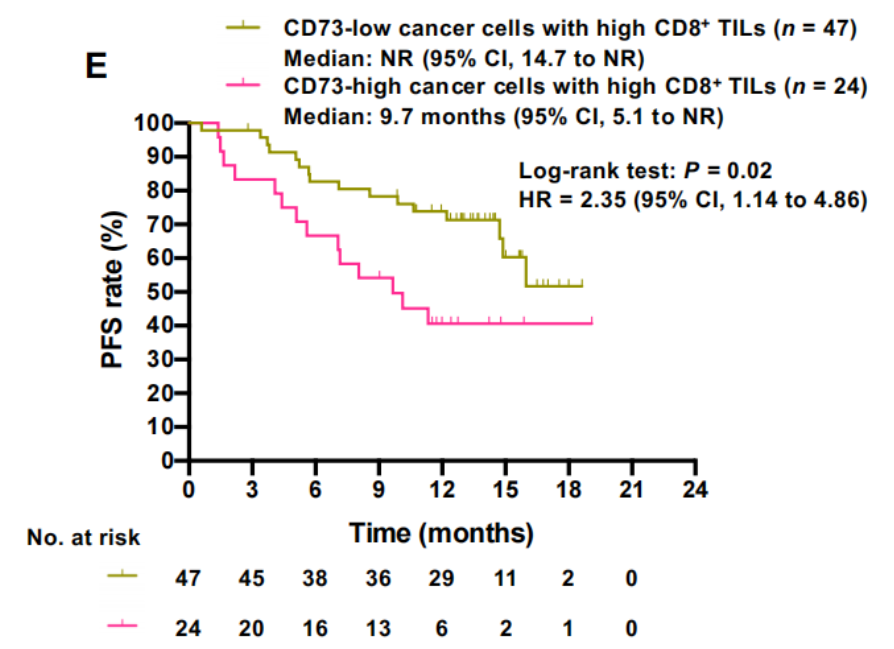
研究背景
同步放化疗后,采用度伐利尤单抗进行巩固治疗的PACIFIC方案是无法手术的III期非小细胞肺癌(NSCLC)患者的标准治疗方案。但是约一半的患者在1年内出现疾病进展,免疫耐药的机制尚不明确。
研究解读
一项研究共纳入135例接受PACIFIC方案的无法手术切除的III期NSCLC患者,对肿瘤微环境进行全面分析,通过多种生物标志物比较无进展生存期(PFS)。研究发现,肿瘤细胞上表达CD73有利于度伐利尤单药耐药,低密度的CD8+ T细胞和高密度的CD73+ 肿瘤细胞与度伐单抗预后差独立相关。配对肿瘤样本的全外显子组测序表明,由于新抗原的可塑性,癌细胞最终逃脱了免疫压力。
该研究强调了功能性适应性免疫在III期NSCLC中的重要性,并暗示CD73是一个有希望的治疗靶点,为开发NSCLC的新治疗方案奠定了基础。
免疫新辅助临床试验

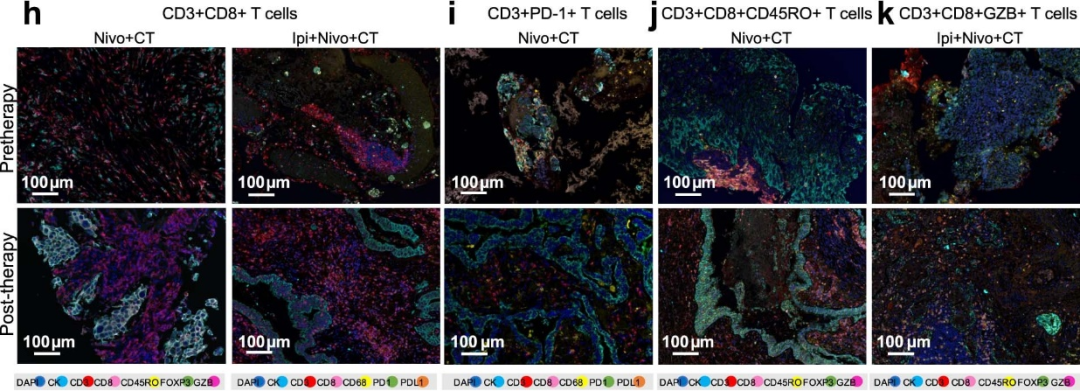
研究背景
在可手术的非小细胞肺癌(NSCLC)患者中,新辅助疗法Ipilimumab + Nivolumab (Ipi+Nivo)和Nivolumab +化疗(Nivo+CT),比单纯CT诱发更高的病理缓解率。新辅助Nivo+CT中加入Ipi的疗效尚不清楚。
研究解读
II期NEOSTAR试验以主要病理反应(MPR)为主要终点,测试新辅助Nivo+CT和Ipi+Nivo+CT疗效。研究表明,Nivo+CT组MPR率为32.1%,Ipi+Nivo+CT组MPR率为50%,两组均达到主要终点。在没有已知肿瘤EGFR/ALK突变的患者中,Nivo+CT组和Ipi+Nivo+CT组的MPR率分别为41.2%(7/17)和62.5%(10/16)。单细胞测序和多重荧光免疫组化等多技术平台分析了免疫细胞群的表型及浸润情况,包括效应记忆CD8+ T、B细胞以及三级淋巴结构,这些标志物在Ipi+Nivo+CT队列中显著增加。MPR患者的基线粪便微生物群富含有益类群,并显示促炎和致病微生物的丰度降低。该研究表明新辅助Ipi+Nivo+CT增强了可手术NSCLC的病理反应,值得进一步研究。
免疫治疗新靶点


研究背景
B细胞常以组织滤泡的形式存在于三级淋巴结构(TLS)的异位淋巴器官中,虽然TLS已被发现与改善患者生存和对免疫检查点阻断(ICB)的反应相关,但这种关联的潜在机制仍不清楚。
研究解读
通过研究来自TRACERx 421和其他肺癌队列患者以及免疫原性肺腺癌小鼠模型的肺驻留B细胞反应,发现人和小鼠肺腺癌都会引起局部生发中心反应和肿瘤结合抗体,并进一步确定内源性逆转录病毒(ERV)包膜糖蛋白是主要的抗肿瘤抗体靶点;揭示了肺腺癌引发下ERV靶向抗体的抗肿瘤活性,以及免疫检查点阻断(immune checkpoint blockade, ICB)、KRAS(G12C)靶向抑制对ERV靶向B细胞反应的放大作用。小鼠模型中有效的免疫治疗需要cxcl13依赖性TLS的形成;相反,治疗性CXCL13可增强抗肿瘤免疫并与ICB协同作用。
该研究为TLS与免疫治疗反应的关联提供了可能的机制基础。
肺癌脑转移

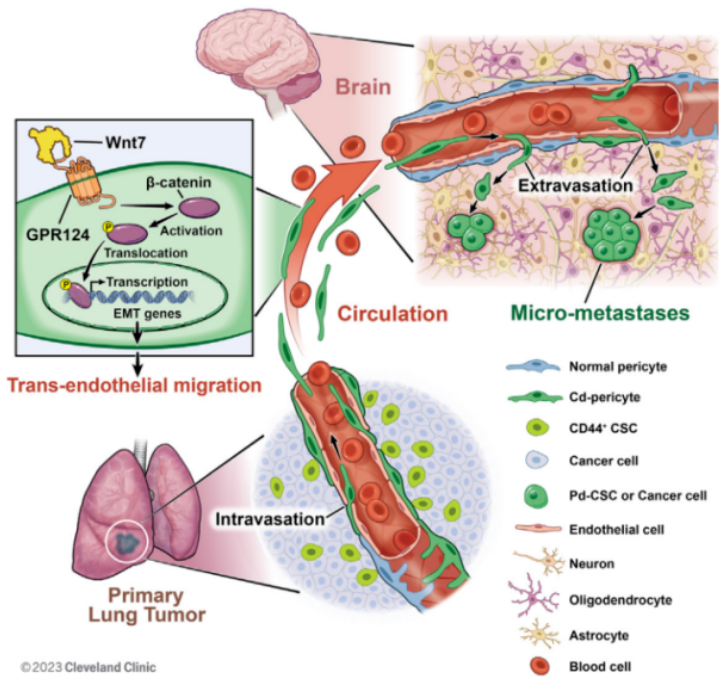
研究背景
肺癌脑转移导致高死亡率,约有30-50%的肺癌患者发生脑转移,但肺癌脑转移的发生机制尚不明确。
研究解读
肺腺癌(ADC)中来自CD44+干细胞(CSCs)的血管周细胞通过g蛋白偶联受体124(GPR124)增强的跨内皮迁移(TEM)有效地引起脑转移。在肺ADC中,血管周围壁龛中的CD44+CSCs产生了大部分的血管周细胞。CSCs衍生的周细胞样细胞(Cd-周细胞)表现出显著的TEM能力,可以有效地内渗到血管腔内,在循环中存活,外渗到脑实质,然后去分化为致瘤性CSCs形成转移灶。Cd-周细胞独特表达GPR124,激活Wnt7-β-catenin信号,增强Cd-周细胞的TEM内渗和外渗能力,这是肿瘤转移的两个关键步骤。此外,Cd-周细胞、GPR124或Wnt7-β-catenin信号的选择性破坏,可显著减少ADC的脑和肝转移。
该研究发现了肺癌转移的新靶点,有望显著降低肺癌的脑转移及其它远处转移风险。

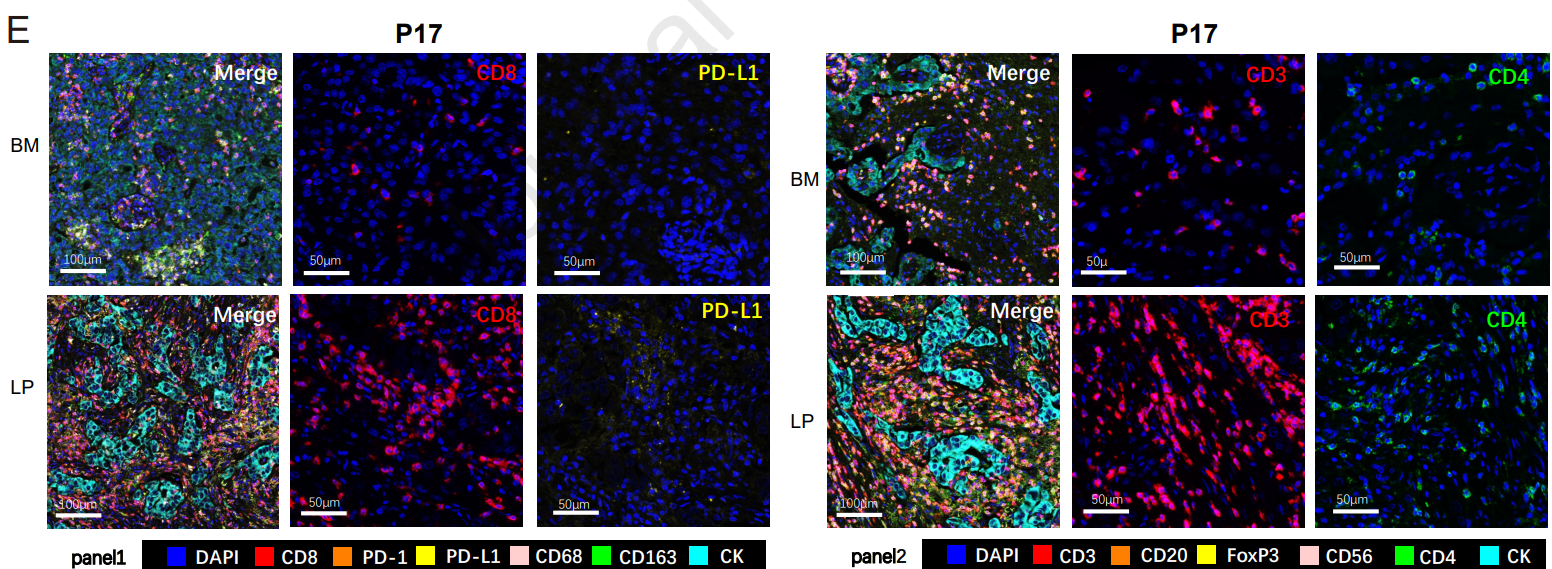
研究背景
脑转移是肺癌患者中发生率最高的转移类型,严重恶化预后并对临床管理构成挑战。迄今为止,脑转移如何逃避免疫清除尚不明确。
研究解读
该研究对30对配对的脑转移(BM)、原发性肺腺癌(LP)和正常组织进行了基因测序和多重荧光免疫组化(mIHC)检测。研究发现,基因组改变的肿瘤内异质性(ITH)在转移过程中起到关键作用。与肺癌原发灶相比,脑转移灶的瘤内异质性更高,免疫微环境更“冷”。该研究首次揭示了瘤内异质性与肿瘤免疫浸润水平呈负相关关系,发现瘤内异质性是肺癌脑转移的预后指标,瘤内异质性低的脑转移瘤患者总生存明显长于异质性高的患者。本研究结果为脑转移的转移过程和免疫逃逸机制提供了新的见解,为肺癌脑转移患者的精准免疫治疗策略铺平了道路。
阔然生物推出的一站式NGP肿瘤微环境检测方案,基于多重荧光免疫组化技术能够深入研究肺癌的肿瘤免疫微环境,探索肿瘤微环境与肺癌发生发展、复发、转移、耐药的关系,挖掘与肿瘤相关的预测性生物标志物,助力肿瘤病理诊断技术的进步。

排版编辑:肿瘤资讯-Lynn











 苏公网安备32059002004080号
苏公网安备32059002004080号


