▎药明康德内容团队编辑
在mRNA疫苗取得巨大成功之后,利用mRNA表达具有治疗作用的蛋白,开发mRNA疗法成为这一领域的下一个目标。然而,将mRNA转化为一种新治疗模式,造福罕见和常见病患者,仍然面临着一系列挑战。不过,科学家们正在开发一系列创新技术,系统性地解决这些挑战。日前,Nature Biotechnology上发表的一篇深度综述对解锁mRNA疗法潜力的四大要素进行了分析。

开发mRNA疗法与mRNA疫苗的不同之处
开发mRNA疗法与mRNA疫苗相比,需要克服额外的一系列挑战。因为,mRNA疫苗需要生产的蛋白水平很低,人体的免疫系统会通过细胞和抗体介导的免疫反应放大免疫信号。而mRNA疗法需要产生的蛋白水平可能需要达到mRNA疫苗的1000倍才能产生治疗效果。
很多情况下,mRNA疗法产生的蛋白需要与特定器官、组织或细胞中的信号通路发生相互作用,这意味着靶标细胞对疗法的吸收将决定蛋白表达水平和疗法的持久性。组织生物可利用度、血循环中的半衰期以及载体的靶向递送效率都可能成为限速因素。向肝脏以外的组织精准递送mRNA疗法仍然是一个挑战。
mRNA疗法的另一个挑战是重复给药。即使对mRNA进行了化学修饰优化并通过脂质纳米颗粒(LNP)递送,长期给药最终仍然会激发先天免疫反应,从而导致蛋白表达水平下降。
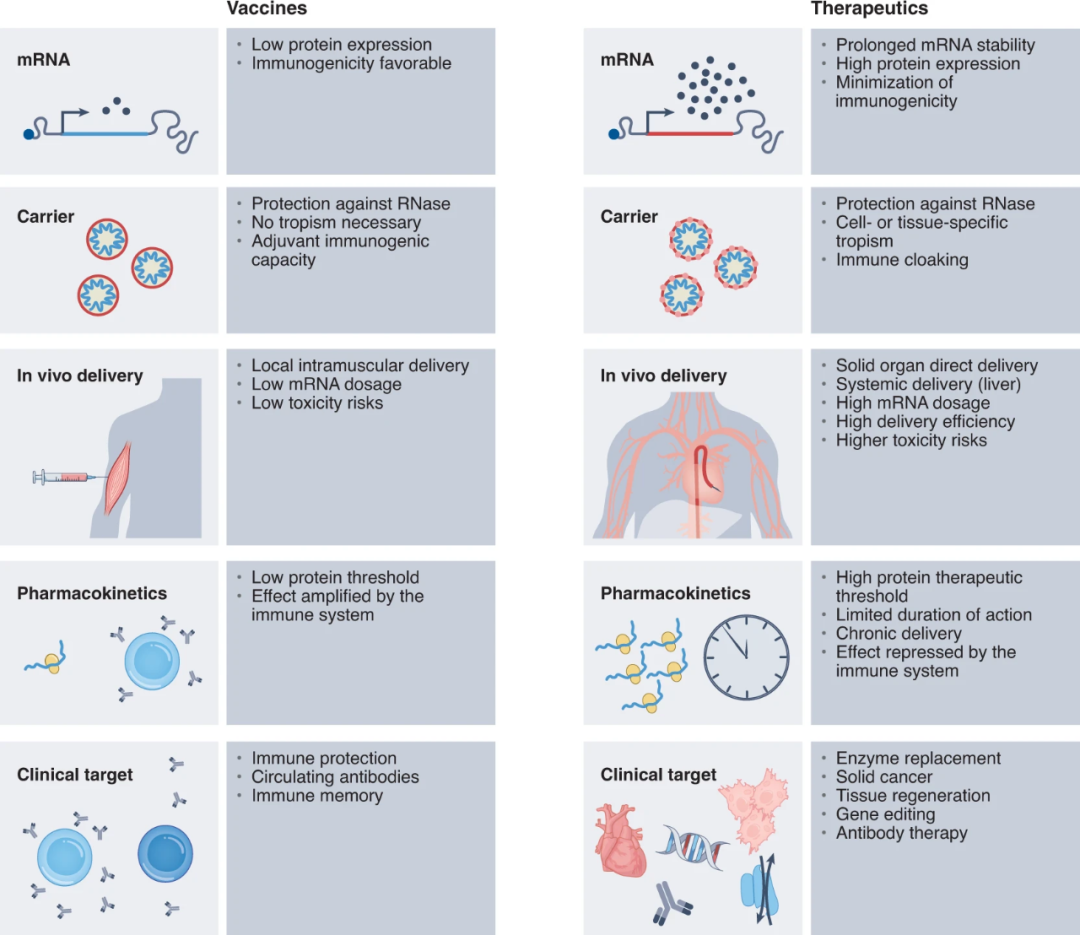
▲mRNA疗法与mRNA疫苗临床开发路径的不同(图片来源:参考资料[1])
增强蛋白表达水平的不同策略
mRNA的内在免疫原性虽然会增强其作为疫苗的效力,但是反而会阻碍它们作为疗法的效力。在小鼠模型中,mRNA作为酶替代疗法(ERT),通常需要比mRNA疫苗高50~1000倍的剂量才能获得治疗水平的蛋白表达。目前,科学家们正在使用多种策略优化mRNA疗法的设计,达到维持高水平蛋白表达的目的。这些策略包括:
对mRNA序列的优化
mRNA序列通常包括5’端帽(cap)、5’和3’端的非转录序列(UTR)、开放阅读框(ORF)和多聚腺苷酸化尾(poly-A tail)。每一个部分都可以通过优化来提高蛋白表达水平或mRNA的稳定性。优化mRNA序列方面最重要的突破之一是利用化学修饰的核苷来取代天然的核苷(特别是尿苷),这一技术可以显著降低mRNA被先天免疫系统识别的可能,提高了蛋白的表达水平。在这方面做出突出贡献的Katalin Karikó与Drew Weissman博士也在2021年获得拉斯克临床医学研究奖。由于mRNA序列中的尿苷比例对先天免疫反应有很大影响,即使不使用化学修饰的核苷,通过优化密码子,替换序列中的尿苷仍然能够获得降低免疫反应,提高蛋白表达的效果。

▲mRNA序列的不同部分都可以进行优化,提高蛋白表达水平(图片来源:参考资料[1])
在蛋白表达水平高低之外,限制mRNA疗法的一个重要因素是蛋白生产的持续时间较短,这意味着需要反复给药。目前,增强蛋白表达持久性的策略包括以下几种:
自我扩增mRNA(samRNAs)基于RNA病毒的自我扩增机制,可以在细胞质中诱导samRNA序列的复制。这一技术可以延长mRNA疗法的表达动力学,从而降低给药的频率。与传统线性mRNA相比,samRNA能够在剂量降低约10倍的情况下维持相似的蛋白表达水平。
另一种策略为环形RNA(circRNA),这一技术消除了线形RNA被外切酶识别的两端,显著提高了mRNA的稳定性。环形RNA半衰期的延长让它们在不提高蛋白表达水平的情况下,增加蛋白的总产量。而且,环形RNA显著降低了mRNA被先天免疫系统识别的可能。
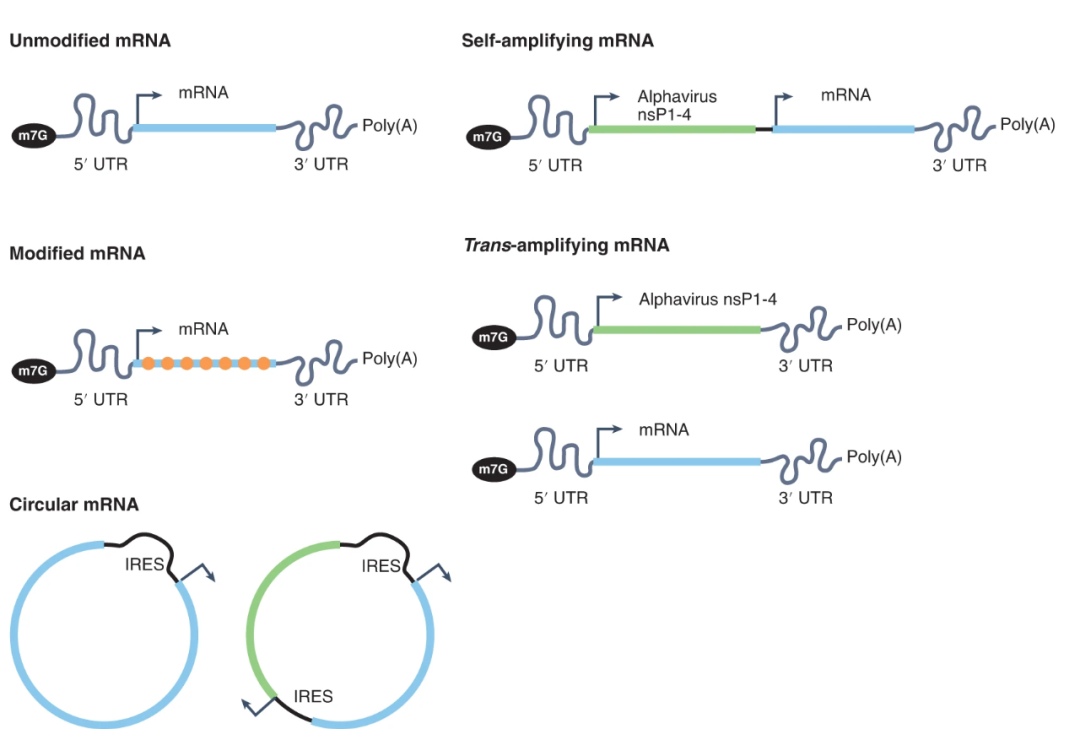
▲提高mRNA表达蛋白水平和持久性的不同策略(图片来源:参考资料[1])
这些策略之外,mRNA的纯化对其表达水平也有重大的影响。mRNA的合成过程可能产生不想要的副产物,比如双链RNA,没有端帽的mRNA或者mRNA片段。这些副产物都可能严重干扰mRNA的转译,激活先天免疫系统,或者导致对mRNA活性的误判。研究显示,对化学修饰或未经修饰的mRNA的纯化,在小鼠模型中分别增加蛋白表达超过400%和30%,凸显了纯化步骤的重要性。
载体递送系统
LNP递送系统
mRNA需要包装在载体中才能免于被核酸酶降解,并且穿过细胞膜被细胞吸收。目前大多数mRNA疗法的载体为LNPs。LNPs的发展已经有60多年的历史,它们最初被用于递送RNAi疗法。目前的LNPs主要由4种脂质组成,结构性脂质、胆固醇、可电离阳性脂质和隐匿脂质(stealth lipids)。结构性脂质构成LNPs的基本骨架,胆固醇的加入能稳定LNP结构并且调节它的膜流动性、可塑性和渗透性。阳离子脂质或可电离脂质协助将携带负电荷的mRNA包装进LNP。隐匿脂质主要为PEG偶联脂质,它们加入到LNP中可以降低它的免疫原性。不过有些人对PEG的超级敏感性可能限制它们的长期使用。
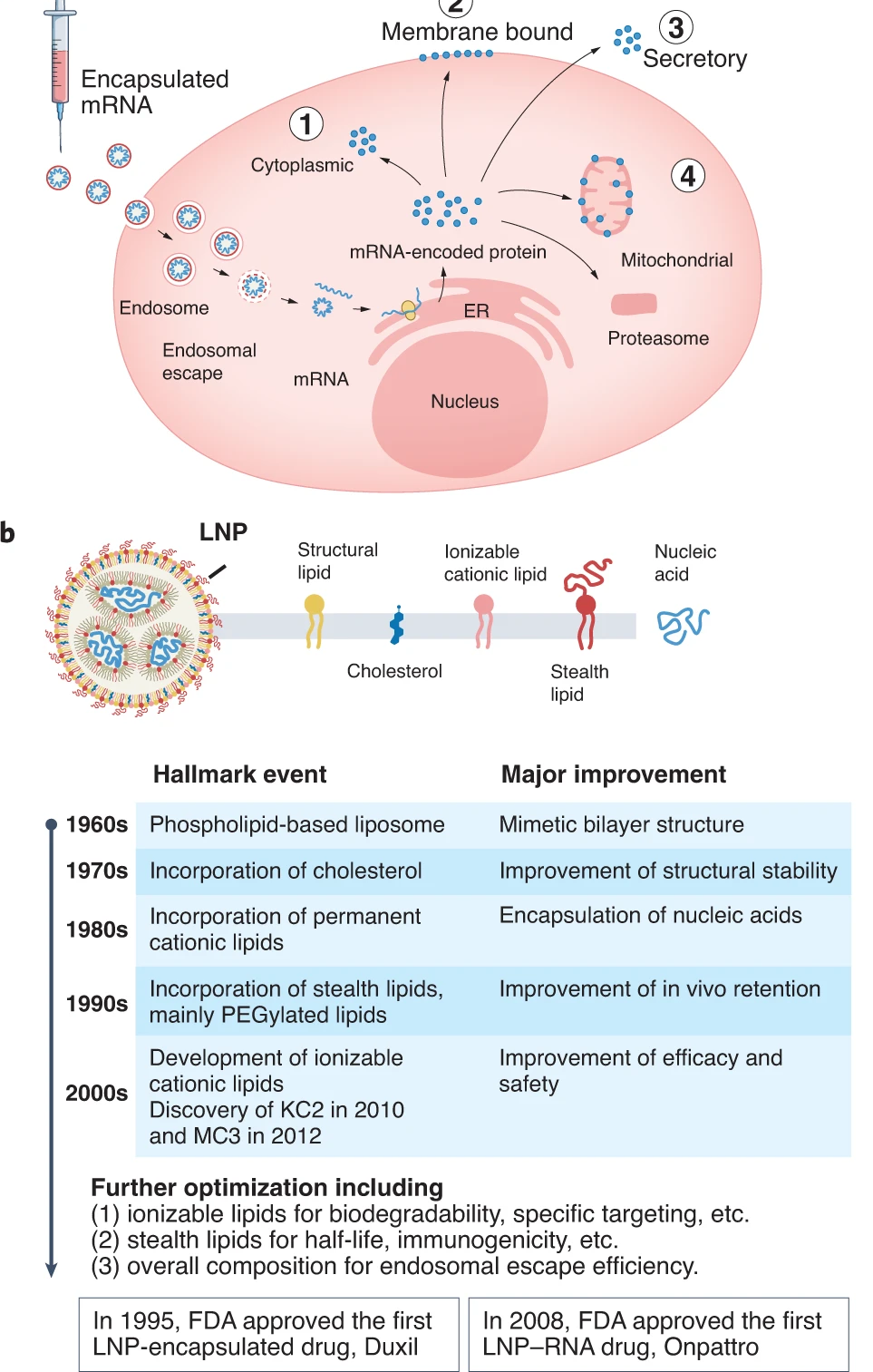
▲LNP的组成和开发里程碑(图片来源:参考资料[1])
LNP递送系统之外,另一种方法是使用细胞作为递送载体。这种方法在体外将mRNA引入到细胞中,然后将细胞注射到患者体内。这些细胞可以成为体内制造蛋白的工厂,与LNP递送手段相比,它们具有更好的生物相容性,在血液循环中的存在时间更长。免疫细胞、血细胞和间充质细胞等细胞类型都可以作为mRNA的载体。不过影响细胞疗法普及的因素也会影响这一递送手段的应用。比如制造流程繁琐,难于递送药物到细胞内。
细胞外囊泡递送系统
另一种递送策略是利用细胞外囊泡(EV)。细胞外囊泡是大部分细胞分泌的由细胞膜构成的囊泡,比如外泌体。这些囊泡可以携带蛋白或RNA、代谢产物等多种不同载荷。过去的研究显示它们在细胞之间的通讯方面起到重要作用。
细胞外囊泡的优势在于它们可能继承了产生它们的细胞的特征,比如血细胞分泌的细胞外囊泡可能保留了穿越血脑屏障的能力,而且已有研究显示这些囊泡的毒性很小,重复给药具有良好的耐受性。因此,它们可能成为可以重复给药的组织特异性递送方式。
不过这一策略需要解决的挑战是如何表征、分离和纯化细胞外囊泡,以及如何将载荷装到囊泡中去。目前的方法可以分为两类,一类是使用传统手段直接将载荷递送到纯化的囊泡中,包括电穿孔、超声、挤压或冻融循环。另一类方法是将载荷递送到生成囊泡的细胞中。
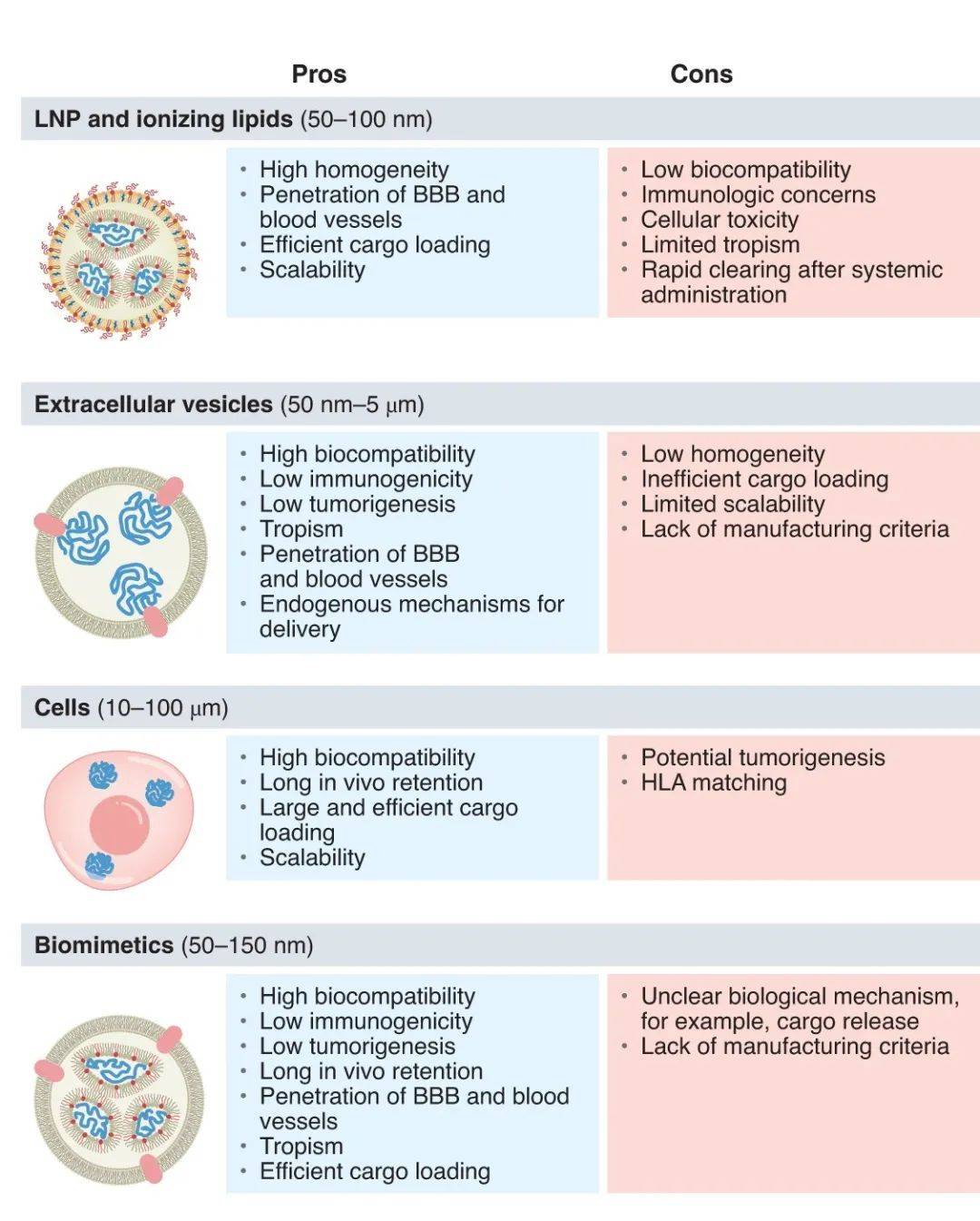
▲递送mRNA的不同载体系统的优势和需要解决的挑战(图片来源:参考资料[1])
生物模拟载体系统
最新药物递送技术的进展显示了生物模拟载体系统的潜力。这一系统结合生物颗粒和合成颗粒的特征,比如使用一个人工合成的核心(包括金纳米颗粒,LNP或者多聚体),它可以与载荷结合,然后在核心的外面再包一层细胞膜。这种系统降低了合成材料的免疫原性,而且根据生成细胞膜的细胞类型的不同,可以赋予载体靶向特定组织的能力,并且延长载体在血液循环中的稳定性。
另一种生物模拟的策略是使用生物学材料(比如细胞外囊泡)和合成材料(比如LNP)成分,构成一种杂合颗粒。这种颗粒同时具有LNP的可控生产流程和稳定承载能力,以及细胞外囊泡的生物兼容性和靶向特异性。比如,研究显示由外泌体和多聚体构成的杂合颗粒在血循环中的稳定性提高了4倍。
靶向特定组织
完全发挥mRNA疗法的潜力需要更先进的体内递送系统,尤其是针对心脏、肾脏、大脑、和肺等实体器官。目前,大多数疗法比较容易靶向肝脏,然而靶向其它器官需要对递送方式的改进,这包括两个方面:包括使用全身性静脉输注以外的给药方式,以及利用对载体系统的改造改变它们的组织嗜性(tropism)。
在全身性静脉输注以外,局部注射,吸入式和鼻内给药可用于靶向肝脏以外的其它器官。比如,通过肾动脉、肾静脉、输尿管等渠道局部注射药物可以靶向肾脏的不同组织区域。虽然目前还没有治疗肾病的mRNA疗法进入临床试验阶段,但是治疗肾病的微RNA(miRNA)疗法已经进入临床。
吸入式给药可以直接将药物递送到肺部,在允许降低药物剂量的同时,减少潜在全身性不良反应,而且肺部接触空气的表面环境更有利于维持RNA的稳定性,因为其中的核酸酶活性低于血清。
由于血脑屏障的存在,大脑通常是药物递送最艰巨的挑战。在这方面,直接脑内注射可以跨越血脑屏障的阻碍,不过手术本身具有侵袭性和自带的风险,限制它的广泛应用。直接与鼻黏膜连接的神经通路让鼻内给药成为一种针对中枢神经系统的非侵袭性给药方式。
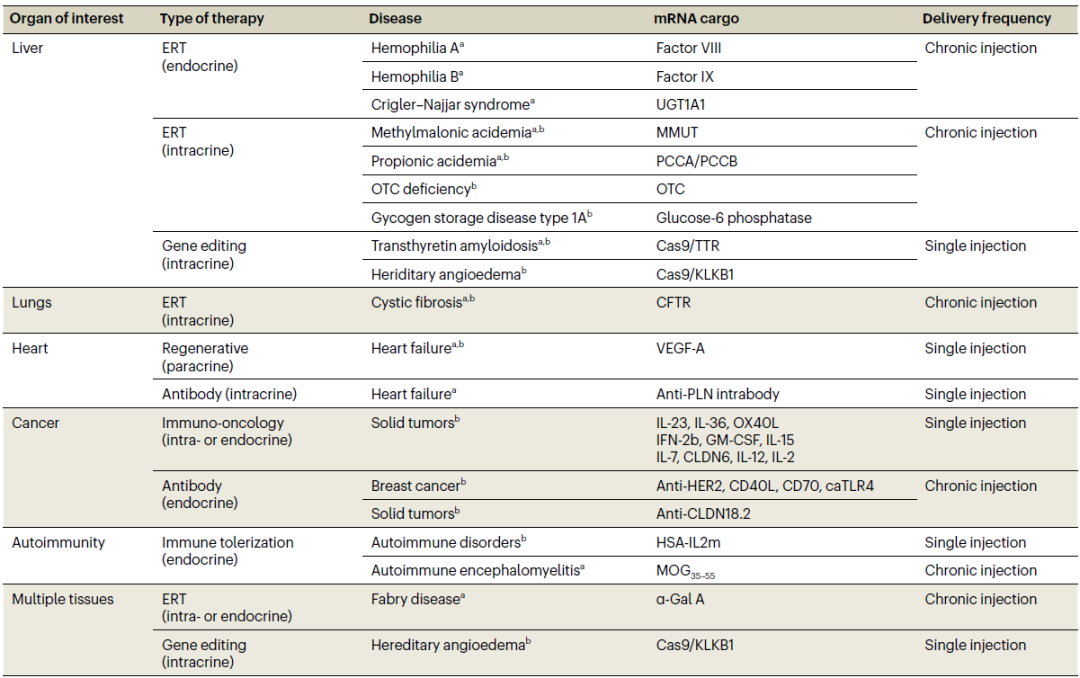
▲目前进入临床试验阶段的部分mRNA疗法(图片来源:参考资料[1])
在改变mRNA疗法载体的嗜性方面,早期LNP载体配方通过与ApoE蛋白结合,促进被它们肝细胞吸收。通过添加PEG修饰的脂质,可以降低LNP被肝脏吸收的程度。而且,在LNP配方中添加不同类型的脂质,可以促使它们在肺部、肝脏或脾脏中积累,比如ReCode Therapeutics公司开发的器官选择性脂质纳米颗粒靶向递送(SORT)系统。该公司这一技术受到辉瑞、拜耳、赛诺菲和安进等多家公司的青睐。
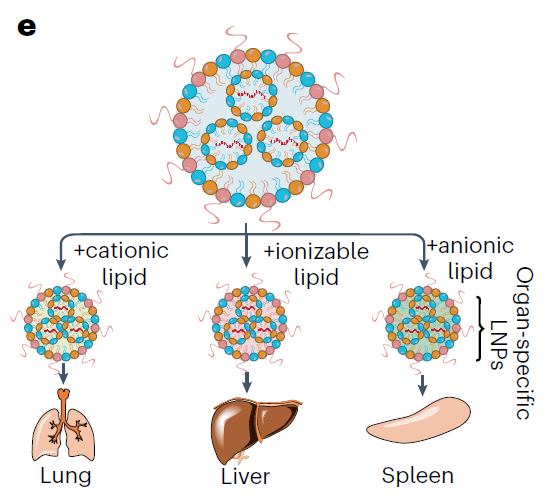
▲通过在LNP配方中添加不同类型的脂质,可以改变LNP递送的组织特异性(图片来源:参考资料[2])
改变LNP的脂质配方之外, 在LNP表面偶联抗体片段在临床前实验中已经显示出可喜的组织特异性,比如抗PECAM1抗体偶联的LNP可以靶向肺部内皮组织,靶向CD4抗体偶联的LNP可以靶向T细胞等等。
长期给药
重复有效和选择性递送mRNA,维持靶标组织的高水平蛋白表达的能力是将mRNA从疫苗转化为疗法的关键之一,尤其对于酶替代疗法。目前的酶替代疗法大多依赖于重组蛋白,比如血友病A和B患者通常接受重组凝血因子的输注,但是他们可能每周需要3~7次的静脉输注。
mRNA疗法除了可能延长蛋白的表达时间外,还具有表达高水平细胞内蛋白的能力,这是重组蛋白难于触达的领域(因为重组蛋白通常无法穿过细胞膜)。
长期给药的主要挑战之一是如何在横跨多年的治疗期间,维持高度蛋白表达。大多数长期蛋白疗法会逐渐丧失效力,因为人体对外源蛋白或载体的中和抗体水平逐渐升高。在小鼠模型中,有些临床前研究已经发现了针对mRNA药物的抗体。
此外,LNP包装的mRNA激发的免疫和细胞毒性反应是临床研究中发现的一个主要潜在隐患。LNP配方中的可电离脂质和PEG修饰脂质均具有免疫原性,可触发炎症和过敏反应。由于PEG在多种日常产品中的使用(比如牙膏和护肤品),普通人群对PEG的敏感度正在逐渐上升。值得一提的是,数项临床前研究显示,长期使用LNP递送mRNA作为酶替代疗法可能产生肝脏毒性。这些证据显示,长期给药的mRNA疗法开发需要在小型和大型动物模型中进行精细的评估和监测。
结语
过去几十年的科学和临床进展造就了mRNA疫苗的突破,也为未来mRNA疗法的开发奠定了基础。综述作者表示,在不远的将来,模块化的mRNA制造单位可能问世,能够在世界各地产生达到GMP标准的mRNA,从而消除冷链运输的需求。随着新一代LNP和非LNP载体的开发,复杂基因和碱基编辑可能成为现实,重复给药的能力可能带来酶替代疗法的新策略。这些进展有望为那些目前其它治疗模式难于治疗的患者带来新希望。
免责声明本文仅供专业人士参看,文中内容仅代表药明康德立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


