近日,广州医科大学附属第一医院何建行/梁文华教授团队,在国际顶级期刊Nature子刊Signal Transduction and Targeted Therapy(中国科学院/ JCR一区,IF=39.3)在线发表研究“The activity and immune dynamics of PD-1inhibition on high-risk pulmonary ground glass opacity lesions: insights from a single-arm, phase II trial”[1]。广州医科大学附属第一医院、广州呼吸健康研究院、国家呼吸医学中心何建行教授、梁文华教授为共同通讯作者,团队程博博士,黎才琛博士,李坚福博士,梁鹏博士以及臻和科技巩龙龙博士为本文主要第一作者。该研究首次证实,PD-1抑制剂对多原发肺癌(MPLC)患者的早期磨璃病灶具有一定疗效,且安全性良好,并展示了PD-1阻断在超早期肺癌治疗中的免疫动态变化。

研究背景
随着抗PD-1/PD-L1抗体等免疫检查点抑制剂的广泛应用,晚期NSCLC患者的总生存期得到显著延长。此外,新辅助免疫治疗在I-IIIA期可切除NSCLC患者中的疗效同样显著。但关于免疫治疗对极早期肺癌患者的疗效,目前尚不明确。
近年来,MPLC患者的检出率逐渐升高,在CT中通常表现为多发磨玻璃结节,这些结节大多是处于肺癌早期的微浸润性甚至浸润前病灶。在MPLC患者接受主要病灶的手术后,如何处理其未切除且有较高进展风险的剩余病灶当前尚无共识。研究表明,免疫逃逸在肺癌的浸润前阶段就已经发生。因此,免疫治疗在肺部高危磨玻璃结节患者中的应用值得探索。
对此,何建行教授团队开展了一项单臂、II期临床研究(NCT04026841),旨在评估信迪利单抗治疗MPLC患者高危磨玻璃病灶的有效性和安全性,并观察了这些早期肺癌患者在用药治疗期间的免疫动态。
研究设计
这是一项前瞻性、单臂、II期临床试验。所有入组患者均具有两个或两个以上无法同时切除的肺结节,其中至少一个经病理检查(手术切除或穿刺活检)证实为NSCLC;且存在未切除的磨玻璃病灶,CTR≤0.5,直径1-3 cm,持续存在≥1年,经MDT一致评估为高危肺结节(Lung-RADs 4级或6个月内曾出现进展),高度怀疑为原发恶性病灶。
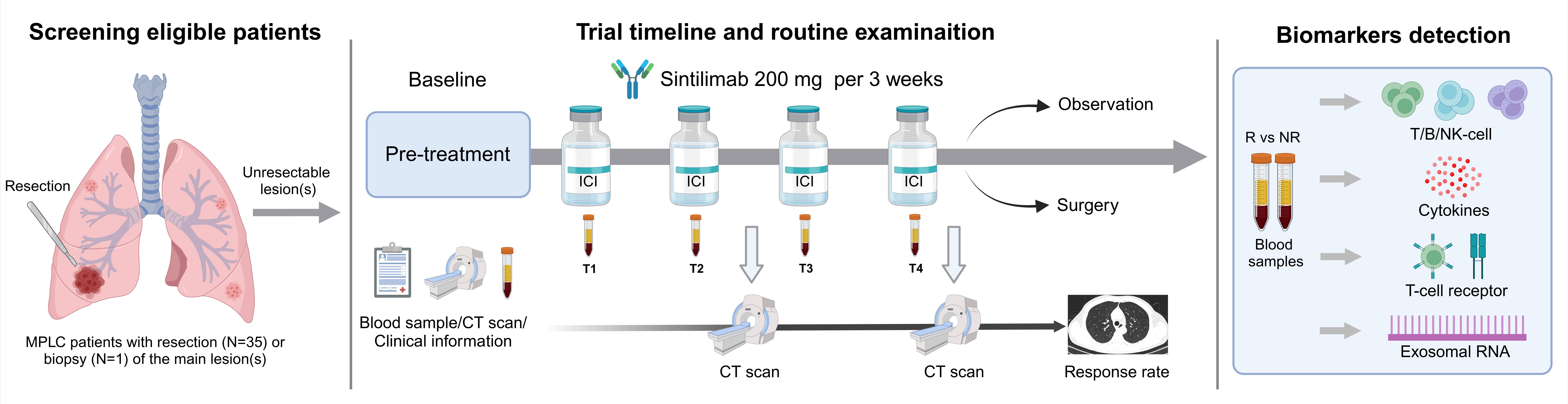 图1. 研究设计及检测项目
图1. 研究设计及检测项目
所有患者均接受共4个周期的信迪利单抗治疗(200mg,q3w),旨在评估信迪利单抗治疗MPLC患者高危磨玻璃病灶的有效性和安全性,主要终点为客观缓解率(ORR)。对于入组患者,目标病灶定义为符合入选标准的纯磨玻璃病灶或磨玻璃成分主的病灶(CTR≤0.5),非目标病灶定义为纯实性病灶或实性成分为主的病灶(CTR>0.5); 以上病灶均经MDT评估为恶性。
研究结果
研究共纳入36例患者,中位年龄为59.5岁(IQR, 53.5-69)。其中,66.7%(24/36)为女性,19.4%(7/36)的患者具有吸烟史;所有患者切除(或活检)的主病灶均为腺癌,其中88.9%(32/36)为I期或原位腺癌,52.8%(19/36)为EGFR突变阳性。
有效性及安全性
患者接受信迪利单抗治疗的ORR为5.6%(2/36),有2例患者的目标病灶(CTR≤0.5)获得缓解,包括1例完全缓解和1例部分缓解。此外,有3例患者的3个非目标病灶(CTR>0.5)在治疗后出现缓解。将非目标病灶考虑在内,则患者的总缓解率为13.9%(5/36),其余31例患者的病灶未见明显变化,所有入组患者在用药期间均未发生疾病进展。
入组患者中有26例(72%)出现了不良事件(AE),其中17例(47%)为I级,9例(25%)为II级,随访过程中无患者发生3-5级AE。疲劳(36%,13/36)和皮疹(36%,13/36)是最常见的AE,无患者因AE退出试验。
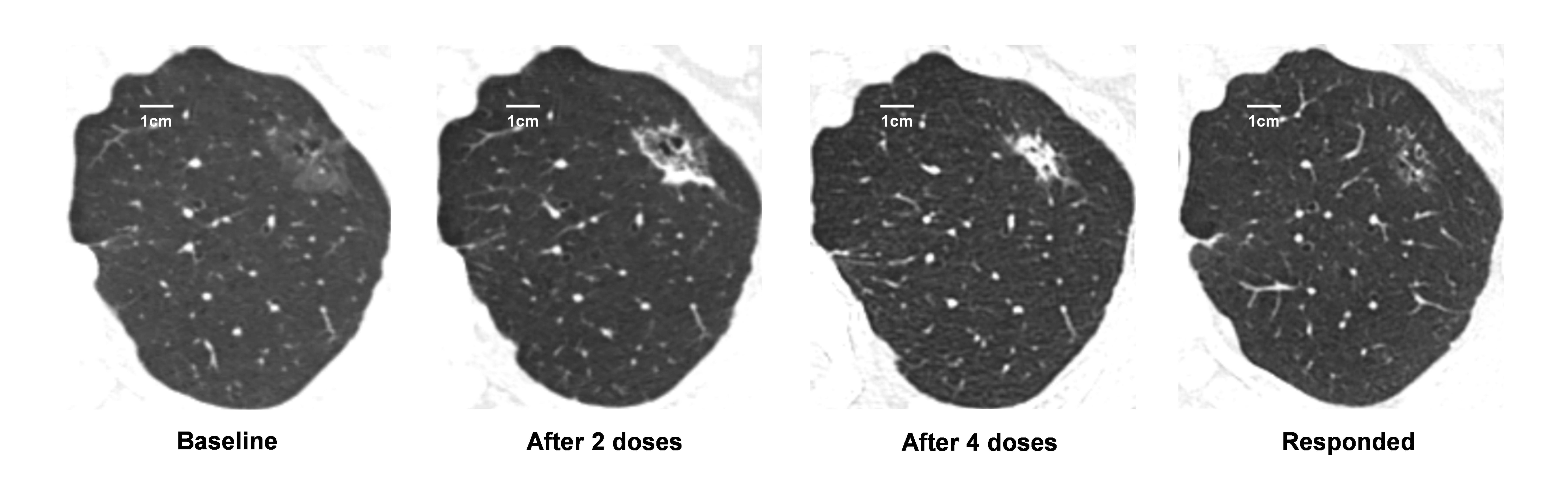 图2. 有效患者目标病灶的影像学变化
图2. 有效患者目标病灶的影像学变化
在5例有效患者中,1例接受了手术治疗,4例继续随访观察;31例无效患者中,11例接受了手术治疗,20例继续随访观察。在治疗完成后的随访中,未观察到有患者出现疾病进展。
多重荧光免疫组化(mIHC)
治疗完成后,基于患者的手术切除肿瘤组织,进行了多重荧光免疫组化检测。结果显示,相比于无效患者,有效患者的肿瘤被更多的CD8+ T细胞浸润,而CD4+ T细胞,CD19+ B细胞,以及CD163+ M2型巨噬细胞更少。
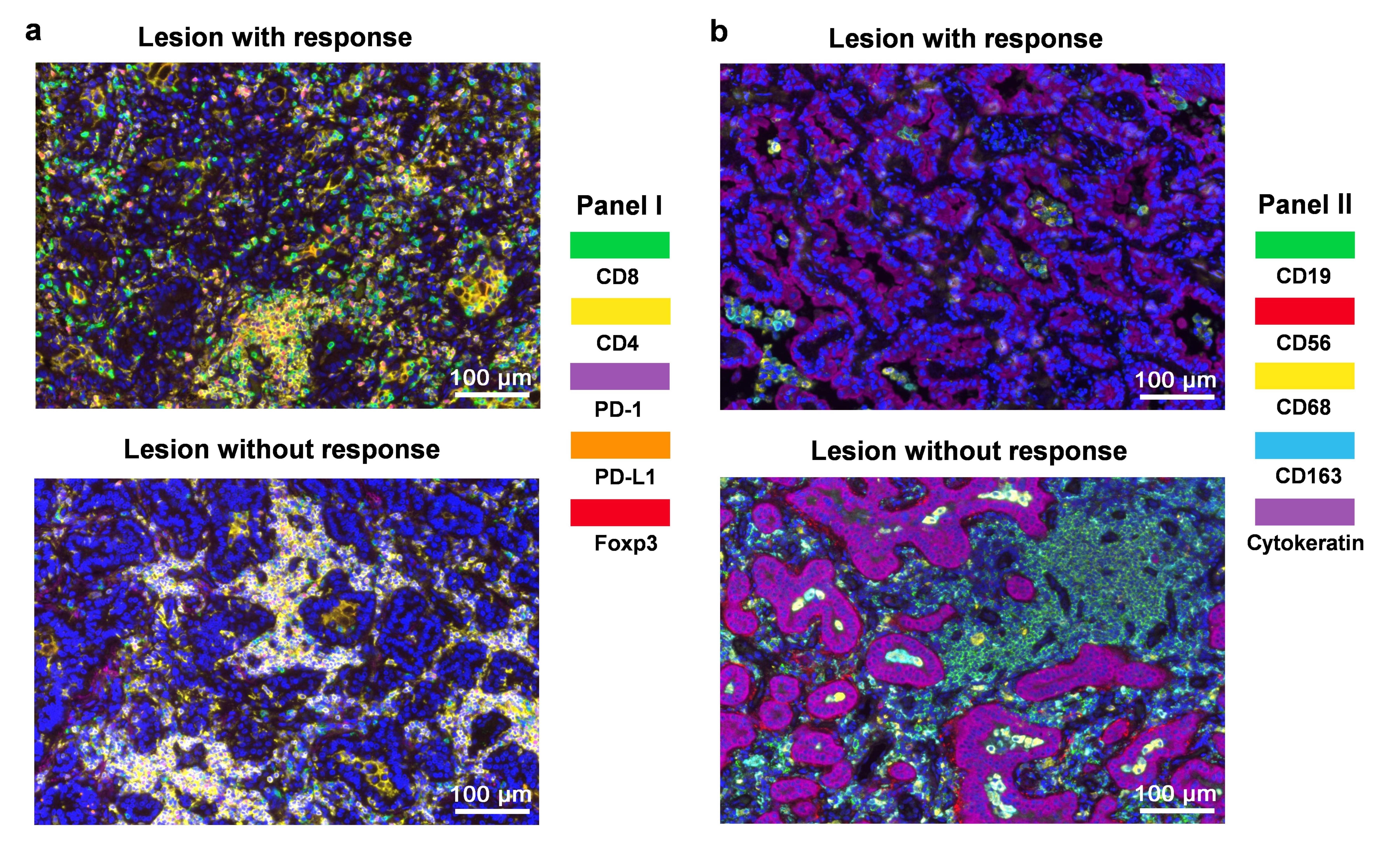 图3. mIHC检测结果
图3. mIHC检测结果
T/B/NK细胞
研究在每个周期用药前抽取血液样本(T1-T4),对有效患者和无效患者的T/B/NK细胞、T细胞受体(TCR)、细胞因子、和外泌体RNA等生物标志物进行了监测和比较。结果表明,有效患者(用药前)基线外周血中的CD8+ T细胞比例(平均值:36.6% vs 24.6%,P<0.001),以及CD8+/CD4+ T细胞比值(平均值:1.09 vs 0.64, P<0.001)均显著高于无效患者,并随着治疗进程逐渐降低。
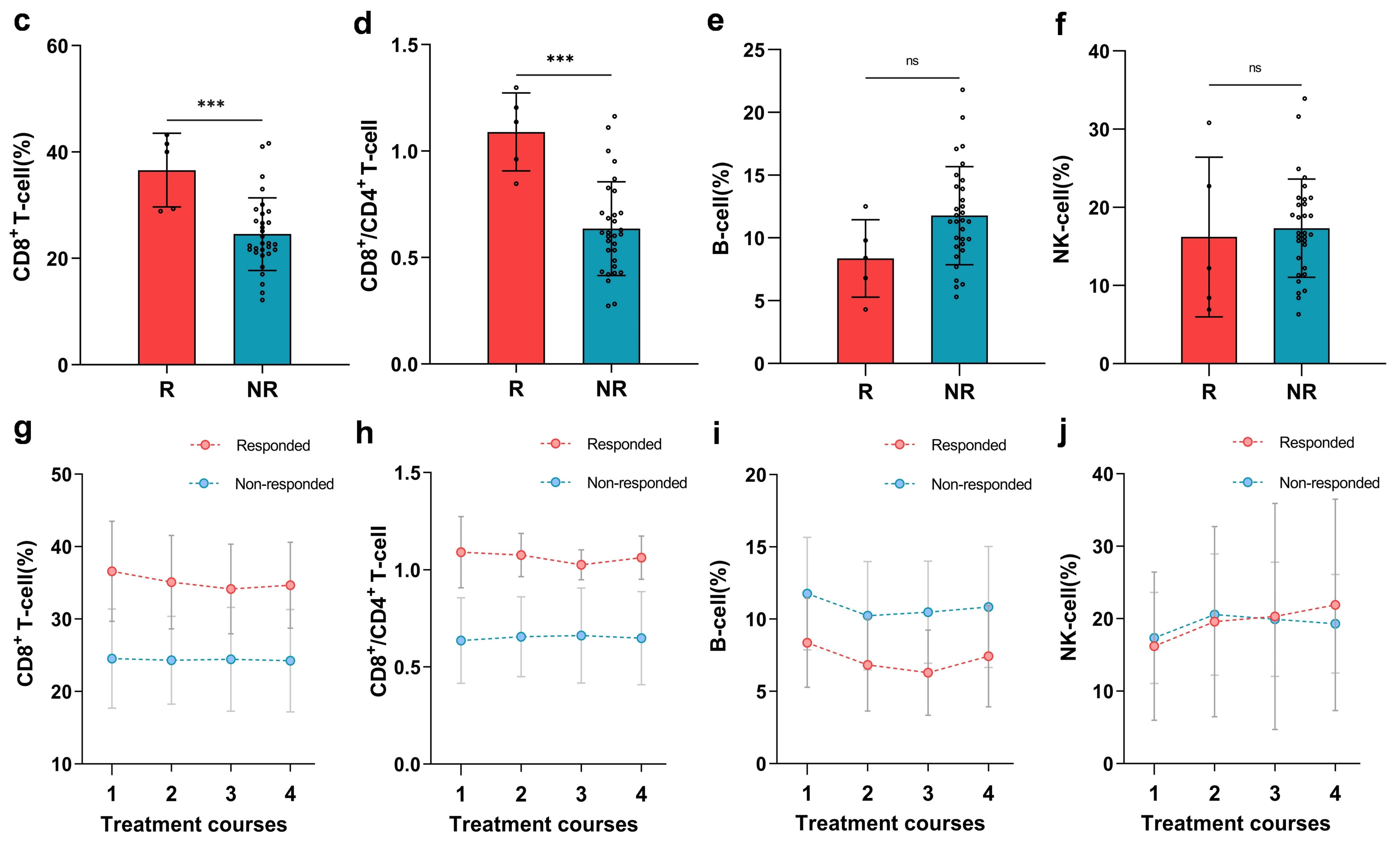 图4. 基线血T/B/NK细胞的检测结果及其变化趋势
图4. 基线血T/B/NK细胞的检测结果及其变化趋势
T细胞受体(TCR)
比较两组患者基线外周血中TCR的克隆性和多样性发现,与无效患者相比,有效患者具有显著更高的TCR克隆性(平均值:0.319 vs 0.129,P<0.01),以及更低的Shannon指数(平均值:8.565 vs 11.504,P<0.01)和均匀性(平均值:0.681 vs 0.872, P<0.01)。此外,在治疗期间,有效患者的TCR克隆性呈下降趋势,而Shannon指数和均匀性呈上升趋势。
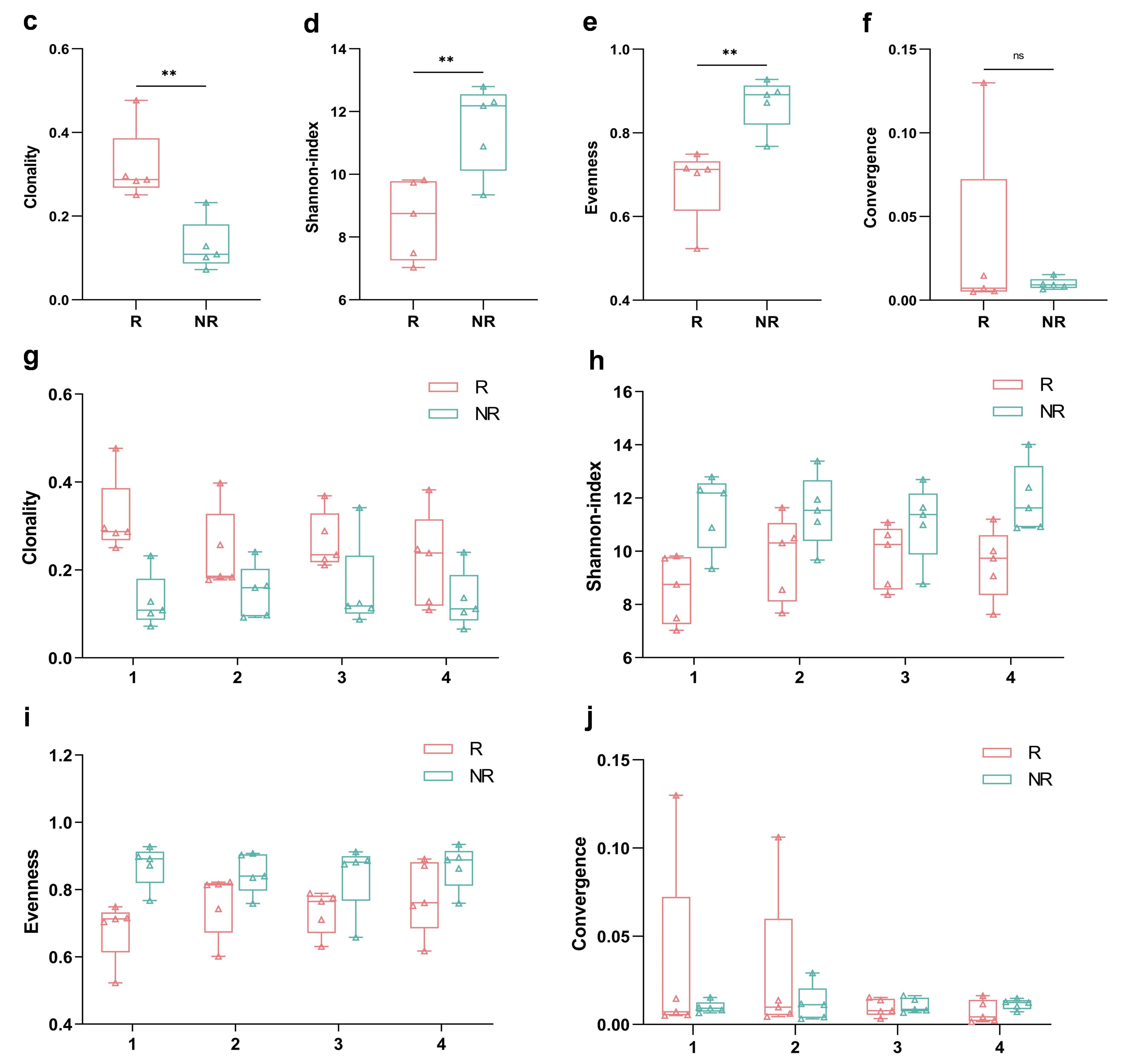 图5. 基线血TCR的检测结果及其变化趋势
图5. 基线血TCR的检测结果及其变化趋势
细胞因子
研究检测了患者外周血中的45种细胞因子和14个免疫检查点,发现有效患者在T2时的EGF(P=0.027)和T4时的CTLA-4(P=0.046)浓度显著高于无效患者。此外,观察细胞因子在患者治疗期间的变化情况,除两组患者的PD-1水平在用药后显著降低外,其余各种细胞因子均无明显变化。
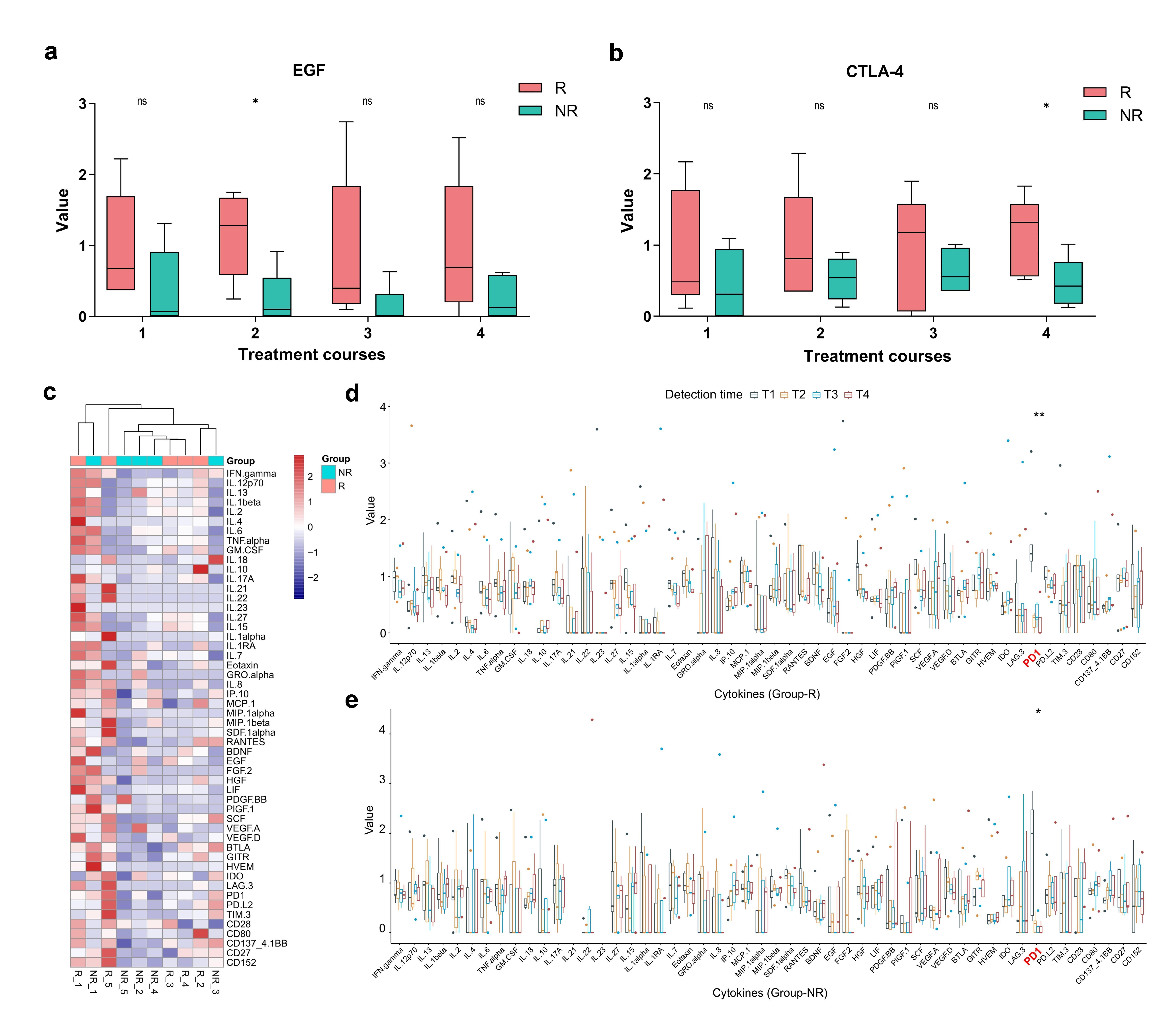 图6. 外周血细胞因子检测结果
图6. 外周血细胞因子检测结果
外泌体RNA
基于患者的外泌体RNA进行GSEA富集分析。结果显示,相比于无效患者,有效患者中Myc targets_v2基因集上调,脂肪酸代谢、氧化磷酸化和蛋白质分泌相关基因集下调。研究者又采用时间序列聚类分析观察两组患者在治疗期间的基因表达趋势,发现有效患者中的部分基因通路发生了显著调控(上调或下调)。进一步采用KEGG和GO富集分析表明,在有效患者中,氧化磷酸化和非酒精性脂肪肝病等通路下调,以及与NADH脱氢酶和氧化还原酶活性相关的基因表达下调。
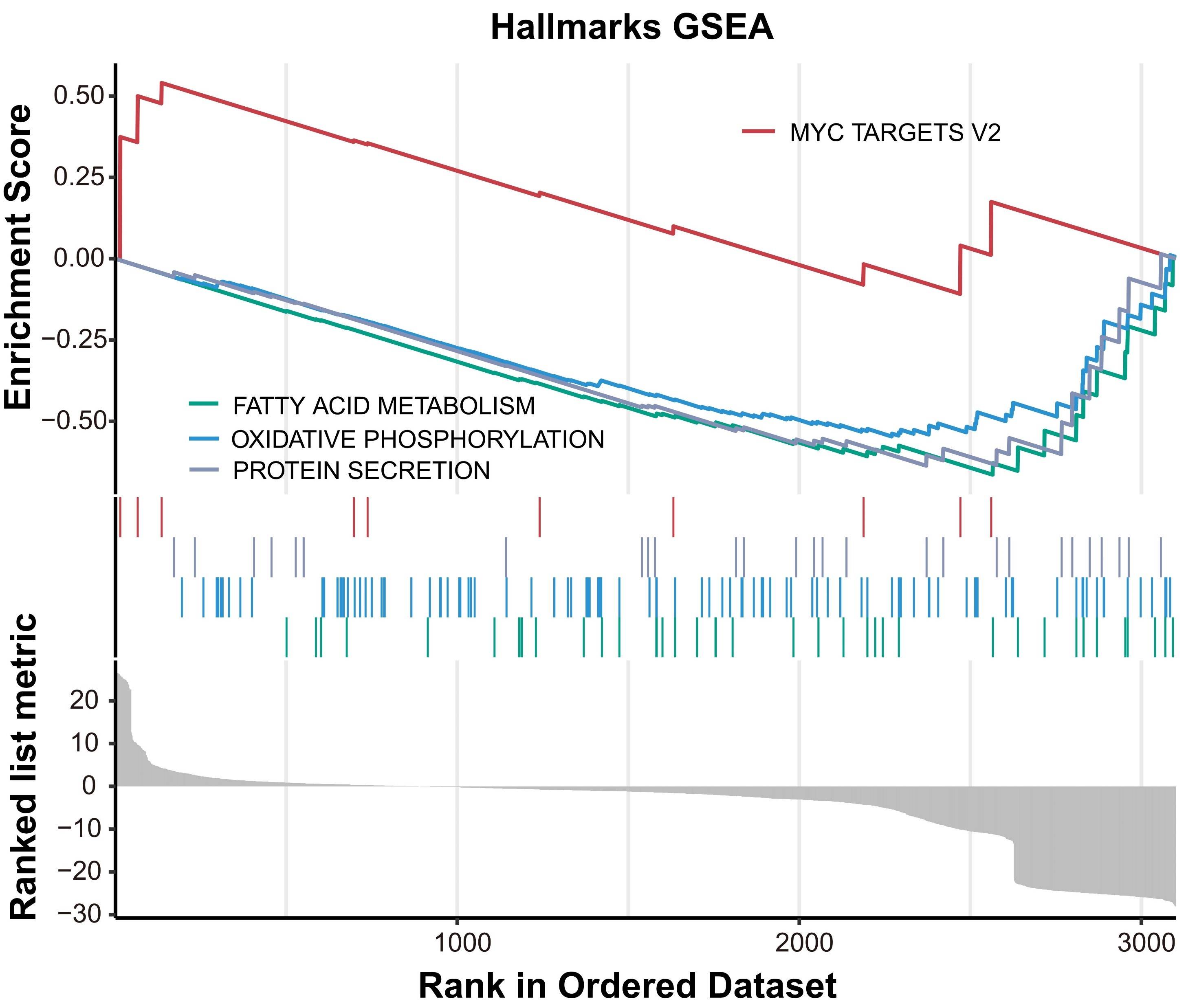 图7. GSEA富集分析
图7. GSEA富集分析
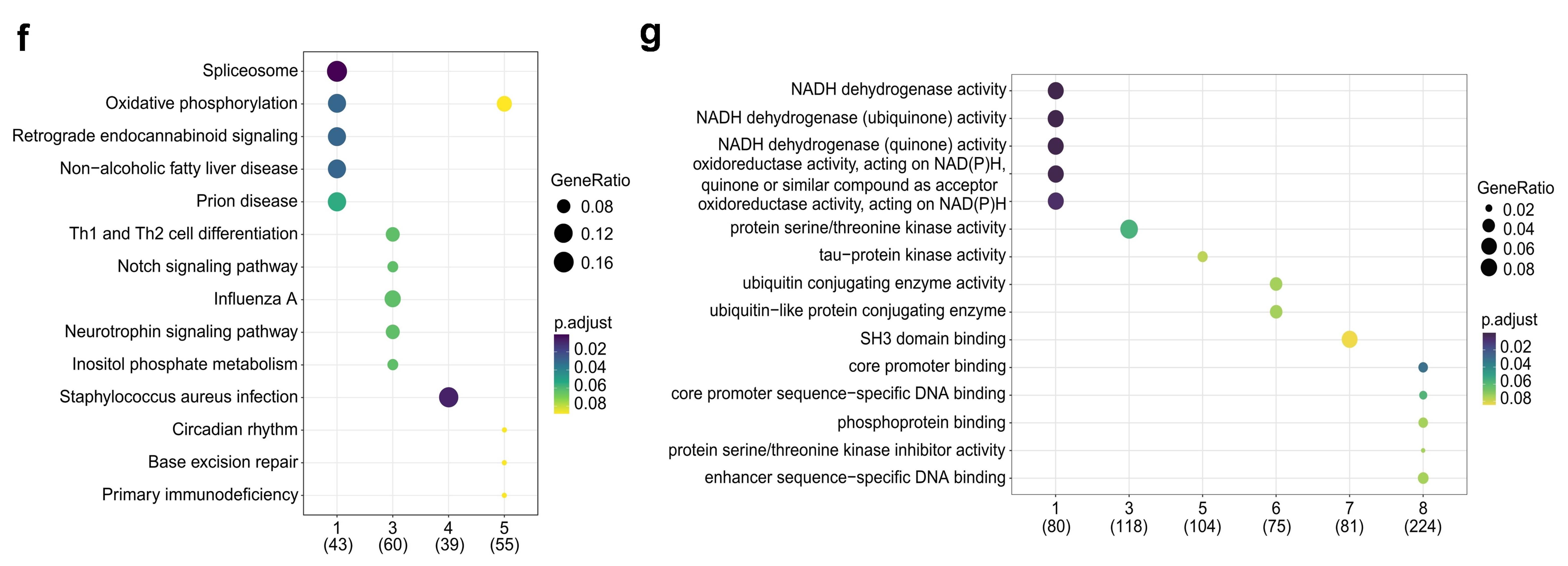 图8. KEGG及GO富集分析
图8. KEGG及GO富集分析
该研究首次证实,免疫治疗对MPLC患者的早期磨玻璃病灶具有一定疗效,且药物毒性可控,安全性较好。其治疗效果与特异性T细胞的重分布、EGF/CTLA-4等细胞因子的调节、和相关代谢通路的调控有关。
总结&展望
此前,何建行/梁文华教授团队发文,在国际上首次证明了EGFR-TKIs对MPLC患者早期磨玻璃样病灶具有治疗作用,而确认磨病灶的基因突变状态,是制定用药决策的关键环节[2, 3]。对此,该团队建立了预测肺腺癌患者磨玻璃病灶EGFR突变状态的影像组学模型,并开发出可即时使用的软件,作为一项无创、且准确快捷的诊断工具,能够有效筛选EGFR突变阳性病灶,显著提高了MPLC患者(磨玻璃病灶)接受EGFR-TKIs治疗的有效率[4]。
本次研究证实,PD-1抑制剂对肺癌早期磨玻璃病灶具有一定的治疗效果。对于EGFR突变阴性或不适于EGFR-TKIs治疗的MPLC患者,免疫治疗可以作为潜在的治疗选择,其获益人群有待通过生物标志物进一步筛选。依据患者的EGFR突变状态(阳性或阴性),筛选识别用药受益人群,进行精准治疗,对于MPLC的临床实践具有重要意义。
近年来,何建行/梁文华教授团队致力于探索早期肺癌以及MPLC的有效诊治策略,并针对靶向治疗与免疫治疗在MPLC患者中的应用开展了系列研究,致力于实现免创的肺结节/早期肺癌药物治疗模式。
[1] Cheng B, Li C, Li J, et al. The activity and immune dynamics of PD-1 inhibition on high-risk pulmonary ground glass opacity lesions: insights from a single-arm, phase II trial [J]. Signal Transduction and Targeted Therapy, 2024, 9(1): 93.
[2] Cheng B, Li C, Zhao Y, et al. The impact of postoperative EGFR-TKIs treatment on residual GGO lesions after resection for lung cancer [J]. Signal Transduct Target Ther, 2021, 6(1): 73.
[3] Cheng B, Deng H, Zhao Y, et al. Management for Residual Ground-Glass Opacity Lesions After Resection of Main Tumor in Multifocal Lung Cancer: A Case Report and Literature Review [J]. Cancer Management and Research, 2021, 13: 977-85.
[4] Cheng B, Deng H, Zhao Y, et al. Predicting EGFR mutation status in lung adenocarcinoma presenting as ground-glass opacity: utilizing radiomics model in clinical translation [J]. European Radiology, 2022, 32(9): 5869-79.
排版编辑:肿瘤资讯-Hanna











 苏公网安备32059002004080号
苏公网安备32059002004080号


