
复旦大学附属华山医院 普通外科
上海市“医苑新星”青年医学人才
美国癌症免疫治疗学会(SITC)会员
Journal for ImmunoTherapy of Cancer等杂志审稿人
主要研究方向肝癌免疫治疗及临床转化研究
至今以第一/通讯作者(含共同)发表SCI论文16篇,10分以上4篇,包括:Gut (IF 31.8), Cellular & molecular immunology (IF 22.1)等杂志
主持国家自然科学基金1项
肿瘤的免疫治疗,除了关注肿瘤细胞本身,肿瘤微环境中免疫细胞类别,数量,功能也与免疫治疗的疗效息息相关。目前的肿瘤免疫治疗主要是靶向PD-1/PD-L1的免疫检查点抑制剂疗法(ICIs),已有证据表明,ICIs疗法是有效的,甚至可以治愈一部分癌症患者。但是,能够获益于这类疗法的患者比例依然有限,单药有效率不超过30%。因此,研究者一直致力于改善ICIs疗效,最主要的策略是“联合治疗”。然而,临床上数以千计的针对不同组合的疗法在评估联合治疗策略的有效性,但是目前并没有提供一种策略,既能够以理想的协同效应来增强疗效,还不会带来更多的不良反应。与其继续各种ICIs为主的联合疗法的盲目组合,不如更好地研究以包括肿瘤免疫分型为主的基础肿瘤免疫学机制。免疫联合疗法的策略适用于特定的患者群体,通过对肿瘤免疫分型的分析和分类,确定不同免疫联合治疗策略适应的肿瘤免疫分型人群,为个体化的肿瘤精准治疗提供理论依据。
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)疗法在临床上取得了显著疗效,为癌症患者带来了新的曙光。2018年,美国免疫学家詹姆斯·艾利森(James P Alison)和日本免疫学家本庶佑(Tasuku Honjo)因为在肿瘤免疫领域做出的贡献,荣获2018年诺贝尔生理学/医学奖。然而,仅有一部分实体瘤患者对ICIs治疗有应答[1]。既往研究提示ICIs疗效与肿瘤的免疫表型有关,与无T细胞浸润的冷肿瘤相比,浸润大量T细胞的热肿瘤对ICIs疗法应答率更高[2]。然而越来越多的研究表明,部分热肿瘤即使有大量T细胞浸润,仍对ICIs不敏感[3, 4]。此外,抗肿瘤免疫涉及肿瘤与微环境间复杂的相互调控,免疫逃逸机制多种多样,提示仅以T细胞浸润分类冷热肿瘤存在局限性。如何准确识别对ICIs有应答的热肿瘤以及如何将无应答的冷肿瘤转变成热肿瘤是免疫治疗领域亟需解决的关键科学问题。

图1.詹姆斯·艾利森(James P Alison)和本庶佑(Tasuku Honjo)
对肿瘤免疫分型的研究有很多,其中之一就是肿瘤免疫三分型:“免疫浸润型(inflamed)”、“免疫豁免型(Immune exclued)”、“免疫沙漠型(Immune desert)”[2, 5]。研究者通过对肿瘤组织进行免疫组化染色后发现这三类存在显著的差异,在“免疫浸润型”肿瘤中,CD8+T细胞可以浸润到肿瘤内部;“免疫豁免型”肿瘤中,虽然也有较高的CD8+T细胞浸润程度,但都是集中在肿瘤外围;而“免疫沙漠型”肿瘤中很少有CD8+T细胞的浸润(图2)。
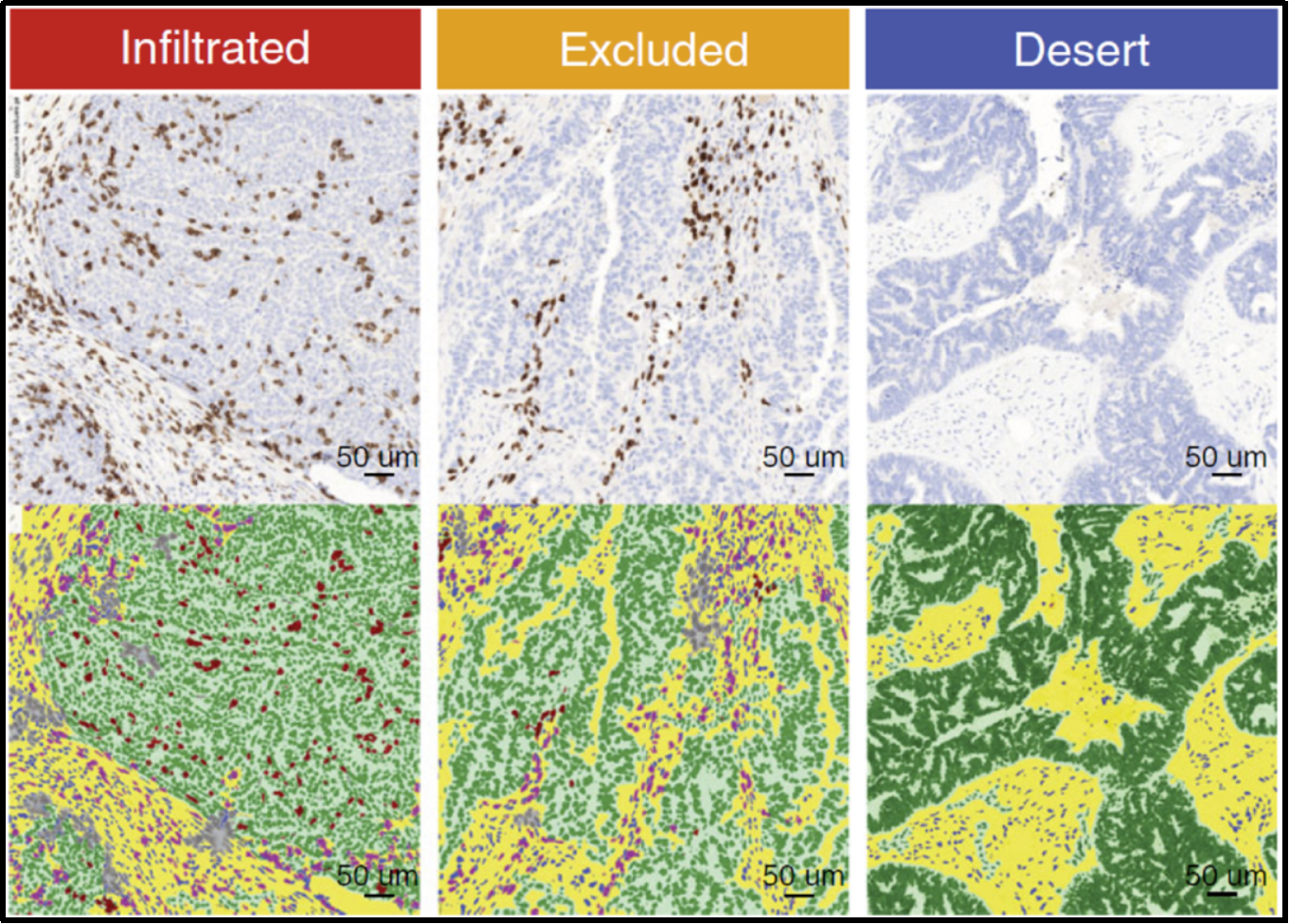
图2.肿瘤免疫三分型[2]
此外,Teng et al.提出,联合检测肿瘤浸润性淋巴细胞(Tumor Infiltrating Lymphocyte,TIL)及肿瘤微环境中的PD-L1,能够优化对ICIs的疗效预测[6]。基于这两个指标,可以将肿瘤初步分为四个亚型:Type I:获得性免疫耐受型(TIL+, PD-L1+),这种类型理论上是免疫治疗,特别是ICIs起效的理想分型;Type II:免疫无反应型(TIL-, PD-L1-),这种类型是预后最差的一种分型,通常需要采用多种策略的联合治疗来诱发患者的免疫反应;Type III:原发诱导表达型(TIL-, PD-L1+),该类型临床少见,各个瘤种不一致,PD-L1表达不依赖于经典的IFN-γ途径,往往通过原癌基因的活化导致PD-L1的固有表达,前期研究表明这种类型往往对ICIs的疗效不敏感;Type IV:其他通道逃逸型(TIL+, PD-L1-),针对这一类型目前临床应用讨论很不一致,其牵涉到PD-L1的时间空间异质性,理论上,该肿瘤的免疫逃逸是依赖于其他的抑制性免疫检查点分子产生,需要今后更多的免疫检查点通路抑制剂的临床验证。

图3.肿瘤免疫四分型[6]
目前,在探索免疫疗法与其他药物联合治疗的临床试验中,ICIs疗法是最常见的支柱,成千上万的临床试验正在进行中,以研究与ICIs疗法可能的联合治疗效果。多种治疗策略可以增加局部和全身肿瘤特异性CD8+T细胞的数量及功能,将冷肿瘤转化为热肿瘤,从而增加ICIs疗法敏感性[7]。在多项随机临床试验中,联合免疫疗法比单一治疗显示出更好的临床效益,提示基于免疫表型的联合免疫治疗策略具有巨大的临床应用前景[8]。在临床实验中检测的各种组合中,化疗、抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)疗法以及靶向治疗是最常见的三个联合治疗策略。
与抗CTLA-4疗法联合
CTLA-4是位于T细胞上的负性调控因子,DC等免疫细胞通过与T细胞上的CTLA-4结合,介导T细胞活化抑制,防止T细胞过度活跃,CTLA-4抑制剂伊匹单抗,靶向抑制负性调控,重新激活T细胞[9]。CTLA-4抑制剂联合PD-1/PD-L1抑制剂,被认为是免疫检查点抑制剂的互补机制,在诸多肿瘤中取得了很好的效果。Check-Mate 743研究旨在评估纳武利尤单抗(PD-1抑制剂)联合伊匹单抗对比标准化疗用于既往未经治疗的不可切除的恶性胸膜间皮瘤患者的疗效和安全性。结果显示,双免疫治疗组相比化疗组能够显著延长总生存期(OS),患者死亡风险降低27%(中位OS:18.1 vs. 14.1个月,HR=0.73),双免疫治疗组有近1/4的患者存活超过3年[10]。在Check-Mate 040研究中,针对晚期肝癌患者,一线治疗进展后,使用纳武利尤单抗联合伊匹单抗进行系统治疗, OS达到了近两年,甚至有40%左右的患者生存达到了3年以上,基于纳武利尤单抗联合伊匹单抗的双免治疗方案获得了美国食品药品监督管理局(FDA)的批准,用于既往接受过索拉非尼治疗的肝细胞癌患者,从此肝癌的治疗也进入了双免疫治疗的时代[11]。最近,HIMALAYA研究宣布达到主要终点,与索拉非尼一线标准治疗相比,度伐利尤单抗(PD-L1抑制剂)联合曲美木单抗(CTLA-4抑制剂)的STRIDE方案获得了具有统计学和临床双重意义的OS 显著改善,成为首个双免联合对比索拉非尼一线治疗肝癌获得 OS阳性结果的临床研究 ,刷新了肝细胞癌一线免疫治疗探索史[12] 。值得注意的是,在一些试验中,双免疫治疗组合在各种免疫相关不良事件包括自身免疫相关不良事件的严重程度显著增加,使用时需要提早识别。
与化疗联合
标准化疗对高度增殖细胞有广泛的细胞毒性作用,特别是对造血和免疫系统。因此,系统性化疗以往被认为是免疫疗法的天敌[13]。然而,一些研究表明,某些化疗药物,如果使用得当,可以通过消除Treg细胞来促进T细胞免疫,以及增加肿瘤细胞死亡时抗原释放,从而能够刺激T细胞介导的免疫[14]。最近的结果支持ICIs联合化疗实现协同的抗肿瘤反应。Keynote-407研究中,与安慰剂联合化疗相比,帕博利珠单抗(PD-1抑制剂)联合化疗显著改善了初治转移性鳞状非小细胞肺癌(NSCLC)患者的OS,且毒性可控,上述研究结果支持帕博利珠单抗联合化疗作为NSCLC的一线治疗方案[15]。同时,在小细胞肺癌(SCLC)和三阴性乳腺癌的几项III期临床试验中也观察到了类似的结果[16, 17]。最近,晚期胆管癌的TOPAZ-1 研究获得阳性结果,结果显示度伐利尤单抗(PD-L1抑制剂)联合化疗显著延长了晚期胆管癌患者的OS、无进展生存期(PFS),显著提高有效率(ORR)[18]。尽管免疫联合化疗在某些肿瘤的临床试验显示出一定的生存优势,但仍有问题有待解决:其一,化疗是否会损害ICIs疗法,化疗药物是否会对免疫细胞产生细胞毒性。为了解决这一问题,需要将抗ICIs联合化疗与ICIs疗法单药治疗进行对比。另一个值得关注的问题是化疗对ICIs疗法的长期影响,尚不清楚化疗药物是否会对长期记忆免疫细胞产生不利影响,因此更好地了解化疗药物如何影响免疫系统对未来评估ICIs联合化疗策略的临床试验至关重要。
与靶向治疗联合
用小分子靶向治疗药物靶向癌细胞内多种信号通路被证明对快速缩小肿瘤体积有效,同时又不会对免疫系统造成不利影响,因此是与ICIs联合的潜在选择。Keynote-426研究拉开了晚期肾癌免疫联合靶向治疗的序幕,这项研究发现:与舒尼替尼单药治疗相比,在未经治疗的晚期肾细胞癌患者中,帕博利珠单抗(PD-1抑制剂)联合阿昔替尼治疗显著改善了OS、PFS和ORR,提示帕博利珠单抗联合阿昔替尼的一线治疗作为晚期肾细胞癌的标准疗法[19, 20]。同样的,IMbrave150研究旨在评价阿替利珠单抗(PD-L1抑制剂)联合贝伐珠单抗(抗VEGF单克隆抗体)对比索拉非尼,用于未经治疗的晚期不可切除肝细胞癌患者的安全性和有效性。该研究显示联合治疗显著降低肝癌患者死亡风险,尤其是中国亚组的死亡风险降低56%,联合治疗组对比索拉非尼组OS分别为24个月 vs. 11.4个月,PFS分别为5.7个月 vs. 3.2个月[21]。IMbrave 150研究作为全球首个获得成功的肝癌III期免疫联合治疗研究,为晚期肝癌的系统性治疗带来了革命性改变[22]。目前,各种靶向治疗与ICIs疗法的组合正在临床试验中进行评估,包括BRAF和MEK抑制剂,EGFR、ALK、ROS1抑制剂等。
目前临床上数以千计的ICIs为主的联合疗法并没有提供一种策略,既能够以理想的协同效应来增强疗效,还不会带来更多的不良反应。与其继续各种ICIs为主的联合现有疗法的组合,不如更好地研究以包括肿瘤免疫分型为主的肿瘤基础免疫学机制,这可能是解决问题的关键。免疫联合疗法的策略适用于特定的患者群体,通过对肿瘤免疫分型的分析和分类,确定不同免疫联合治疗策略对应的肿瘤免疫分型人群,为个体化的肿瘤精准治疗提供理论依据。
1 Dammeijer F, van Gulijk M, Mulder EE, Lukkes M, Klaase L, van den Bosch T et al. The PD-1/PD-L1-Checkpoint Restrains T cell Immunity in Tumor-Draining Lymph Nodes. Cancer cell 2020; 38: 685-700.e688.
2 Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature 2017; 541: 321-330.
3 Sivori S, Pende D, Quatrini L, Pietra G, Della Chiesa M, Vacca P et al. NK cells and ILCs in tumor immunotherapy. Molecular aspects of medicine 2021; 80: 100870.
4 Dong W, Wu X, Ma S, Wang Y, Nalin AP, Zhu Z et al. The Mechanism of Anti-PD-L1 Antibody Efficacy against PD-L1-Negative Tumors Identifies NK Cells Expressing PD-L1 as a Cytolytic Effector. Cancer discovery 2019; 9: 1422-1437.
5 Hegde PS, Chen DS. Top 10 Challenges in Cancer Immunotherapy. Immunity 2020; 52: 17-35.
6 Teng MW, Ngiow SF, Ribas A, Smyth MJ. Classifying Cancers Based on T-cell Infiltration and PD-L1. Cancer research 2015; 75: 2139-2145.
7 Tang J, Shalabi A, Hubbard-Lucey VM. Comprehensive analysis of the clinical immuno-oncology landscape. Annals of oncology : official journal of the European Society for Medical Oncology 2018; 29: 84-91.
8 Upadhaya S, Neftelinov ST, Hodge J, Campbell J. Challenges and opportunities in the PD1/PDL1 inhibitor clinical trial landscape. Nature reviews Drug discovery 2022; 21: 482-483.
9 Hodi FS, O'Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB et al. Improved survival with ipilimumab in patients with metastatic melanoma. The New England journal of medicine 2010; 363: 711-723.
10 Baas P, Scherpereel A, Nowak AK, Fujimoto N, Peters S, Tsao AS et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet (London, England) 2021; 397: 375-386.
11 Yau T, Kang YK, Kim TY, El-Khoueiry AB, Santoro A, Sangro B et al. Efficacy and Safety of Nivolumab Plus Ipilimumab in Patients With Advanced Hepatocellular Carcinoma Previously Treated With Sorafenib: The CheckMate 040 Randomized Clinical Trial. JAMA oncology 2020; 6: e204564.
12 Kudo M. Durvalumab Plus Tremelimumab: A Novel Combination Immunotherapy for Unresectable Hepatocellular Carcinoma. Liver cancer 2022; 11: 87-93.
13 Zitvogel L, Apetoh L, Ghiringhelli F, Kroemer G. Immunological aspects of cancer chemotherapy. Nature reviews Immunology 2008; 8: 59-73.
14 Ghiringhelli F, Menard C, Puig PE, Ladoire S, Roux S, Martin F et al. Metronomic cyclophosphamide regimen selectively depletes CD4+CD25+ regulatory T cells and restores T and NK effector functions in end stage cancer patients. Cancer immunology, immunotherapy : CII 2007; 56: 641-648.
15 Gandhi L, Rodríguez-Abreu D, Gadgeel S, Esteban E, Felip E, De Angelis F et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. The New England journal of medicine 2018; 378: 2078-2092.
16 Schmid P, Adams S, Rugo HS, Schneeweiss A, Barrios CH, Iwata H et al. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. New England Journal of Medicine 2018; 379: 2108-2121.
17 Paz-Ares L, Dvorkin M, Chen Y, Reinmuth N, Hotta K, Trukhin D et al. Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet (London, England) 2019; 394: 1929-1939.
18 AstraZeneca. Imfinzi plus chemotherapy significantly improved overall survival in 1st-line advanced biliary tract cancer in TOPAZ-1 Phase III trial at interim analysis2021.
19 Rini BI, Plimack ER, Stus V, Gafanov R, Hawkins R, Nosov D et al. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. The New England journal of medicine 2019; 380: 1116-1127.
20 Powles T, Plimack ER, Soulières D, Waddell T, Stus V, Gafanov R et al. Pembrolizumab plus axitinib versus sunitinib monotherapy as first-line treatment of advanced renal cell carcinoma (KEYNOTE-426): extended follow-up from a randomised, open-label, phase 3 trial. The Lancet Oncology 2020; 21: 1563-1573.
21 Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim T-Y et al. IMbrave150: Updated overall survival (OS) data from a global, randomized, open-label phase III study of atezolizumab (atezo)+ bevacizumab (bev) versus sorafenib (sor) in patients (pts) with unresectable hepatocellular carcinoma (HCC). American Society of Clinical Oncology, 2021.
22 Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim T-Y et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. New England Journal of Medicine 2020; 382: 1894-1905.











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


