在肿瘤精准医学时代,基因检测已成为解开这一复杂疾病“密码”的关键钥匙,但在神经内分泌肿瘤中,基因检测的应用范围及价值与其它实体肿瘤有显著的区别。复旦大学附属肿瘤医院陈洁教授详细梳理了基因检测在神经内分泌肿瘤诊断、遗传筛查、精准用药及免疫治疗评估中的现状、技术要点与临床决策路径,希望通过这篇文章,能使读者更深刻理解基因检测在神经内分泌肿瘤诊治应用中的意义及时机选择。

基因检测的临床意义

基因检测最早应用于临床的主要目的是对各类遗传性疾病进行诊断。我们知晓,神经内分泌肿瘤中约有10%为遗传相关性神经内分泌肿瘤。所以,基因检测的首要目的便是用于遗传性疾病的诊断,它是确诊各类遗传性神经内分泌肿瘤的金标准。
其次,随着肿瘤精准医学的发展,通过探寻可靶向治疗的突变基因,肿瘤学领域形成了诸多靶向治疗方法。并且,随着免疫治疗时代的来临,我们借助基因检测对免疫治疗相关的标记物进行检测,以筛选出能够从免疫治疗中获益的患者。例如,肿瘤突变负荷(TMB)的高低与免疫治疗疗效密切相关。因此,临床上基因检测的第二个目的是对肿瘤进行精准治疗。
再者,基因检测还应用于药物基因组学。药物基因组学是指通过对患者进行基因检测,预测特定药物在患者体内的代谢疗效以及不良反应的风险,从而指导临床药物治疗的选择,甚至进行剂量调整。
此外,基因检测还有其他应用。当通过常规培养无法找到感染病原体时,可通过病原体的基因检测来搜寻病原体。在临床上,遇到一些难以明确组织学起源或原发部位的肿瘤时,也有专门用于寻找肿瘤组织学起源和原发部位的基因检测技术。
基因检测的主要技术演进

早期或传统的基因检测技术包括经典染色体分析技术、原位杂交(FISH)、PCR基因扩增技术及多重连接探针扩增技术(MLPA)等。
随后出现了第一代测序、第二代测序和第三代测序技术。第一代测序技术,以Sanger测序为代表,作为早期基因检测的标准方法,主要采用双脱氧链末端终止法进行DNA序列测定,准确性高达99.999%。然而,其成本较高、通量较低,因此主要用于验证已知的致病突变位点和小规模基因panel的分析,这既是其优势,也限制了其应用范围。
第二代测序(NGS)技术取得进步,可高通量地对大样本、长基因进行测序,是目前的主流技术,许多患者的样本都采用该技术检测。不过,第二代测序技术在拼接复杂基因组区域或检测大型基因结构变异方面可能出现差错。
第三代测序技术,它克服了二代测序读长的限制,实现了对单分子DNA的直接测序,且无需PCR扩增,从而避免了由此引入的扩增偏好性或误差。由此可见,一代、二代、三代基因测序技术逐渐实现高通量,且朝着测序的深入化和精准化方向发展。
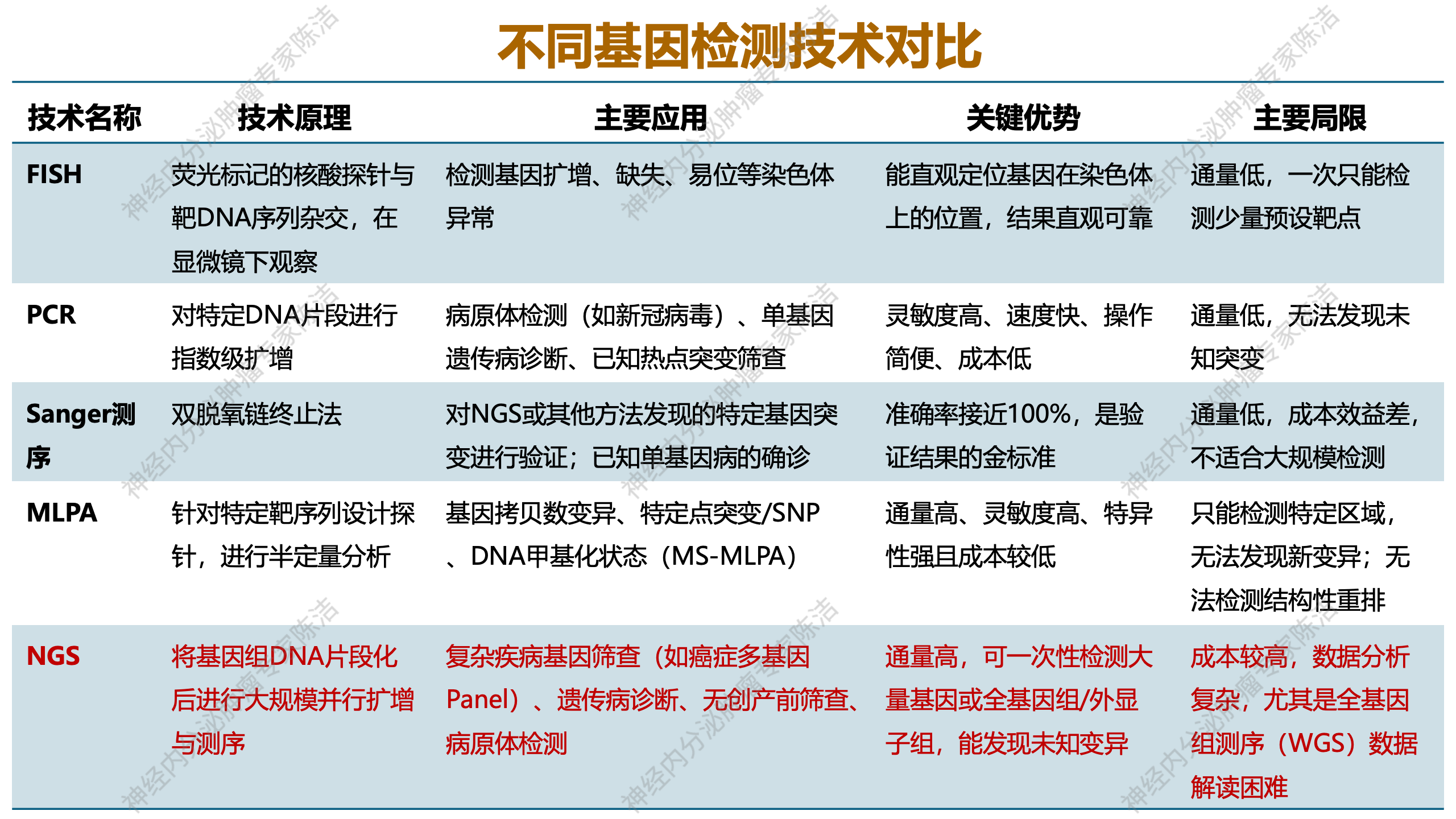
此表格对从早期到一代、二代等不同的基因检测技术展开比较,涵盖其技术原理、主要应用、关键优势及主要局限性。从表格中可以看出,从FISH、PCR到MLPA以及其他测序方法,其主要问题在于通量较低,仅能检测预设的靶点,无法发现未知突变。目前,主流的NGS技术克服了上述经典基因检测技术的缺陷,能够对基因组进行大规模扩增和测序,因此在临床上可用于复杂疾病的基因检测,如癌症的体细胞突变检测、遗传病筛查及诊断、产前筛查、病原体检测等。该技术具有高通量的特点,可一次性检测大量基因,甚至能进行全基因组或外显子组测序,不仅能发现已知变异,还能发现未知变异。然而,总体而言,NGS技术目前存在成本较高、数据分析复杂的问题,尤其是全基因组测序数据量极大,解读存在一定困难,对专业能力也有一定要求。
胚系基因突变与体细胞基因突变的区别
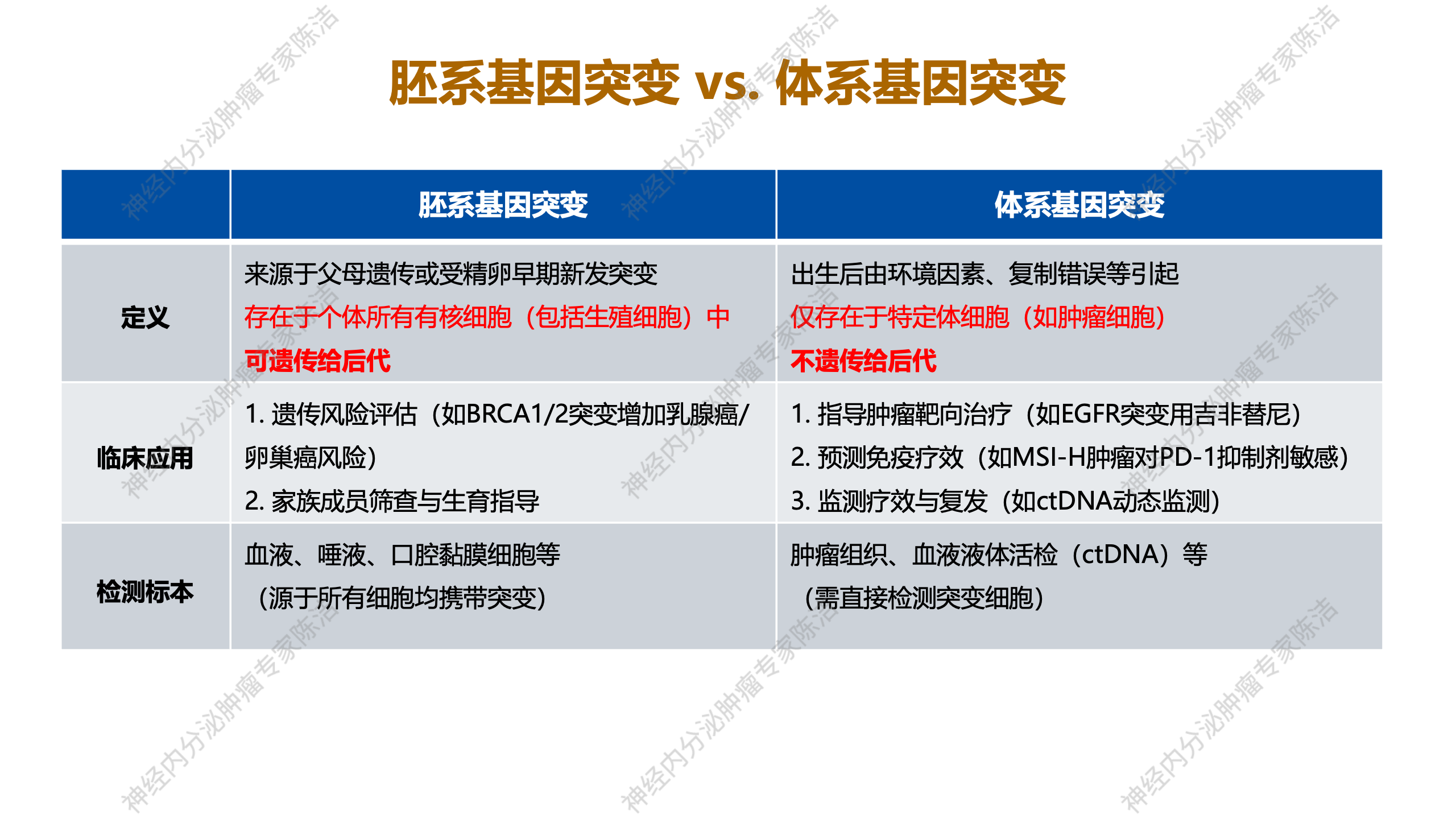
在探讨基因检测技术应用于肿瘤诊治时,有一些重要概念需要明确。在基因检测报告中,会出现胚系基因突变和体细胞基因突变这两种不同类型的基因突变。所谓胚系基因突变,是指源于父母遗传或受精卵早期新发的突变,存在于个体所有有核细胞,包括生殖细胞,此类突变可遗传给后代。在临床上,进行胚系基因突变检测主要用于遗传风险评估,或在怀疑存在遗传相关性肿瘤时使用,也可用于遗传相关疾病家族成员的筛查,以及携带致病基因患者的生育指导,这些情况均需进行胚系基因检测。胚系基因检测通常采用血液、唾液或口腔粘膜细胞等标本,这些正常人体细胞均携带可遗传的胚系基因突变。
体细胞基因突变是出生后由环境因素或基因复制错误等引发的,仅存在于特定体细胞且不会遗传给后代的突变。在肿瘤精准治疗中,检测体细胞突变通常需提供肿瘤组织;部分患者则提供血液进行液体活检,以检测其中游离的肿瘤细胞DNA。其主要目的是直接检测肿瘤细胞的基因,用于临床指导肿瘤的靶向治疗、预测免疫治疗疗效、监测疗效及复发情况等,这便是检测体细胞基因突变的临床意义。最重要的是,体细胞基因突变不会遗传给后代。因此,大家首先要明确基因检测报告中胚系基因突变和体细胞基因突变的意义分别是什么。
基因检测在神经内分泌肿瘤中的临床应用概述
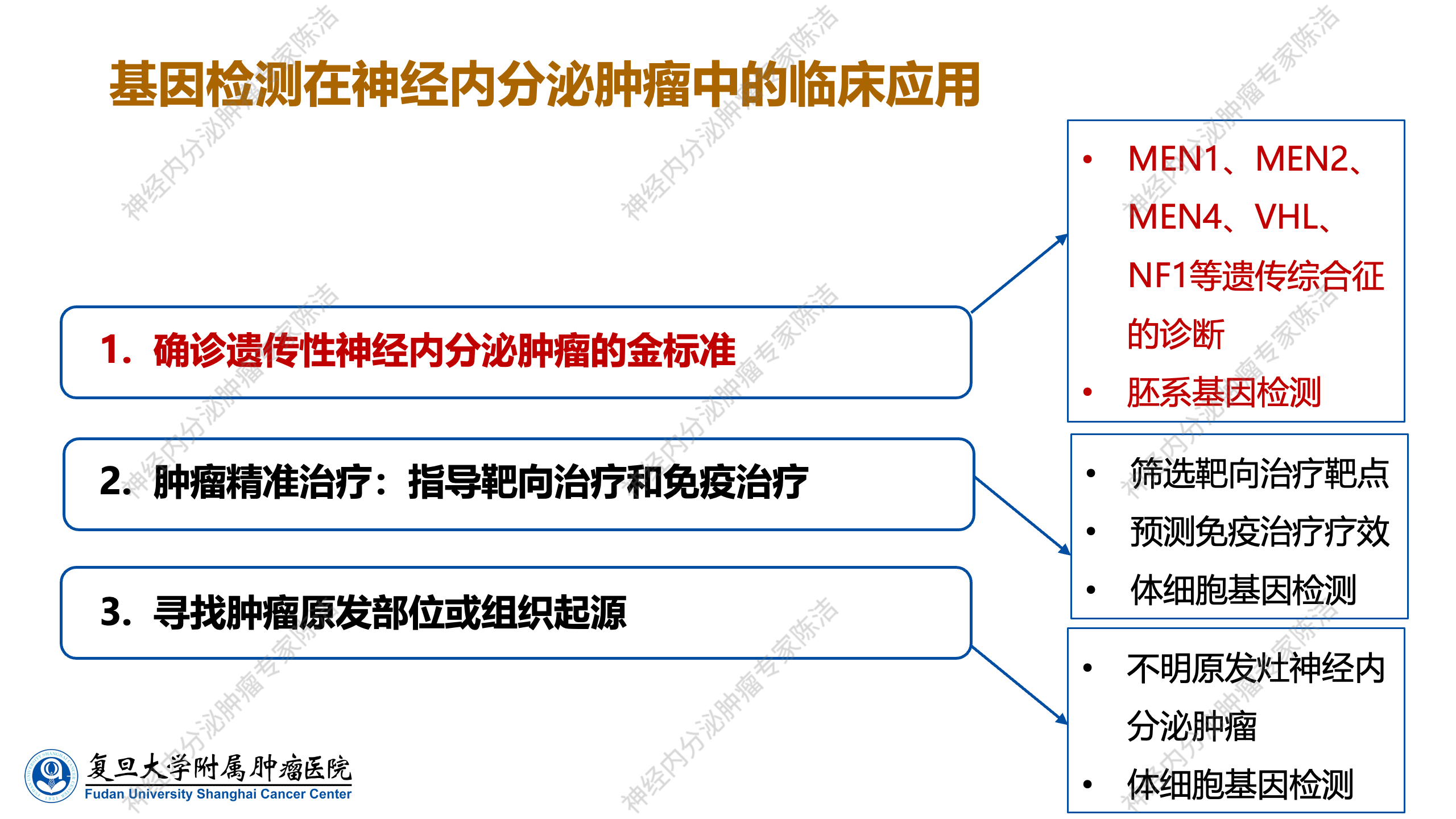
总体而言,目前在神经内分泌肿瘤临床中应用的基因检测主要用于三个方面,其一,它是确诊遗传性神经内分泌肿瘤的金标准。该标准主要通过胚系基因检测,以明确患者是否携带从父母遗传而来的致病性遗传基因,这是第一个主要的临床应用。其二为肿瘤的精准治疗,即通过基因检测指导患者进行靶向治疗靶点的筛查,预测免疫治疗的疗效,并筛选出适合免疫治疗的患者。这一过程主要依赖于体细胞基因检测技术,它在个性化治疗方案的制定中发挥着关键作用。其三,针对部分不明原发灶的神经内分泌肿瘤,可借助体细胞基因检测技术来探寻肿瘤的原发部位或组织起源。
基因检测在遗传性神经内分泌肿瘤中的应用
1. 神经内分泌肿瘤相关遗传综合征及筛查要点
在《CACA神经内分泌肿瘤诊治指南(2025年版)》中,梳理了神经内分泌肿瘤相关的遗传综合征,通俗而言即遗传性神经内分泌肿瘤。下方表格呈现了神经内分泌肿瘤各种常见相关遗传综合征的特点。总体来说,若父母一方携带该基因,子女无论性别,均有50%的几率遗传这一致病突变基因,进而可能致使下一代患病。


在临床实践中,需明确何时要求患者进行这些遗传综合征的筛查,即患者就诊时,何时开具胚系基因突变检测单、哪些患者需要接受基因检测。依据《CACA神经内分泌肿瘤诊治指南(2025年版)》,遵循以下原则:
发生于十二指肠、胰腺的 胃泌素瘤,以及导致2型胃NET的胃泌素瘤;
肾上腺皮质癌;
PPGLs;
多灶性 pNET;
患者在 30岁以前出现甲状旁腺腺瘤或原发性甲状旁腺功能亢进、多发性甲状旁腺腺瘤、无明显继发原因的多发性腺体增生或反复发作的原发性甲状旁腺功能亢进;
临床上对存在甲状腺髓样癌或MEN2相关特征的患者需要怀疑MEN2可能;
一级亲属中有符合上述任一标准但因各种原因未能进行检测者。
同时,也建议符合以下2种或2种以上,或满足1种且家族史中符合以下1种或1种以上而被临床怀疑患有MEN1的患者进行评估:原发性甲状旁腺功能亢进,十二指肠或胰腺NETs,发生于支气管、胸腺、胃这些前肠器官的NETs和PitNETs。

在复旦大学附属肿瘤医院,为就诊患者提供胚系基因检测服务,检测后患者会获得一份《神经内分泌肿瘤血液胚系多基因检测报告》。我院整合的基因检测panel涵盖了目前已知与遗传性神经内分泌肿瘤相关的致病突变基因。通过该panel基因检测,可以明确遗传性神经内分泌肿瘤的诊断并为后续检查、家系筛查等提供指导。
之所以选择多基因组套检测而非单基因突变检测,是因为同一部位神经内分泌肿瘤,可能由不同胚系基因突变引起。例如,副神经节瘤可能由超过十个基因导致,而胰腺神经内分泌肿瘤也可能由不少于五个致病基因引发,将这些相应致病基因整合在一起,留取标本后可一并进行高通量检测和筛查。目前进行胚系基因突变检测,在我院主要采用血液标本,当然,口腔脱落细胞等正常细胞也可用于胚系基因检测。对于已确诊的患者,需对其家属上下三代进行致病基因筛查。
另外,在我院的基因检测分析中,不仅要进行基因突变检测,还需通过MLPA方法检测基因大片段缺失或拷贝数变异。例如,临床上,对于疑似MEN1综合征的患者,在检测MEN1基因时未发现突变,而若进一步采用MLPA检测方法,可能会发现患者携带该基因的长片段缺失。这些片段缺失后,常规NGS测序时自然无法检测到突变。然而,临床上患者仍会呈现MEN1综合征的相关症状。因此,若患者仅进行基因突变检测,而未采用MLPA技术进行大片段缺失检测,可能会漏诊因大片段缺失导致的MEN1基因异常患者。
2. 胚系基因检测结果解读

胚系基因检测报告中的风险评估可分为5个等级,包括:
致病性/可能致病性:有充分或较强证据表明变异会直接导致疾病,具有临床意义且可遗传。
意义未明:目前证据不足以判断其是否有害,临床影响尚不明确。
良性/可能良性:通常不会引起健康问题,无需关注。
3. 具有遗传综合征表现但基因检测阴性的原因解读

临床上,部分患者表现为多部位多发肿瘤,怀疑可能为某种遗传综合征,但基因检测结果为阴性,该如何解读这一结果?这种情况在多发性内分泌腺瘤病1型(即MEN1综合征)患者中较为常见。约2%—25%具有MEN1综合征表型的患者,基因检测未发现MEN1基因的相关突变。可能的原因是,除MEN1基因突变外,CDKN1A、CDKN1B等基因变异也可能使患者出现MEN1综合征的表现。如前文所述,我院基因检测套餐的优势在于可同时检测所有相关基因,避免仅进行MEN1基因突变检测而漏诊其他相关基因突变。此外,如AIP基因突变可引发家族性孤立型垂体腺瘤综合征,若患者在垂体瘤的基础上,恰好伴有甲状旁腺腺瘤,易被误诊为MEN1综合征。因此,在检测套餐中,AIP基因是必查项目。通过这种大panel的基因检测,基本可避免漏诊或误诊情况的发生。另外,还存在偶然出现的双原发肿瘤情况。甲状旁腺腺瘤和垂体瘤等常见肿瘤,在非遗传相关的正常人中也有一定发病率。有时,患者可能同时患有这两种肿瘤,但实际上为非遗传相关的双原发肿瘤,这在临床上也较为常见。最后,还有一个重要问题是检测手段的敏感性。某些基因测序未采用合适的检测手段,如前文所述的MLPA技术,则可能漏诊大片段缺失,或可能因测序深度不足,导致原本存在的突变基因未能被检测到。这实则是检测技术敏感性方面的问题。因此,对于有遗传综合征表现但基因检测结果呈阴性的患者,我们需认真分析,其究竟是偶然出现的多发性肿瘤,还是因检测技术局限性而遗漏了相关信息。
4. 遗传性神经内分泌肿瘤基因检测需要注意的问题

关于遗传性神经内分泌肿瘤的基因检测,有几个问题需重点强调。对于临床医生,必须对遗传性神经内分泌肿瘤保持警觉,但需注意避免将双原发或多发性肿瘤误诊为遗传性神经内分泌肿瘤;对于患者,若在临床层面考虑患者患有遗传性神经内分泌肿瘤,且医生建议其进行胚系基因检测,患者也务必遵循医生建议接受检测,以免漏诊。
在临床上,部分患者因社会、保险等因素,拒绝进行此类检测,部分患者会询问,基因检测会对本人及家庭产生何种影响。首先,就患者本人而言,若知晓自身携带致病基因,应尽早每年对可能发生肿瘤的器官进行相关检查,以期早期发现肿瘤,从而获得及时有效治疗。否则,患者就诊时可能已出现全身广泛转移。对于有生育需求的患者,这一点更为关键。携带遗传致病基因的患者并非不能生育,随着医学发展以及第三代试管婴儿技术的成熟,我们完全能够借助该技术生育不携带致病基因的健康后代,进而阻断致病基因的代际传播。因此,我们强烈建议患者进行基因检测,这对患者本人及其下一代均具有重要意义,可避免致病基因在家族中代代相传。
基因检测在指导靶向治疗和免疫治疗中的应用
基因检测技术除了在遗传性神经内分泌肿瘤的应用中发挥着重要作用,还能指导靶向治疗和免疫治疗,为患者提供个性化治疗方案。
1. 肿瘤体细胞基因检测中的常用术语

其一为肿瘤突变负荷(TMB),它是衡量肿瘤细胞基因突变数量的指标。肿瘤基因突变数量越多,产生异常蛋白质的可能性就越大,这些异常蛋白质可能会被人体自身免疫系统识别为外来物质,即所谓的新生抗原,进而激活免疫细胞攻击肿瘤。因此,TMB值高的肿瘤,通常具有更高的免疫原性,对免疫治疗,包括PD-1和PD-L1免疫检查点抑制剂的反应常常更好。所以,肿瘤突变负荷是筛选对免疫治疗敏感患者的重要标志物。
其二是微卫星不稳定性(MSI)与错配修复系统(MMR)。错配修复系统是人体细胞内的重要纠错系统,能够在DNA复制过程中修正错误,维持基因稳定。若错配修复系统功能失效,临床上称之为错配修复缺陷,简称为dMMR。此时,DNA复制过程中的错误会大量累积,尤其是在一些短的重复DNA序列(即微卫星)上,这会导致微卫星长度改变,出现微卫星不稳定性(MSI-H现象)。所以,错配修复缺陷是导致微卫星不稳定性肿瘤的原因。由于此类肿瘤积累了大量突变,更易被免疫系统识别,同样可能对免疫治疗敏感。因此,肿瘤突变负荷、微卫星不稳定性以及错配修复系统缺陷等指标,对于预测肿瘤患者的免疫治疗能否获益具有重要意义。

检测肿瘤体细胞突变的另一作用在于筛选具备靶向治疗药物适用条件的基因突变。这里需要提一下OncoKB,这是由美国纪念斯隆凯特琳癌症中心(MSKCC)开发的精准肿瘤学知识库,该知识库涵盖了有关癌症基因组改变的生物学与临床信息。在这个知识库中,对迄今发现的所有可用于靶向治疗药物的基因突变进行了不同等级的分类。其中,一级(Level 1)标记物是获得美国食品药品监督管理局(FDA)认可的标志物,用于指导FDA批准的药物用于特定情况。在此,有两类重要的可靶向治疗药物的治疗靶点:一类是肿瘤类型特异性的靶向治疗靶点,例如肺癌的表皮生长因子受体(EGFR)各种变异、间变性淋巴瘤激酶(ALK)融合,以及乳腺癌、结肠癌、甲状腺髓样癌等的相应靶点;另一类是泛实体肿瘤的可靶向治疗靶点,即无论何种实体肿瘤,若存在BRAF V600E、神经营养因子受体酪氨酸激酶(NTRK)融合或错配修复缺陷高度不稳定(MSI-H)等情况,均可使用相应的靶向或免疫药物。无论是肿瘤类型特异的靶点还是泛实体肿瘤的靶点,我们均可通过基因检测找出。若肿瘤细胞中存在可使用靶向药物的治疗靶点,则意味着患者可能有机会接受靶向治疗。
2. 神经内分泌肿瘤体细胞基因改变特点

然而,令人遗憾的是,神经内分泌肿瘤,包括神经内分泌瘤和神经内分泌癌,其基因组相对稳定。基因测序结果通常显示,肿瘤整体突变负荷极低,微卫星处于稳定状态。虽然存在一些基因突变,但可进行靶向治疗的基因突变极为罕见。例如,在分化良好的神经内分泌瘤中,可靶向治疗的基因突变仅偶尔在如肺的不典型类癌中发现;在甲状腺髓样癌中,RET基因突变率相对较高,可进行相应靶向药物治疗。但总体而言,其他可靶向治疗的基因突变极为少见,常常是“大海捞针”。

对于神经内分泌癌,其体细胞基因突变主要表现也是整体突变负荷低,微卫星状态稳定。这表明神经内分泌肿瘤,无论是瘤还是癌,常属于所谓的“免疫冷肿瘤”,对免疫治疗总体不敏感。在神经内分泌癌中,最重要且常见的突变基因是TP53和RB1,但目前针对这两个突变尚无可用药物,相关药物研发尚未实现。可靶向治疗的靶点同样罕见。不过,神经内分泌癌中有两个特殊部位,有可能通过基因检测找到治疗靶点。例如,肺的大细胞神经内分泌癌可能携带肺腺癌中常见的一些可靶向治疗的突变,有相应的靶向药物可用;结肠的神经内分泌癌中,部分患者的肿瘤会携带BRAFV600E突变,该突变也有靶向药物可使用。总体来看,神经内分泌肿瘤体细胞基因突变检测中,可靶向治疗靶点较为罕见,主要集中于肺和结肠部位,而在胰腺等其他部位则难觅踪迹,也堪比大海捞针。
3. 免疫治疗标记物与“免疫微环境冷热转化“


前文已提及免疫治疗的相关标记物,目前免疫治疗主要以PD-1/PD-L1/CTLA-4抗体为代表的免疫检查点阻断剂,是临床上广泛应用的免疫治疗药物。这类免疫治疗药物,对肿瘤高突变负荷、微卫星不稳定,或肿瘤组织中有较多免疫淋巴细胞浸润,或高表达PD-L1的所谓“免疫热肿瘤”可能有效,患者或可从中获益。反之,“免疫冷肿瘤”患者则往往无法从该类治疗中获益。如前文阐述体细胞变异时所提及,无论神经内分泌肿瘤瘤或还是神经内分泌癌,总体而言,多属于免疫冷肿瘤。其肿瘤突变负荷不高、微卫星稳定、PD-L1表达低,肿瘤相关淋巴细胞浸润也较少。免疫治疗在其他领域蓬勃发展之际,在神经内分泌肿瘤领域则进展相对缓慢。

这里介绍一项来自美国的大样本真实世界研究,该研究对1477例神经内分泌肿瘤样本进行了TMB高和MSI-H发生频率的分析。该研究样本量大,病理类型涵盖瘤和癌,发病部位涉及肺、胃、肠、胰腺和前列腺。结果显示,高TMB的发生频率相对低,约为13%;而MSI-H的发生频率更低,不足1%。这些数据表明,在神经内分泌肿瘤患者中,高TMB和MSI-H的发生率并不高。具体而言,高TMB在肺部的发生率相对较高,而在胰腺和胃肠的发生率则极低。在高级别的神经内分泌肿瘤中,其发生率稍高;在低级别的神经内分泌肿瘤中,发生率极低。在筛选免疫治疗候选患者时,我们常告知患者,进行基因检测后,仅有约十分之一的比例可能符合免疫治疗条件。换言之,超过90%的患者可能并不适合免疫治疗。

既然神经内分泌肿瘤多为免疫冷肿瘤,是否有办法使其转变为免疫热肿瘤,从而提高其对免疫治疗的敏感性呢?近年来,有一个备受关注的发现:在神经内分泌肿瘤的治疗中,常使用一类烷化剂的化疗药物,其代表药物为替莫唑胺。在2024年ENETS年会上,来自三个不同国家的回顾性临床研究均发现,在使用烷化剂或替莫唑胺治疗的胰腺神经内分泌肿瘤病例中,替莫唑胺等烷化剂可能诱导胰腺神经内分泌肿瘤出现错配修复缺陷,从而产生超突变亚型,即让部分肿瘤出现高突变负荷。而高突变负荷是否意味着将免疫冷肿瘤转变为免疫热肿瘤呢?
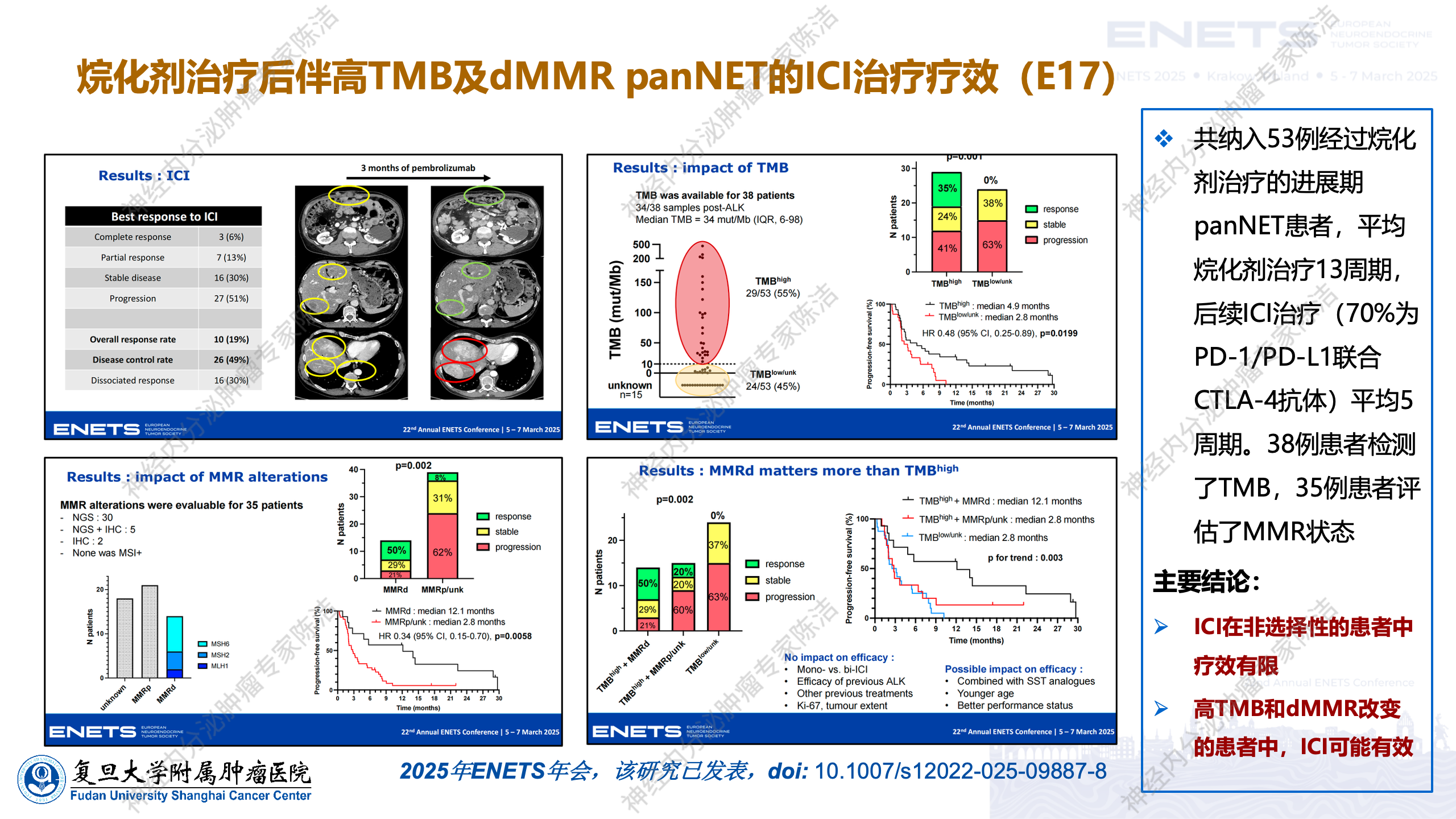
在2025年的ENETS年会上,有报道称,经烷化剂治疗后出现高突变负荷或错配修复缺陷的患者,在后续免疫检查点治疗中取得了较好疗效。目前该研究结果已正式发表,这为我们提供了一种新思路,即烷化剂的治疗,有可能帮助部分患者将肿瘤转变为免疫治疗敏感的肿瘤。
4. 临床抉择:何时进行基因检测?

至此,患者或临床同道可能会问,对于神经内分泌肿瘤,何时进行基因检测以指导药物治疗的选择。2024年ENETS年会上的一篇专题报告具有临床指导意义:
首先,在神经内分泌肿瘤患者中,潜在可靶向治疗的靶点突变率极低,高突变负荷或微卫星不稳定的发生率亦低。而现有的用于治疗神经内分泌肿瘤的靶向药物,如依维莫司以及一系列抗血管生成靶向药物,其临床应用并不依赖基因突变检测。对于一些少见的特殊突变,例如BRCA1、BRAFV600、RET、ALK、NTRK基因等,这些有相应靶向药物的特定靶点,临床上可考虑使用针对这些靶点的靶向药物。然而,这些靶向药物与现有标准治疗的疗效优劣,目前尚不明晰。当然,临床上在标准治疗之后,也可使用这些靶向药物。鉴于神经内分泌肿瘤的这些特点,若欲通过NGS或全基因组测序技术来寻找治疗靶点、评估肿瘤的突变负荷或微卫星状态,建议对肿瘤进行再次活检后再开展基因检测。
那么,何时对这类肿瘤进行基因测序以寻找治疗靶点呢?较为合理的建议是,对于分化良好的神经内分泌瘤,通常在多线标准治疗失败后再进行基因测序。因为多数分化良好的神经内分泌瘤患者在前期接受SSA、靶向药物或PRRT等治疗时,这些治疗能延长患者生存期,而确诊时即进行对未来三五年治疗无指导意义的基因检测,这无疑会增加患者不必要的费用。当然,若这些患者多线标准治疗失败且无其他治疗途径,肿瘤经特定药物治疗(如烷化剂)后可能转变为免疫治疗敏感肿瘤,或在特定部位(如肺部、结肠)有寻找治疗靶点需求时,进行基因检测是相对合理的。需向患者说明,即便进行基因测序,寻找到治疗靶点或证实为免疫治疗敏感的高突变负荷肿瘤或微卫星不稳定的概率总体仍较低。而对于生物学行为不佳的G3级神经内分泌肿瘤或神经内分泌癌,鉴于此类患者预后极差、生存时间较短,可在确诊后即进行基因检测。
因此,临床上需合理抉择何时运用基因检测为神经内分泌肿瘤患者实施个体化治疗,避免过早滥用基因检测,毕竟这是一项费用高昂的检测手段。
基因检测在寻找神经内分泌肿瘤原发部位或组织起源的潜在价值
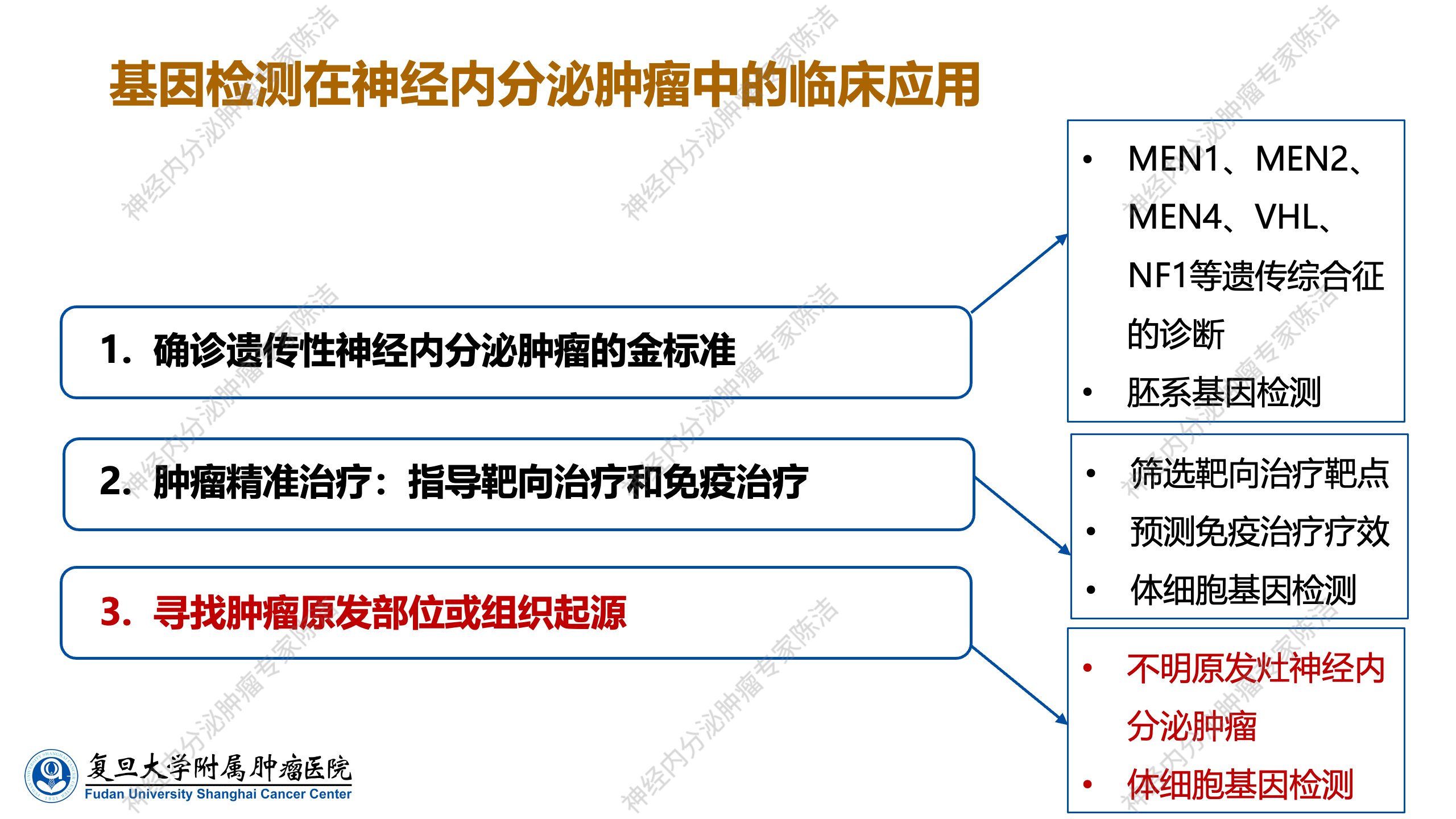
基因检测的第三个应用是针对不明原因发作的神经内分泌肿瘤,可借助基因检测手段辅助临床寻找肿瘤的原发部位或组织起源。不过,基因检测仅能提供线索,最终仍需结合影像学检查来综合判断肿瘤的原发部位或组织起源。

此表列出了不同部位(如支气管、肺、胰腺)神经内分泌肿瘤出现的不同基因突变情况,通过对这些基因突变的检测,可推测神经内分泌肿瘤的原发部位。
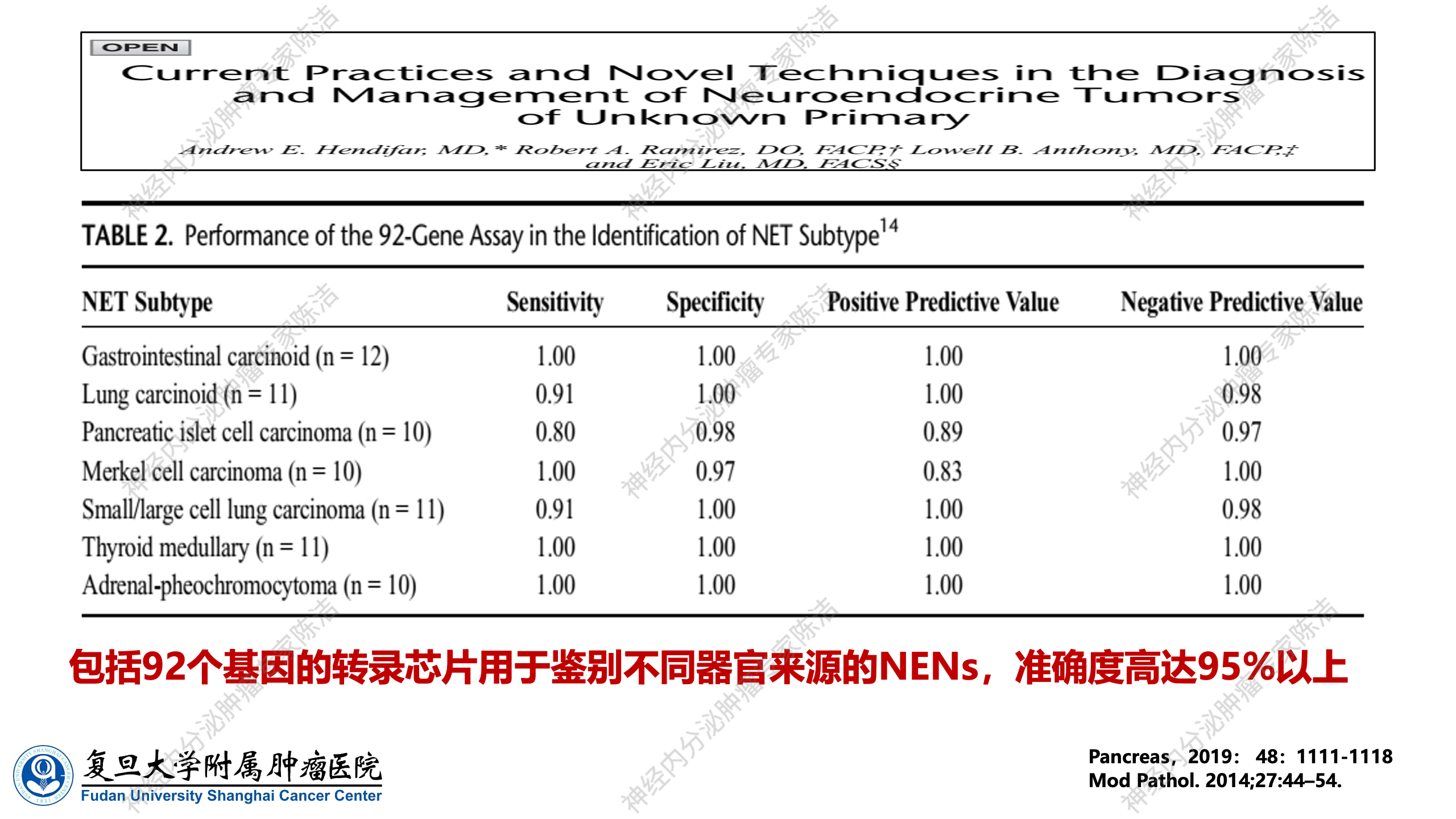
2019年,国外报道了一个包含92个基因的panel,可用于鉴别不同器官来源的神经内分泌肿瘤。该研究报道显示其准确度高达95%以上。然而,目前国内没有可用于神经内分泌肿瘤组织起源检测的芯片。国内一些用于肿瘤组织来源检测的基因芯片,在神经内分泌肿瘤中的效能较差。
总 结

临床上,对于疑诊遗传综合征或部分遗传比例发生率较高的神经内分泌肿瘤患者,需进行胚系基因突变或大片段缺失的筛查,以找出这部分遗传相关性的神经内分泌肿瘤患者。找出后,还需进一步进行致病基因家系的筛查,从而阻断致病基因在其家系中的代代遗传。
散发性神经内分泌肿瘤可靶向的治疗靶点较少,靶基因突变发生率很低,对于特定部位可能有一定价值,如肺的大细胞神经内分泌癌、结肠的神经内分泌癌、甲状腺髓样癌,通过基因检测可能筛出一些治疗靶点,但总体而言是低概率事件。免疫治疗标记物与免疫检查点抑制剂的治疗相关。临床上若要使用免疫检查点抑制剂,建议进行标志物检测,如突变负荷、微卫星状态检测,以筛选出适合用免疫制剂治疗的患者。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室第三十八期 | 神经内分泌肿瘤基因检测专场回放:
https://doctor.liangyihui.net/#/doc/160363

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


