随着科技的飞速发展,多发性骨髓瘤(MM)的治疗已进入一个多维度、个体化的全程管理新时代。MM现代治疗策略的核心在于,通过整合高效的系统性抗肿瘤治疗与关键性的支持治疗,以期达到深度且持久的疾病缓解,并最大化改善患者的生存质量。在系统治疗层面,对于适合移植的MM患者,以大剂量化疗为基础的自体干细胞移植(ASCT)至今仍是帮助患者实现长期无病生存的关键基石。与此同时,骨病作为MM最常见且具有明显破坏性的并发症之一,其管理贯穿于治疗的始终。而有效的骨保护治疗不仅能显著降低骨相关事件(SRE)的发生率、缓解疼痛,更是协同抗肿瘤治疗、改善MM患者整体预后的重要组成部分,其地位已从单纯的“支持”角色,转变为MM综合治疗体系中不可或缺的一环。为进一步明确ASCT在MM治疗中的价值以及骨保护治疗相关要点,【肿瘤资讯】特别邀请河南科技大学第一附属医院赵小强教授进行相关进展解读,详情如下。
河南科技大学第一附属医院
血液淋巴瘤病区主任,硕士研究生导师
意大利交流学者
河南省血液病学会青年委员会委员
河南省实验血液学会委员
河南省生命关怀协会慢粒联盟常委
河南省生命关怀协会淋巴瘤联盟委员
擅长淋巴瘤、急慢性白血病、多发性骨髓瘤、骨髓增生异常综合征、各种贫血、血小板减少及出凝血异常等血液病的诊治,擅长造血干细胞移植。
从“优势互补”到“创新整合”:在新药时代如何整合ASCT以构筑MM现代治疗新体系?
近年来,随着以蛋白酶体抑制剂、免疫调节剂、单克隆抗体为代表的靶向治疗及免疫治疗药物的广泛应用,初治MM患者的缓解深度与生存预后得到了明显的改善[1, 2]。然而,对于能够耐受的MM患者而言,以大剂量美法仑为预处理方案的自体造血干细胞移植(ASCT)至今仍是其获得深度、持久缓解乃至长期无病生存的重要治疗手段[2, 3]。总体而言,ASCT在适合移植MM中的临床价值主要体现在其能够显著提升患者的缓解深度,包括完全缓解(CR)和非常好的部分缓解(VGPR)率,从而转化为更长的无进展生存期(PFS),并在部分研究队列中观察到总生存期(OS)的获益[3, 4]。一项比较RVD方案(来那度胺、硼替佐米、地塞米松)与RVD方案联合ASCT治疗MM的研究结果显示,尽管两组间的中位OS无显著差异,但ASCT组患者的中位PFS显著延长(67.6个月 vs 46.2个月),证实了移植在深化缓解、延长生存方面的作用[3]。而这也确立了适合移植MM“诱导治疗-ASCT-维持/巩固治疗”的治疗模式,使得移植与新药能够优势互补,共同构筑起MM的现代治疗体系[4]。
随着细胞免疫疗法(如CAR-T细胞疗)与新型抗体药物(如双特异性抗体、抗体偶联药物)的崛起,如何将ASCT与这些创新疗法进行有效整合,已成为当前MM领域的研究热点[5]。现阶段,讨论的核心聚焦于移植的时机(早期 vs 延迟)、高危患者(如具有高危细胞遗传学特征或微小残留病(MRD)阳性的治疗策略选择,以及如何为后续的免疫治疗创造最佳条件[4, 5]。现有证据表明,ASCT是MM患者实现MRD转阴的重要途径之一,而获得MRD阴性状态与患者更优的长期生存密切相关[4]。因此,对于高危患者,早期进行ASCT以清除肿瘤负荷、实现深度缓解,可能为其后续衔接新疗法或进入临床试验提供更好的“窗口期”。
除抗MM治疗选择外,骨保护治疗亦与MM患者的生存结局和生活质量密切相关。临床实践中,临床医生应将骨保护治疗与移植的全过程紧密协同,确保在围移植期乃至移植后的长期随访中,MM患者的骨骼健康得到持续、有效的管理,从而最大化改善其生活质量与远期预后[6, 7]。
从“破骨失衡”到“协同获益”:骨保护治疗如何重塑MM患者的骨骼健康与生存结局?
MM作为一种以骨髓内单克隆浆细胞异常增殖为特征的血液系统恶性肿瘤,其标志性特征之一便是骨病。超过80%的MM患者在初次诊断时即已存在不同程度的骨骼损害,这不仅严重影响其生存质量,也对其生存时长构成重大挑战[8~9]。因此,有效的骨保护治疗不仅是简单的对症治疗,更是贯穿MM全程管理的基石治疗之一,其能直接降低SRE的发生率,并与抗MM治疗协同增效,共同改善MM患者的整体预后[8]。
MM骨病的病理核心在于肿瘤细胞驱动的破骨细胞活性异常增强与成骨细胞功能受抑所导致的失衡,最终引发骨质溶解性破坏。MM骨保护治疗的根本目标正是要打破这一恶性循环,其临床终点聚焦于预防病理性骨折、减少因严重骨破坏或脊髓压迫所必需的放疗或手术干预、有效缓解疼痛,并最终维持患者的日常活动能力与生活质量[8~9]。
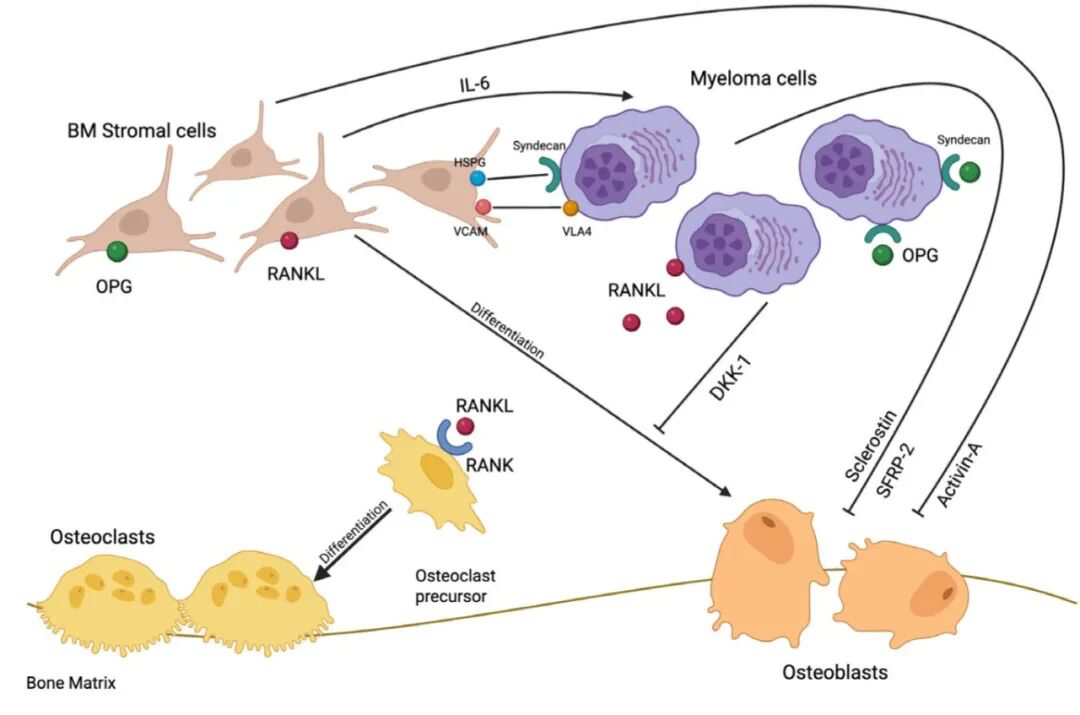
对于尚未发生SRE的MM患者,骨保护治疗旨在延缓其SRE的首次发生时间;而对于已有SRE病史的患者,则致力于降低复发风险。鉴于SRE可导致MM患者的死亡风险增加20%~40%,骨保护治疗在改善患者生存方面的价值不言而喻[8]。
为进一步优化患者的临床结局,实践中,在首次诊断MM时临床医生应全面评估患者的骨病负担并尽早启动骨保护治疗。这种积极的干预策略不仅能有效遏制骨破坏的进展,更能显著缓解MM患者的疼痛症状,改善其生理功能与心理状态[8~9]。目前,临床上首选的骨保护治疗药物主要包括RANKL抑制剂(如地舒单抗)和双膦酸盐。双膦酸盐一般通过静脉输注给药,能与骨基质结合,在破骨细胞吸收骨质时被其摄入,从而诱导其凋亡。而地舒单抗作为一种全人源化单克隆抗体,通过皮下注射给药,能特异性中和破骨细胞分化、活化和生存所必需的关键因子RANKL,从而高效抑制骨吸收。
综上所述,通过早期、持续地应用这些骨保护治疗药物,并将其与抗MM治疗紧密结合,可以有效控制骨病,降低SRE风险,显著改善患者的生活质量,为实现更长的生存期和更优的生存状态提供坚实保障[8~9]。
超越“支持”,铸就“基石”:骨保护治疗如何从“对症治疗”转变为MM全程管理的主要治疗环节?
近年来,随着对MM骨病病理生理机制认识的加深以及新型骨保护药物的问世,其治疗策略正朝着更个体化、更精准化的方向发展。究其根本,MM骨病的发生在于MM细胞与骨髓微环境的相互作用,而此过程导致破骨细胞过度活化与成骨细胞功能受抑,最终打破了骨重塑的平衡[8]。鉴于骨破坏在MM早期阶段即已启动,权威诊疗指南因此普遍建议,所有需要接受抗MM治疗的活动性MM患者,无论是否存在影像学可检测的溶骨性病变,均应尽早启动骨保护治疗。这一前瞻性干预旨在最大程度地预防或延缓SRE的发生,维持MM患者的骨骼健康,为后续的系统性抗肿瘤治疗奠定基础。
关于骨保护治疗的持续时间,权威指南最初建议应至少持续2年。然而,随着MM患者生存期的显著延长,长期治疗的必要性与安全性已成为新的议题。因此,近期的指南和研究趋势表明,对于已完成至少2年治疗且获得良好疾病控制(如达到CR或更好疗效)的MM患者,可考虑延长给药间隔(例如,从每4周一次调整为每12周一次)或在严密监测下暂停治疗。这一决策必须基于对MM患者复发风险、骨病残留负担及药物潜在长期不良反应的综合评估,并强调“以患者为中心”的个体化风险分层管理。
在药物选择上,临床医生在为MM患者制定骨保护治疗策略时,需综合考量患者的具体情况。双膦酸盐类药物主要通过肾脏清除,其在体内的蓄积可能导致肾功能损伤。鉴于肾功能不全是MM的常见并发症之一,因此这对于MM患者而言是一个不可忽视的风险[8]。相比之下,地舒单抗是一种全人源化单克隆抗体,其特异性靶向并抑制RANKL,从而阻断破骨细胞的活化与功能;正是其独特的药理学特性使其在多个临床情景下展现出优势[10]。一项大型III期临床研究的亚洲亚组数据显示,对于新诊断的MM患者,地舒单抗在预防首次SRE发生时间方面非劣效于双膦酸盐类药物。值得注意的是,地舒单抗组的SRE累积发生率呈数值上更低的趋势,且在计划进行ASCT的患者亚组中显示出潜在的优效性[11]。此外,地舒单抗通过皮下注射给药,每4周一次,操作简便且无需水化,这极大地提升了患者的治疗依从性和门诊管理效率。
尽管骨保护药物的总体安全性良好,但在治疗过程中临床医生仍需关注特定的不良事件。例如,低钙血症是多数骨靶向药物均可能引起的常见不良反应。因此在治疗前及治疗期间,MM患者应常规补充钙剂和维生素D,并定期监测血钙水平。此外,颌骨坏死(ONJ)是一种虽罕见但后果严重的并发症,因此治疗前进行全面的口腔评估和必要的牙科处理至关重要。对于需要长期治疗的患者,应定期评估ONJ风险。
总体而言,基于上述循证医学证据,骨保护治疗是MM综合管理的重要组成部分,必须与系统性抗肿瘤治疗协同进行。在MM的全程管理期间,血液科、牙科、肾内科等多学科团队更应协同配合,旨在为患者制定最优化的整合治疗方案,最终改善其预后和生活质量。
[1] GAGELMANN N, EIKEMA D J, Koster L, et al. Impact of autologous stem cell transplantation in patients with newly diagnosed multiple myeloma in the era of novel agents: a study from the Chronic Malignancies Working Party of the EBMT[J]. Haematologica, 2022, 107(12): 2893-2903.
[2] MCCARTHY P L, HAHN T, HASSEN E, et al. Maintenance with lenalidomide after autologous stem cell transplantation for multiple myeloma: a meta-analysis[J]. Journal of Clinical Oncology, 2017, 35(31): 3637-3645.
[3] RICHARDSON P G, JACOBUSS S J, WELLER E A, et al. Lenalidomide, bortezomib, and dexamethasone (RVD) ± transplantation in RVD-responder patients with newly diagnosed multiple myeloma (NDMM): final primary endpoint (PFS) analysis of the phase 3 DETERMINATION trial[J]. Blood, 2022, 140(Supplement 1): LBA-1.
[4] COSTA L J, ZHANG M J, ZHONG X, et al. Deepening of response and achievement of minimal residual disease negativity after upfront autologous stem cell transplantation in newly diagnosed multiple myeloma in the era of modern induction[J]. Blood, 2022, 140(Supplement 1): 1039-1040.
[5] SHAH N, CHHABRA S, COHEN A D, et al. Chimeric antigen receptor T-cell therapy for multiple myeloma: a practical review[J]. Journal of Clinical Oncology, 2024, 42(1): 92-104.
[6] TERPOS E, ZAMAGNI E, LENTZSCH S, et al. Advances in supportive care for multiple myeloma-related bone disease—a review[J]. Cancers, 2025, 17(8): 2166.
[7] ENGELHARDT M, ISERNHAGEN J, KLAUS J, et al. Incidence and prevention of skeletal-related events in multiple myeloma patients: a real-world study[J]. JHA, 2022, 5(4): 669-678.
[8]Bernstein, Z.S.; Kim, E.B.;Raje, N. Bone Disease in Multiple Myeloma: Biologic and Clinical Implications. Cells 2022 , 11 , 2308. https://doi.org/10.3390/ cells11152308
[9]Mukkamalla S K R, Malipeddi D. Myeloma bone disease: a comprehensive review[J]. International journal of molecular sciences, 2021, 22(12): 6208.
[10]homas D, Henshaw R, Skubitz K, et al. Denosumab in patients with giant-cell tumour of bone: an open-label, phase 2 study[J]. The Lancet Oncology, 2010, 11(3): 275-280.[11]Wajda BG, Ferrie LE, Abbott AG, Elmi Assadzadeh G, Monument MJ, Kendal JK. Denosumab vs. Zoledronic Acid for Metastatic Bone Disease: A Comprehensive Systematic Review and Meta-Analysis of Randomized Controlled Trials. Cancers (Basel). 2025 Jan 24;17(3):388. doi: 10.3390/cancers17030388. PMID: 39941757; PMCID: PMC11816125.
排版编辑:肿瘤资讯-LBJ











 苏公网安备32059002004080号
苏公网安备32059002004080号


