消化系统肿瘤是我国高发、高死亡率的重大疾病,患者确诊时多为中晚期,预后不佳。新兴的免疫治疗为晚期患者带来了长期生存的希望,但在消化道肿瘤中,其单药有效率普遍偏低且缺乏精准的疗效预测标志物。
针对这些临床困局,中山大学肿瘤防治中心消化肿瘤团队围绕“免疫联合治疗”、“疗效精准预测”及“耐药机制与克服”三大方向,开展了一系列临床与转化研究,取得了诸多突破性成果,为提升我国消化道肿瘤免疫治疗水平、改善患者生存提供了重要的“中国方案”和新思路。
在山东大学齐鲁医院“齐肿内科大查房”第184期“研究者说”栏目中,中山大学肿瘤防治中心骆卉妍教授以研究者视角进行了详细分享与深度解读。
中山大学肿瘤防治中心 主任医师,教授,博士生导师
中山大学肿瘤防治中心内科二病区区长
国家优秀青年医师、广东省科技创新领军人才
中国抗癌协会胃癌专委会青年工作组 副组长
中国抗癌协会人工智能专委会 委员
中国临床肿瘤学会食管癌专委会 委员
广东省抗癌协会免疫治疗专委会 主任委员
广东省临床医学学会消化肿瘤综合治疗青委会 主任委员
广东省抗癌协会靶向治疗专委会 候任主任委员
先后荣获"人民好医生-金山茶花计划"胃癌领域杰出贡献专家 "国之名医-优秀风范"等称号
以第一/通讯作者在JAMA、Nat Mater、Nat Med、Landcet Oncol、Gut, Ann Oncol等杂志上发表SCI论文60余篇。荣获国家科技进步奖二等奖一项、省部级一等奖5项、中国医学科学院"2021年度重要医学进展"

(一)探索免疫联合治疗新策略
消化道肿瘤因其新抗原负荷低、肿瘤微环境“冷”的特点,对单药免疫治疗响应不佳。研究的核心策略在于,通过联合治疗改变肿瘤细胞的免疫原性和重塑肿瘤免疫微环境,以提高疗效。
免疫与化疗的联合
传统的化疗药物能通过诱导肿瘤细胞免疫原性死亡来激活抗肿瘤免疫。中肿团队在基础研究中发现,紫杉醇类药物通过影响胆固醇代谢重编程,可诱导比传统5-FU更强的免疫原性死亡。
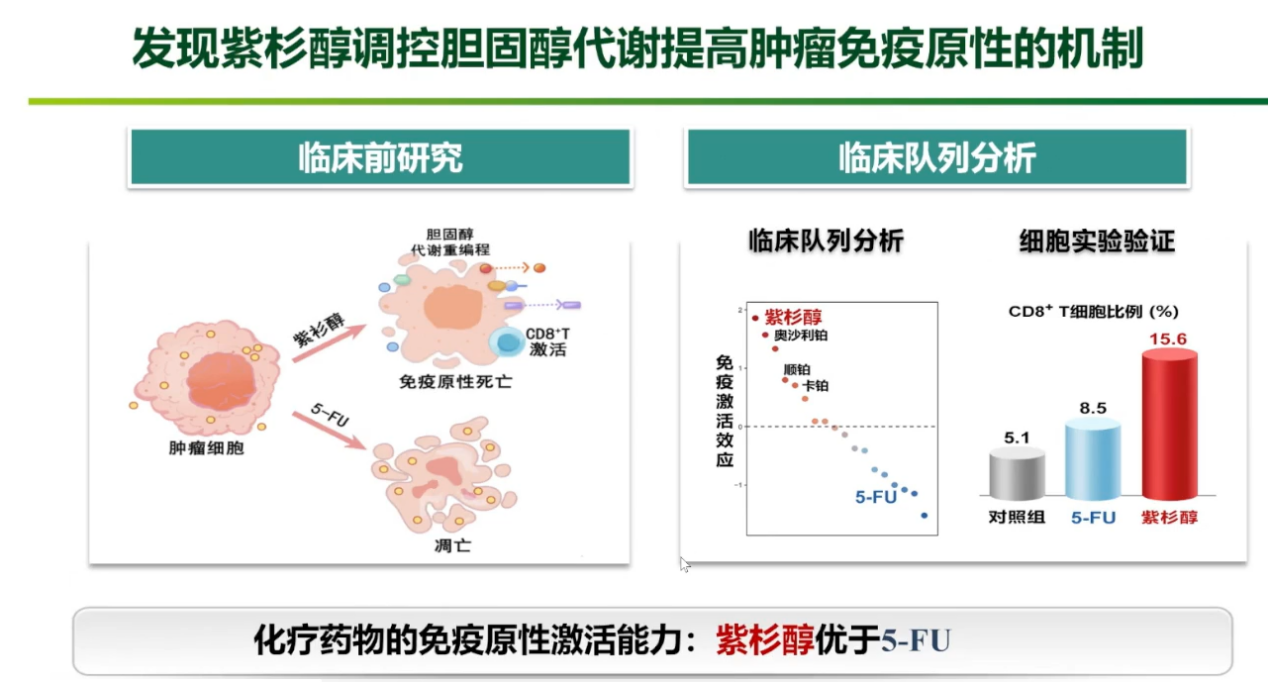
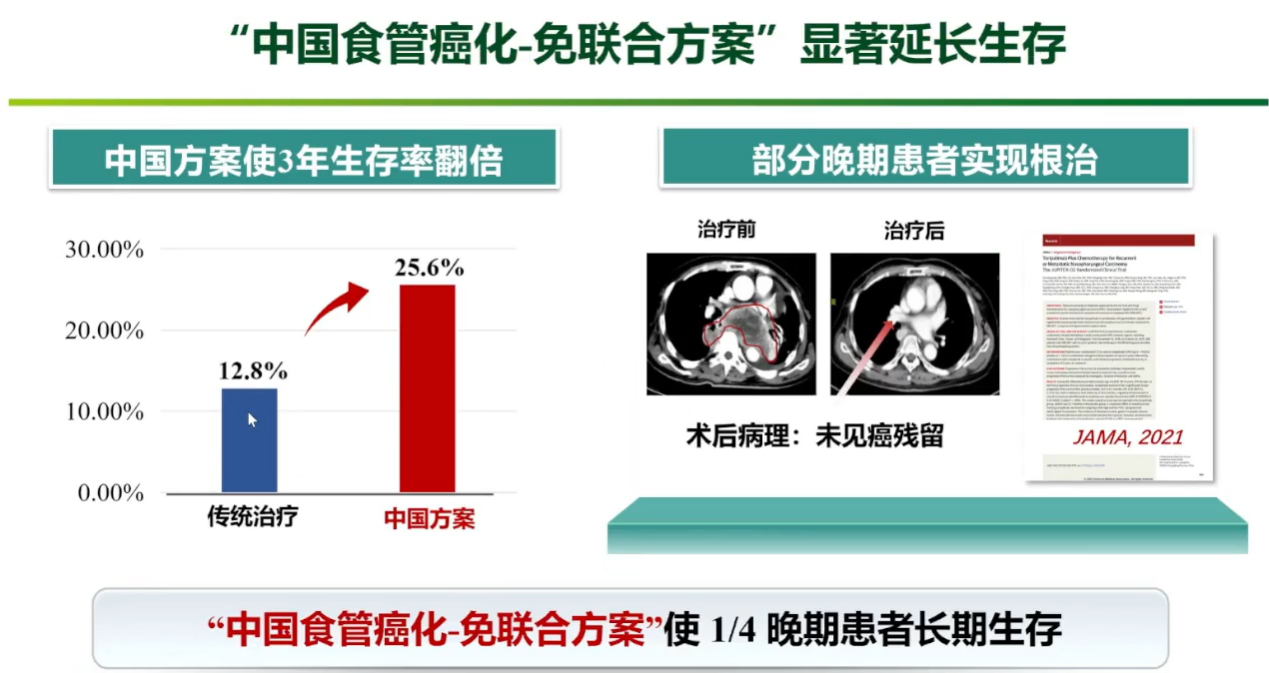
基于此,团队开展了ESCORT-1st的III期关键性研究,采用“紫杉醇+顺铂+PD-1抑制剂”这一免疫原性更强的“中国方案”一线治疗晚期食管癌。研究结果证实,该方案相较于单纯化疗,可使近四分之一的患者获得长期生存(3年生存率达到25.6%),甚至使部分晚期患者的肿瘤显著退缩,重获根治性手术机会。该“中国方案”的客观缓解率(ORR)高达72%,明显高于欧美以5-FU为基础的方案数据。这项研究成果发表于国际顶级期刊JAMA,并被ASCO、ESMO等多个国际权威指南采纳,改写了全球食管癌的治疗格局。
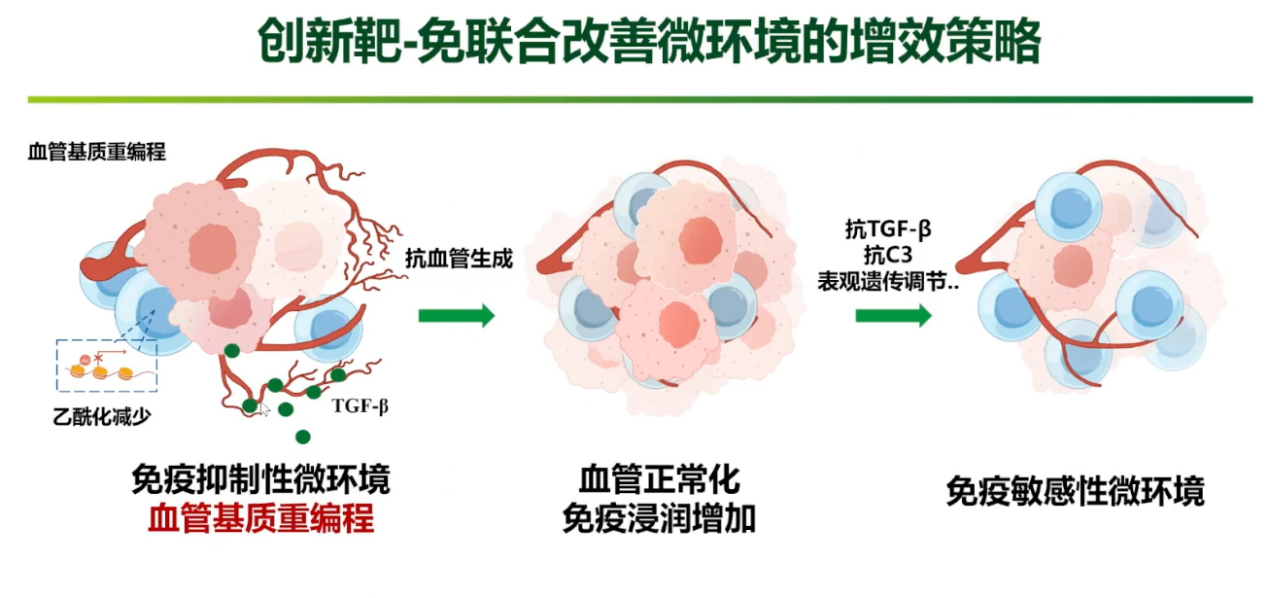
免疫与抗血管生成药物的联合
消化道肿瘤的“冷”微环境与未成熟的肿瘤血管密切相关。因此,另一项核心策略是以“抗血管生成”为中心,重塑免疫微环境。
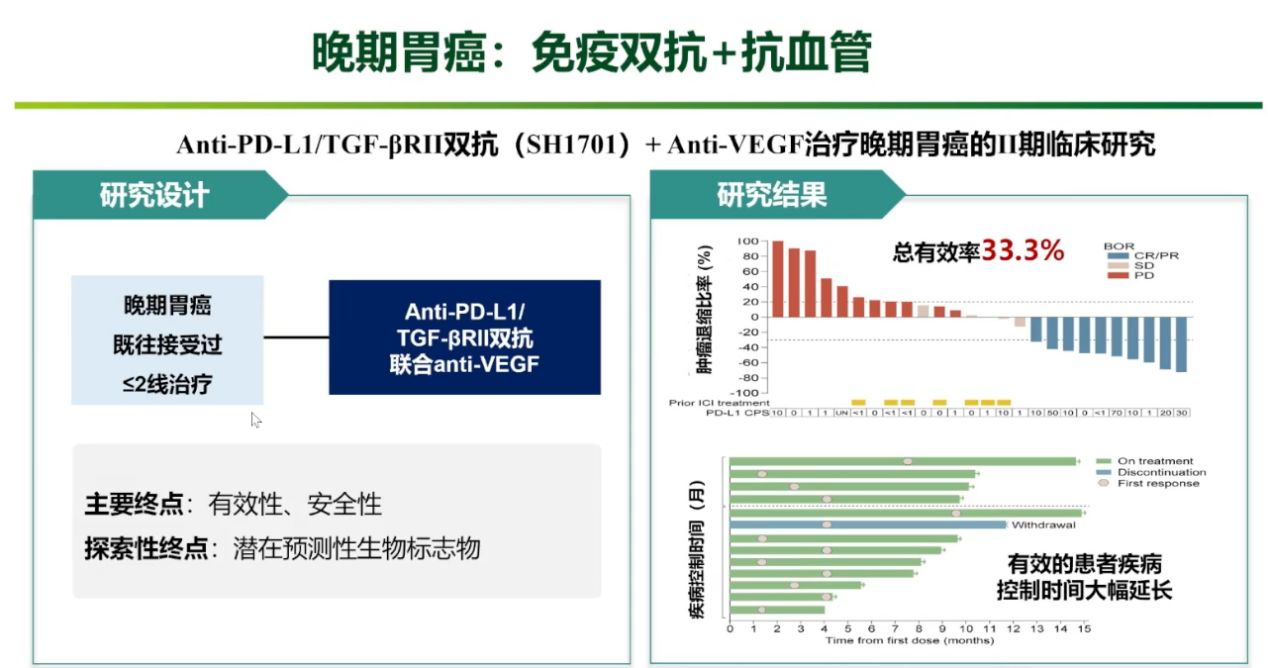
在晚期胃癌中,研究团队探索了PD-L1/TGF-β双抗联合抗血管生成药物的“去化疗”方案。对于一线标准治疗失败的晚期胃癌患者,该方案的ORR达到33.3%,且在有效患者中,疾病控制时间大幅延长,远超常规二线治疗。
在结直肠癌一线治疗领域,团队开展的II期临床研究探索了“免疫双抗(抗PD-L1/TGF-βRII)+化疗(XELOX)+抗血管生成”的四药联合方案。针对初治的晚期MSS型结直肠癌患者,这一创新组合取得了令人鼓舞的结果。研究显示,总有效率达到了59.7%,中位无进展生存期(PFS)延长至10.3个月,显示出强大的肿瘤控制能力,并为这部分患者群体带来持续缓解的希望。
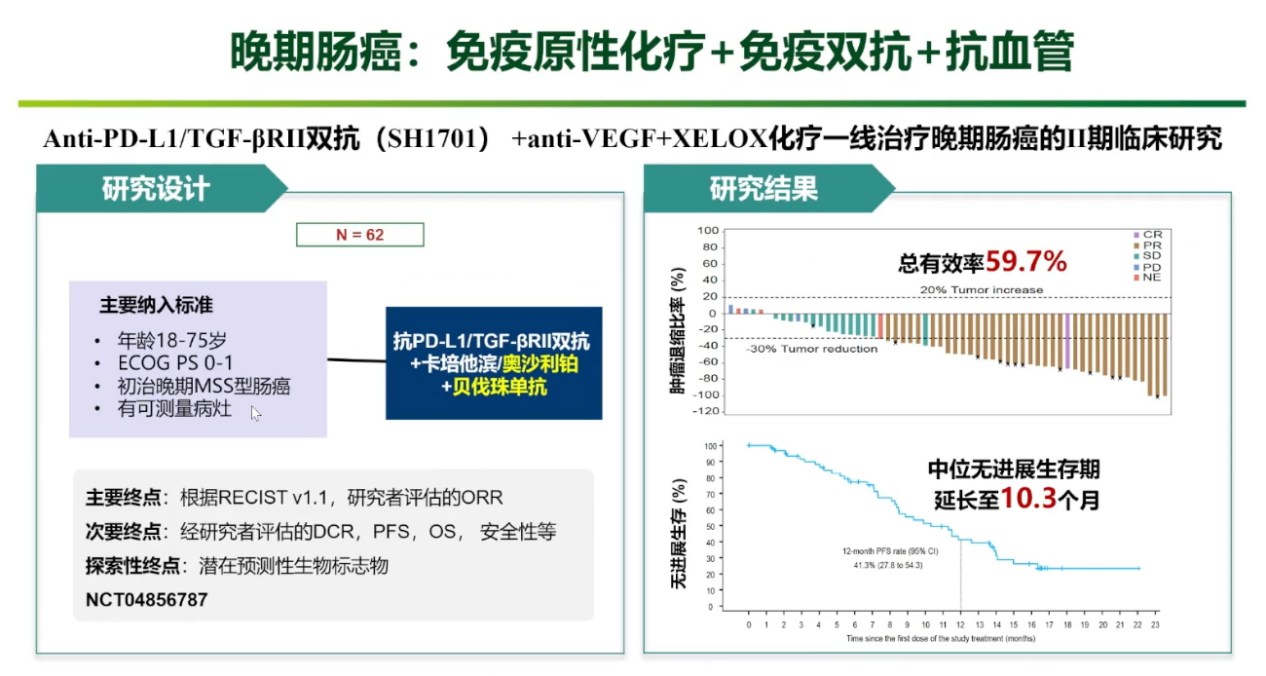
免疫与表观遗传+抗血管生成药物的联合
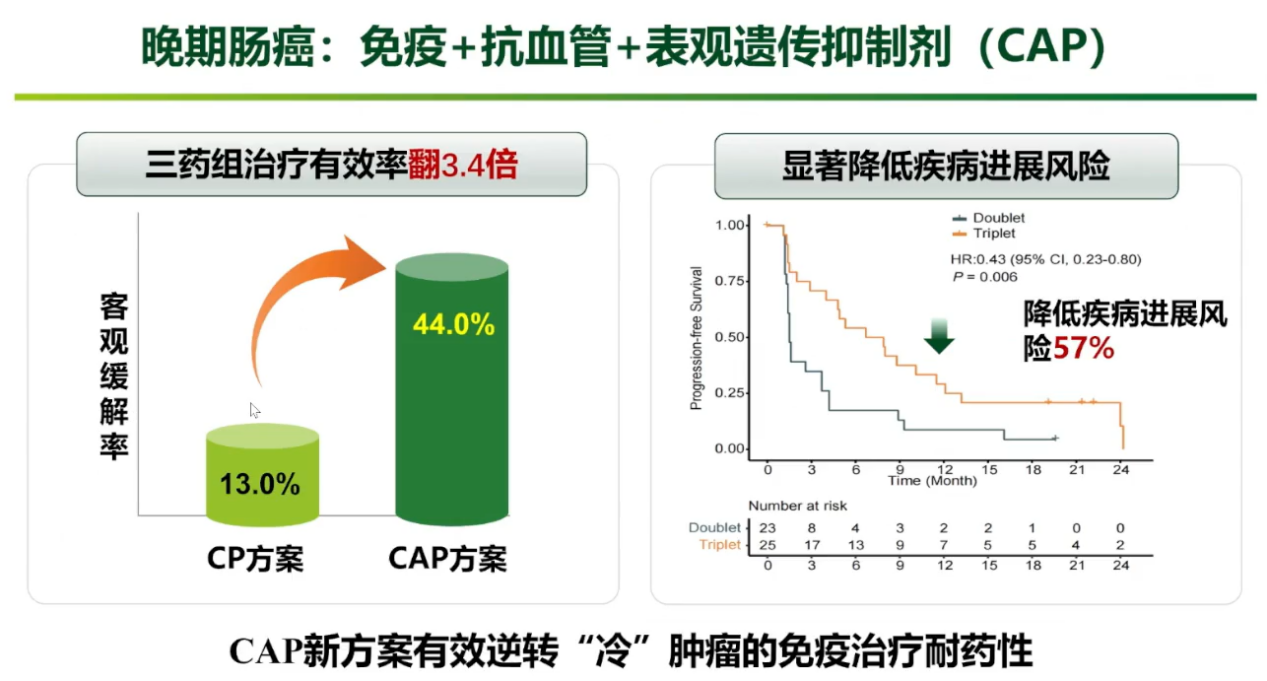
在动物研究中,团队发现表观遗传抑制剂与抗血管可协同提升CD8+ T细胞的浸润及功能,重塑免疫微环境。基于此,团队在结直肠癌后线治疗领域进一步探索了“表观遗传抑制剂(西达本胺)+PD-1抑制剂+抗血管生成药物(贝伐珠单抗)”的CAP方案。在标准治疗失败的晚期结直肠癌患者中,该三药联合方案的ORR高达44%,相比传统三线治疗不足5%的有效率实现了巨大突破,疾病进展风险降低57%,PFS从既往的2个月左右延长至7.3个月。研究中的典型病例显示,一例六线治疗失败的患者在使用该方案后,肺部病灶几乎完全消失,并获得了接近3年的无进展生存。
(二)精准筛选免疫治疗敏感亚型
为了将“好钢用在刀刃上”,精准筛选能从免疫治疗中获益的人群至关重要。团队从多组学和液体活检两个方向进行了深入探索。
泛癌:EPHA7突变等对免疫治疗敏感
通过对公共数据库的挖掘,首次发现EPHA7基因突变是泛癌种中预测免疫治疗疗效的潜在标志物。EPHA7突变型患者较野生型患者接受免疫治疗的有效率可从29%提高至52%,PFS和总生存期(OS)也显著延长。
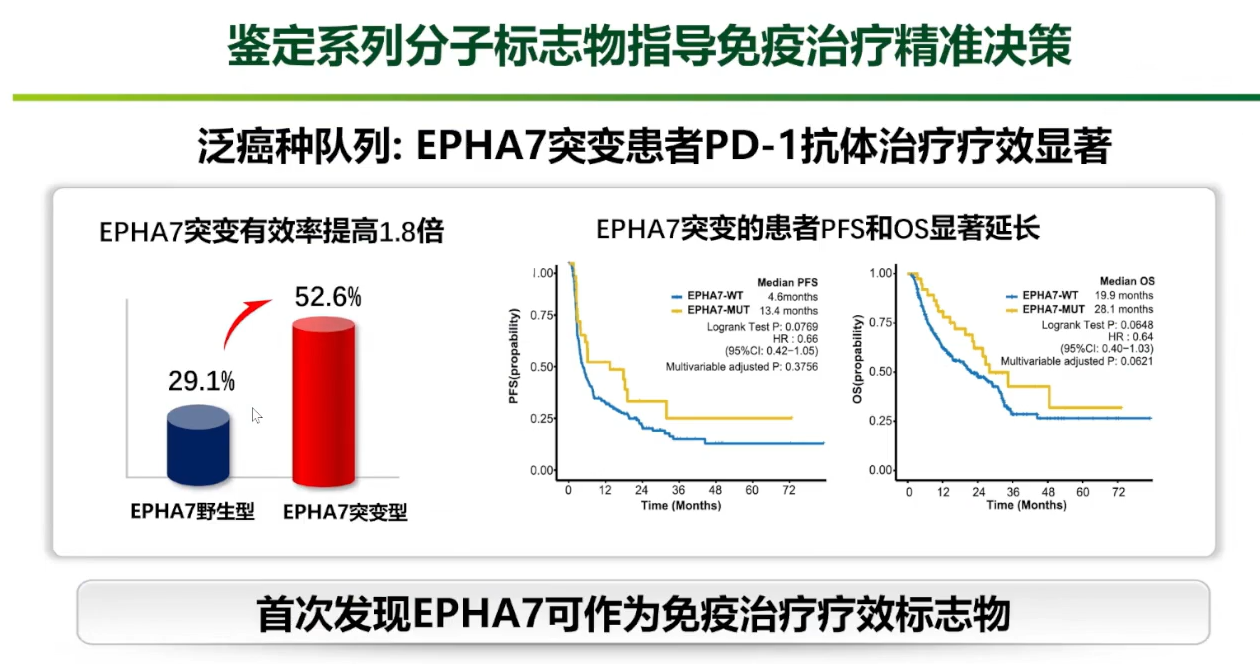
另一项针对食管癌的探索,首次鉴定出与免疫治疗结局密切相关的外泌体长链非编码RNA(lncRNA),并将其命名为RIME。临床数据验证,血液中RIME高表达的患者,其客观缓解率(11.6% vs 40.0%)和疾病控制率(37.2% vs 73.3%)均明显低于低表达组,且总生存期和无进展生存期也更差。这一发现为筛选食管癌免疫治疗优势人群提供了重要的无创预测指标。
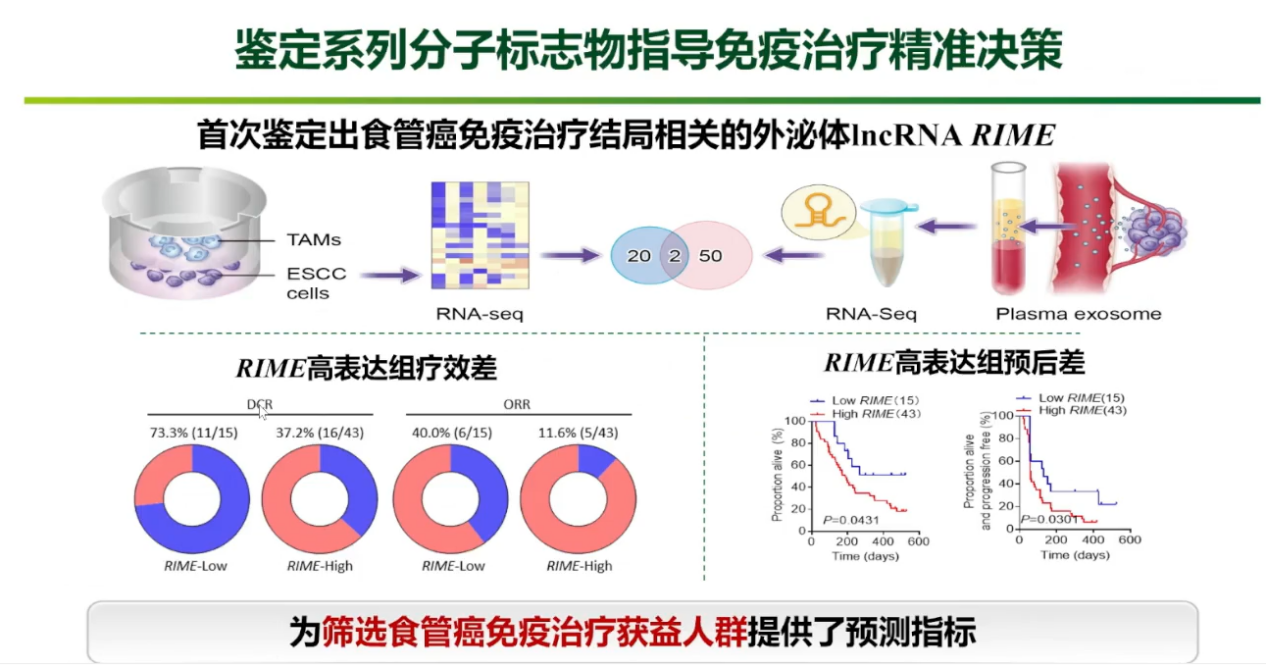
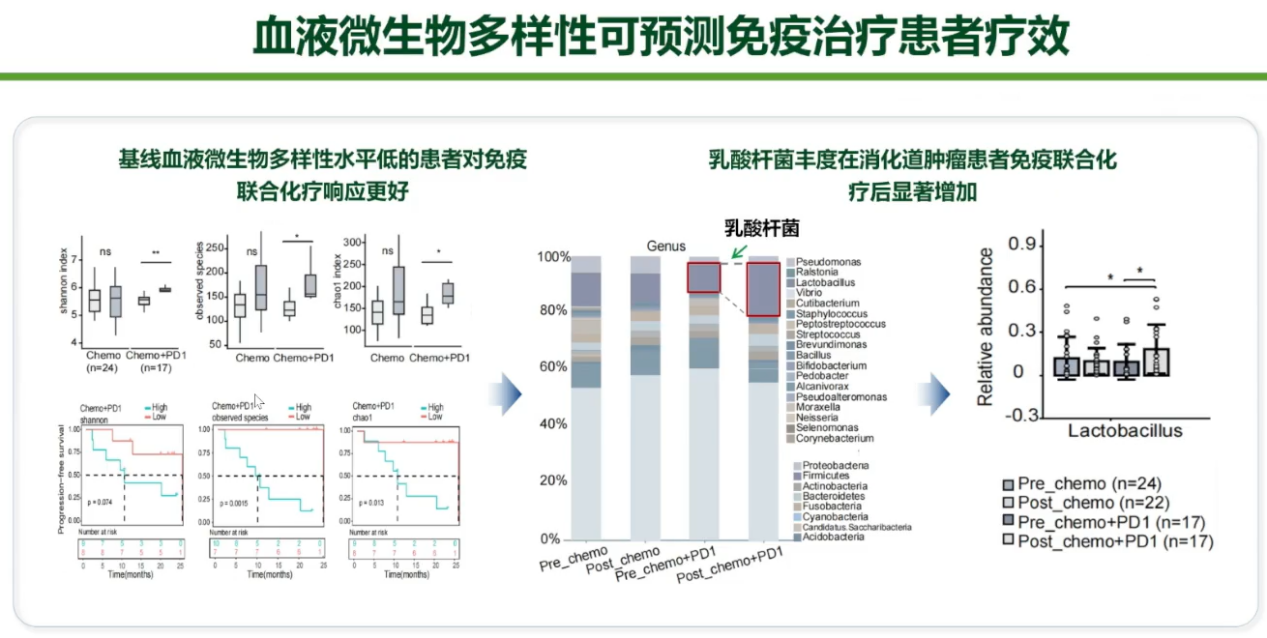
胃癌:血液菌群预测免疫治疗疗效
团队创新性地从血液中探索菌群对免疫疗效的预测价值。研究发现,治疗前血液微生物多样性较低的患者,更能从免疫联合化疗中获益。而在治疗过程中,乳酸杆菌丰度增高的患者免疫治疗疗效更佳。这一发现在动物实验中得到验证,提示血液菌群可作为便捷的疗效预测及潜在的增效手段。
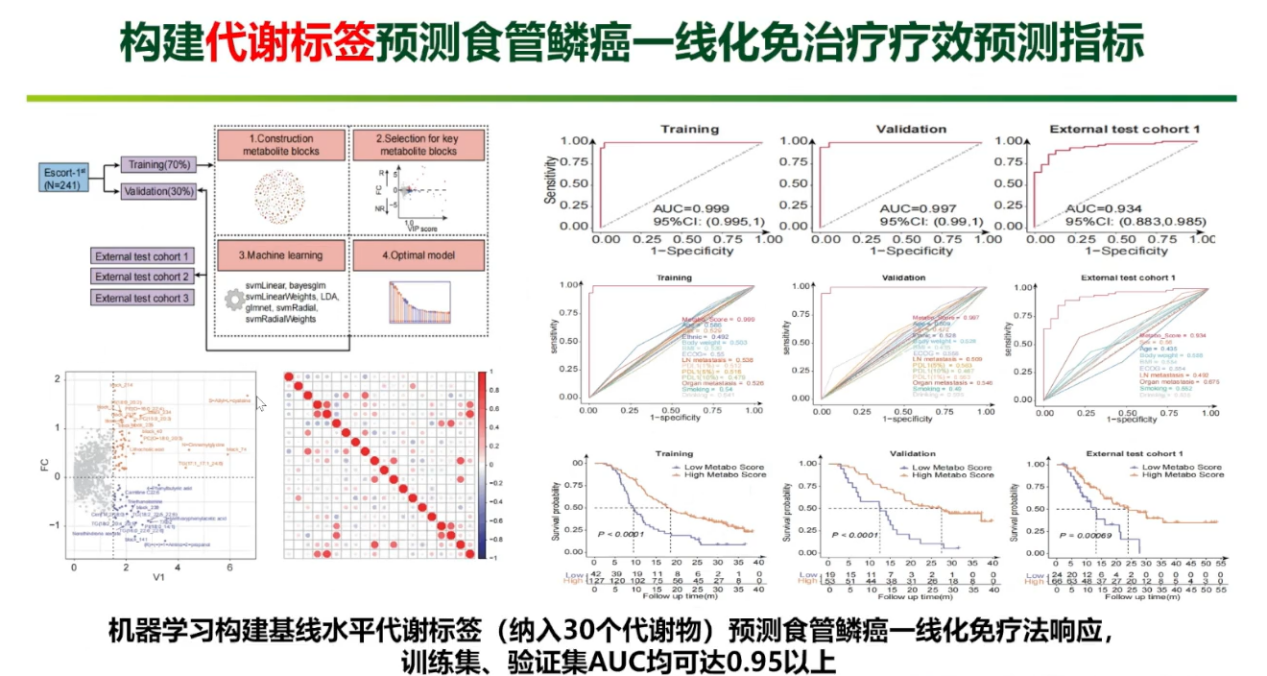
食管癌:血液代谢组疗效预测模型
在血液代谢组学方面,团队同样取得了重要突破。基于其开展的ESCORT-1st研究队列,研究团队针对食管癌患者,开发了一套动态且互补的血液代谢物预测模型体系。该体系功能强大,在治疗开始前,通过分析30种基线代谢物便能有效区分“响应者”与“无响应者”;通过捕捉治疗前后血清代谢物的动态变化,更能精准预测哪些患者能够获得长期生存。
研究还发现了鞘磷脂等“风险代谢物”和甘油磷脂等“保护性代谢物”,它们的水平变化构成了一个动态风险预警系统,使医生可在治疗过程中的任何时间点评估患者的疾病进展风险。此外,基于研究还筛选出饮食来源的可调节免疫治疗疗效的代谢物,发现来源于大蒜、卷心菜的外源性代谢物也与疗效密切相关,并在动物实验中证实,主动补充这些代谢物能协同增强抗肿瘤效果。
(三)转化研究探索免疫治疗增效新策略
针对免疫治疗耐药这一核心难题,团队从肿瘤内源性、微环境和宿主宏环境三个层面,深入探索了耐药机制并提出了新的增效策略。
鉴定肿瘤内源性治疗抵抗新机制及新靶点
从肿瘤细胞自身着手,研究揭示了两条新通路。一是发现肿瘤酸性微环境会抑制维生素D受体(VDR)表达从而导致耐药,提示调控VDR是潜在增敏策略。二是在巨噬细胞中,调控STING信号通路可促进IL-24分泌,从而直接杀伤肿瘤并招募T细胞,为增敏免疫治疗提供了新靶点。
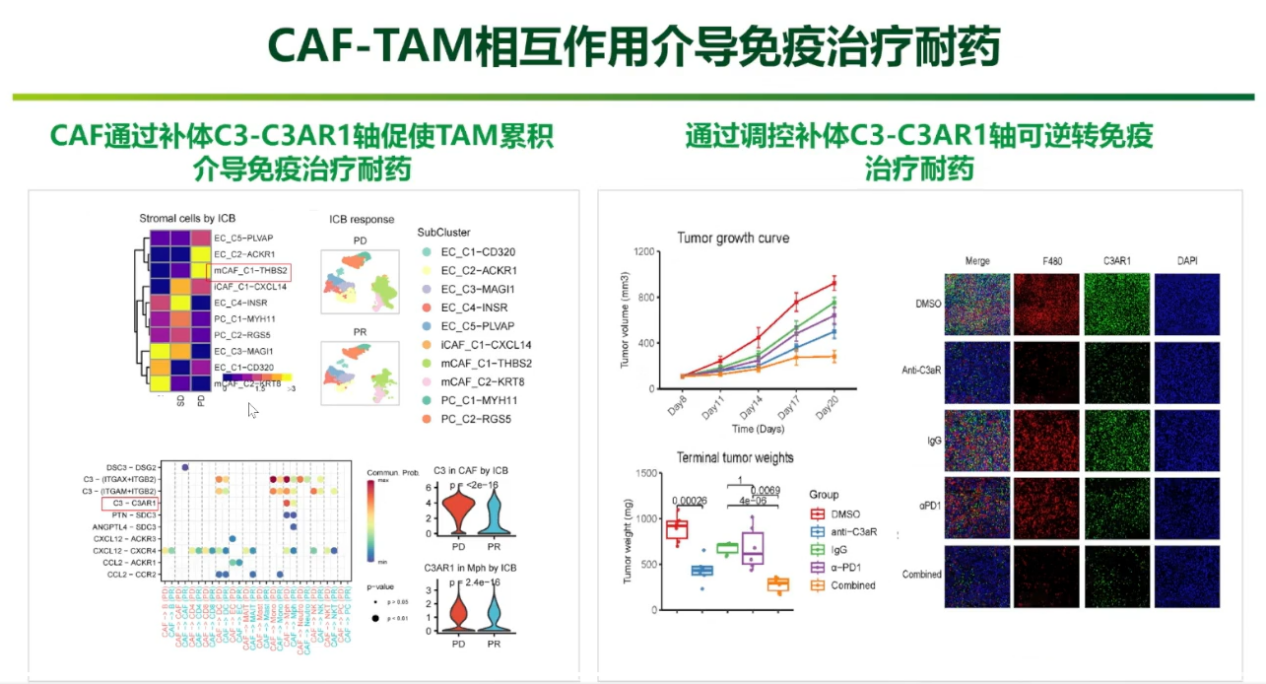
调控补体C3-C3AR1轴可逆转免疫治疗耐药
针对棘手的胃癌腹膜转移,团队开展的一项基于多组织、超40万细胞的单细胞分析揭示了其关键耐药机制。研究发现,胃癌腹膜转移微环境中富集的THBS2+成纤维细胞(CAF)通过C3-C3AR1轴促使SPP1+巨噬细胞(TAM)累积,介导免疫治疗耐药。动物实验证实,阻断C3-C3AR1信号轴,能有效逆转PD-1抑制剂的耐药,为胃癌腹膜转移治疗提供了极具潜力的免疫增敏新策略。
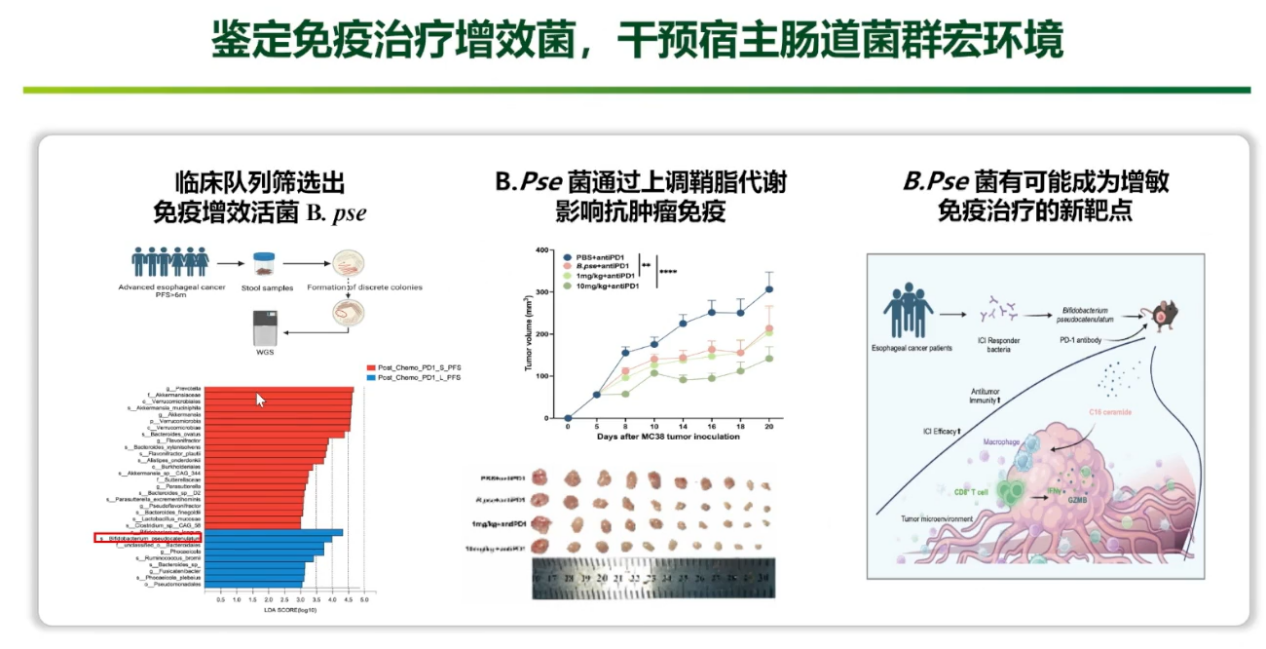
原创肠道菌剂可为免疫治疗增敏剂
团队从食管癌、胃癌、肠癌等多个临床队列中,筛选出在免疫治疗有效患者粪便中共同富集的两株关键细菌(长双歧杆菌,B.pse菌)。动物实验证实,补充B.pse菌较长双歧杆菌可更好地增强PD-1抑制剂的抗肿瘤效果。机制研究发现,B.pse菌主要通过其代谢产物——C16神经酰胺,上调鞘脂代谢通路,重塑肿瘤免疫微环境(增加CD8+T细胞浸润),从而起到增敏作用。这为开发基于肠道菌群代谢产物的新型免疫增敏剂提供了坚实的理论基础。
小结
中肿消化团队通过一系列临床与转化研究,系统地回答了如何提高消化道肿瘤免疫治疗疗效、如何精准筛选获益人群以及如何克服耐药等关键科学问题。从优化联合化疗方案的“中国智慧”,到开创性的“抗血管+”联合模式,再到发现EPHA7、血液菌群、代谢组学等新型预测标志物,以及揭示C3-C3AR1轴和肠道菌群在耐药中的新机制,这些成果不仅助力改善了患者的生存,也为未来的免疫治疗研究开辟了新的方向。
排版编辑:肿瘤资讯-AS











 苏公网安备32059002004080号
苏公网安备32059002004080号


