PAM信号通路(即PI3K/Akt/mTOR通路)在细胞生理功能中扮演重要角色。然而,一旦异常激活,它便成为多种肿瘤发生发展的关键驱动因素,也是各类癌症中最常见的激活通路之一[1]。在中国,PIK3CA突变的携带率高达32%~46.5%,其高频率突变凸显了PAM通路在中国人群中的广泛影响。
PAM通路的异常不仅会驱动肿瘤生长,还被证实与乳腺癌的多种治疗挑战紧密相关,包括对内分泌治疗、CDK4/6抑制剂、抗HER2治疗和化疗的耐药性[2]。其中,它与晚期乳腺癌内分泌治疗耐药的关联,已成为目前研究的焦点。
尽管挑战严峻,希望也随之而来。近年来,靶向PAM通路的乳腺癌药物研发突飞猛进,新药迭出,PI3K/AKT/mTOR抑制剂在临床上展现出显著益处,尤其为晚期HR+/HER2-乳腺癌患者带来了新的治疗契机,PAM通路也因此备受瞩目。为此,【肿瘤资讯】特别推出“「PAM」乳腺学院”专题,旨在与您共同探索这条前沿通路。本期,我们将首先全面梳理PAM通路的机制与流行病学。
PAM信号通路,基础机制为改变临床诊疗“奠基”
PAM通路是指PI3K/AKT/mTOR信号通路[即磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路],最先由美国科学家Lewis C. Cantley教授于1988年发现[3]。如名称所示,其主要由PI3K、Akt、mTOR 3个作用分子构成,可将细胞外和细胞内的信号整合起来,从而在细胞代谢和生存过程中发挥核心调控的作用[4]。
然而,更为重要的是,经过科学家们不断探索和研究,学界发现PAM信号通路的异常激活在包括乳腺癌在内的多种癌症的发生、发展中起到了重要作用[5]。这种异常激活不仅增强了肿瘤细胞的增殖、生长,还加强了对包括化疗、免疫治疗等在内的多种药物治疗的抵抗[4]。
具体来说,针对早期乳腺癌患者,有研究表明PAM通路的异常激活与较低的病理完全缓解率、较高的复发风险以及较短的总生存期显著相关[6, 7]。对于晚期乳腺癌,PAM通路的异常激活同样是导致生存预后不佳的重要因素[8]。
PAM信号通路的异常激活已被证实与乳腺癌对多种临床治疗的抵抗紧密关联,其中包括内分泌治疗、CDK4/6抑制剂、抗HER2靶向治疗以及化疗[2]。然而,在这些关联中,PAM通路异常激活导致HR+/HER2-乳腺癌患者对现有内分泌治疗和CDK4/6抑制剂耐药[9],是当前研究最为深入,也是药物进展最为显著的领域。其相关药物已上市并已改变临床实践、成为临床标准治疗之一。这些发现强调了PAM信号通路在乳腺癌预后判断和治疗策略制定中的重要性。
为何PAMi备受关注?
高频突变背后的治疗新希望
PAM通路的异常激活较为高发,我国广东省人民医院相关资料显示,约62.6%的我国乳腺癌患者存在至少一个PAM通路基因突变[1]。其中最常见的3个突变位点为PIK3CA(发生率约40%)、PTEN(发生率可达7.5%)、AKT1(发生率5.9%[1])。
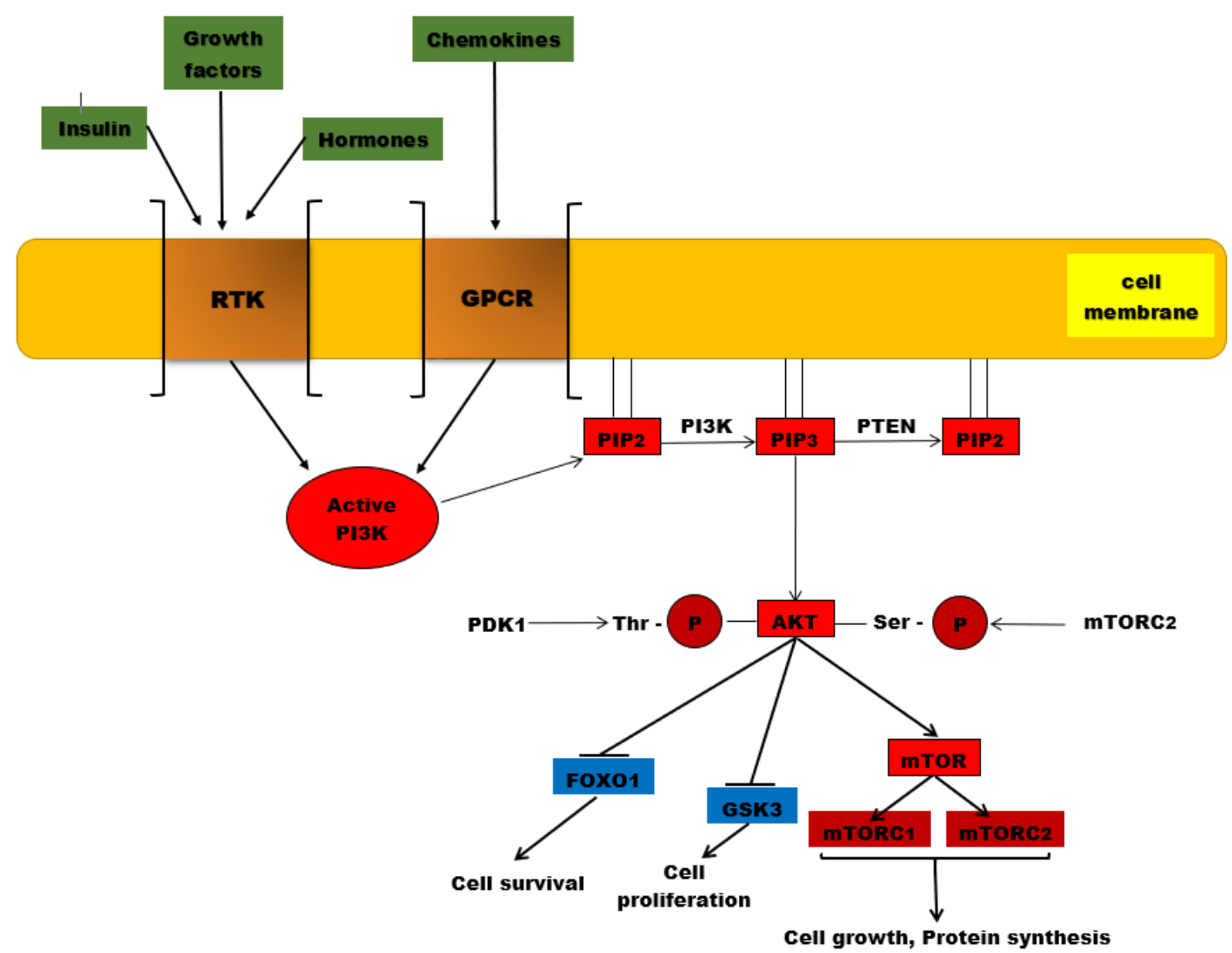
图1 PI3K/AKT/mTOR 信号通路[10]
1.PIK3CA 突变
PIK3CA突变是PAM通路发生率最高的基因突变。一般认为在中国人群中,PIK3CA 突变的携带率在 32% 至 46.5% 之间,显著高于癌症基因组图谱(TCGA) 数据库中记录的西方人群的相应数据(45.6% vs 34.7%)。
此外,在不同的乳腺癌亚型中,PIK3CA 突变的分布略有差异。对于HR+/HER2-乳腺癌,约40%的HR+/HER2-乳腺癌患者携带PI3KCA突变基因,这是HR+/HER2-乳腺癌内分泌治疗失败的重要原因。此外,无论对于ER+还是ER低表达转移性乳腺癌,PIK3CA突变均是发生率最高的基因突变。而在ER-转移性乳腺癌中,PIK3CA突变发生率也可达13%[11]。PIK3CA突变与预后不良相关,相较 PIK3CA未突变组,PIK3CA突变组患者中位PFS更短[7]。
2. PTEN功能缺失
PTEN作为PI3K/AKT通路的负调控因子,其功能缺失是乳腺癌中另一种常见的通路异常形式,主要通过以下机制实现:约5%-10%的乳腺癌存在PTEN基因突变(如错义突变、无义突变),导致蛋白功能失活;40%-50%的乳腺癌存在PTEN基因座的杂合性缺失,降低 PTEN 表达;启动子甲基化或蛋白降解异常也可导致PTEN表达下调。PTEN功能缺失会导致 PIP3 积累和 AKT 持续激活,与乳腺癌的侵袭性表型、不良预后及内分泌治疗耐药相关[10]。
在不同乳腺癌亚型中,PTEN功能缺失发生率差异显著:三阴性乳腺癌(TNBC)中高达67%,Luminal型乳腺癌为29%~44%,HER2阳性乳腺癌中则为22% [12]。
一项纳入4895例乳腺癌组织样本的回顾性研究显示,PTEN功能缺失的发生率高达54.8%,其中7.0%的样本中为PTEN基因突变[13]。
根据CAPItello-291研究的探索性分析结果,在内分泌治疗后进展或复发的HR+/HER2-晚期乳腺癌患者中,PTEN功能缺陷发生率为19%,且这些患者同样能从卡匹色替联合氟维司群治疗中获益[14]。这一发现提示,PTEN蛋白功能缺陷有望成为筛选优势患者的潜在生物标志物。
3. AKT突变
AKT是PI3K通路的核心下游分子,属于丝氨酸/苏氨酸蛋白激酶,包含三个亚型:AKT1(在多数组织中广泛表达)、AKT2(主要在胰岛素敏感组织如肝脏、胰腺、肌肉中表达)和AKT3(主要在脑和睾丸中表达)。AKT主要突变在各亚型乳腺癌中发生率相似,约为2.6%~7.4%[2]。在中国乳腺癌患者中,AKT1的突变率约为 6.4%,尤其是Luminal A型乳腺癌患者的突变率可达12.1%[15]。目前靶向AKT抑制剂卡匹色替已被证实可为内分泌治疗经治且存在 PIK3CA/AKT1/PTEN任意突变的HR+/HER2-转移性乳腺癌带来PFS获益[16]。
4.其他通路异常
除上述核心成员外,PI3K/AKT/mTOR 通路的上游或下游分子异常也可导致通路激活,例如:HER2、EGFR 等 RTKs 的扩增或过表达可通过激活 PI3K 启动通路,约 15%-20% 的乳腺癌存在HER2过表达,其与PIK3CA突变常同时出现,协同促进肿瘤进展;INPP4B 是一种磷酸肌醇 4-磷酸酶,可抑制 PI3K 通路,其缺失在乳腺癌中与 PTEN 缺失类似,可增强 AKT 活性[10]。
PAMi的临床实践与展望
目前,已有多项临床前和临床研究证实了PAMi用于乳腺癌的疗效。其中,PI3K抑制剂alpelisib(阿培利司,截至目前在我国大陆尚未上市)和伊那利塞、AKT抑制剂卡匹色替、mTOR抑制剂依维莫司已被美国FDA批准用于HR+/HER2-晚期乳腺癌的临床治疗,依维莫司于2022年2月在我国获批新增乳腺癌适应证,伊那利塞和卡匹色替分别于2025年3月、4月在我国获批上市。
于临床实践方面,随着PAMi于HR+乳腺癌的临床获益逐渐明确,相关基因检测的实施及诸如检测时机、检测标本等也掀起讨论热潮。一般而言,国内外权威指南普遍建议,针对HR+/HER2-的晚期乳腺癌患者,应在内分泌治疗进展时进行PIK3CA、AKT1和PTEN基因检测[2]。在标本选择上,通常认为组织活检的敏感性更高,而血液检测则能更好地反映肿瘤细胞的异质性。
未来,随着临床医生对PAMi认知的加深和诊疗规范化的提升,相信PAMi将惠及更多乳腺癌患者。此外,目前于临床,PAMi主要应用于HR+/HER2-晚期乳腺癌的一线或后续治疗。而在研究领域,其探索已逐步拓展至三阴性乳腺癌和HER2阳性乳腺癌。同时,新型PAMi联合治疗策略及基因检测新技术的研究也在持续进行,有望进一步优化PAM通路检测,从而实现更精准的治疗。
下一期更精彩:
后续「PAM」乳腺学院,我们将为您带来更深层次的解读。届时,我们将陆续呈现PAM通路抑制剂的最新药物进展、实际临床应用,以及不良反应管理和基因检测的详尽内容,更将为您精心整理重要共识。预知更多精彩,敬请锁定本专题!
[1] Weikai Xiao, et al. J Cancer. 2021 May 27;12(14):4408-4417.
[2] Fei Ma. Expert Consensus on the Clinical Application of PI3K/ AKT/mTOR Inhibitors in the Treatment of Breast Cancer (2025 Edition).Cancer Innovation.Cancer Innov. 2025 Apr 9;4(3):e70008. doi: 10.1002/cai2.70008.
[3] Whitman M, Downes CP, Keeler M, Keller T, Cantley L. Type I phosphatidylinositol kinase makes a novel inositol phospholipid, phosphatidylinositol-3-phosphate. Nature. 1988;332(6165):644-646. doi:10.1038/332644a0.
[4]《乳腺癌靶向PI3K/Akt/mTOR抑制剂合理用药管理专家共识》编写组. 乳腺癌靶向PI3K/Akt/mTOR抑制剂合理用药管理专家共识. 中国药房. 2025;36(11):1289-1300.
[5] Zhu, Kunrui et al. PI3K/AKT/mTOR-Targeted Therapy for Breast Cancer. Cells vol. 11,16 2508. 12 Aug. 2022, doi:10.3390/cells11162508
[6] Jank P, Karn T, van Mackelenbergh M, et al. An analysis of PIK3CA hotspot mutations and response to neoadjuvant therapy in breast cancer patients from four prospective clinical trials. Clin Cancer Res. Published online June 5, 2024. doi:10.1158/1078-0432.CCR-24-0459
[7] Zagami P, Fernandez-Martinez A, Rashid NU, et al. Association of PIK3CA Mutation With Pathologic Complete Response and Outcome by Hormone Receptor Status and Intrinsic Subtype in Early-Stage ERBB2/HER2-Positive Breast Cancer. JAMA Netw Open. 2023;6(12):e2348814. Published 2023 Dec 1. doi:10.1001/jamanetworkopen.2023.48814
[8] 赵佳宁,刘月平. 乳腺癌PIK3CA突变的临床意义及其检测研究进展[J]. 临床与实验病理学杂志,2024,40(9):973-978. DOI:10.13315/j.cnki.cjcep.2024.09.014.
[9] Schagerholm, C., Robertson, S., Toosi, H. et al. PIK3CA mutations in endocrine-resistant breast cancer. Sci Rep 14, 12542 (2024).
[10] Miricescu D, Totan A, Stanescu-Spinu II, et al. PI3K/AKT/mTOR Signaling Pathway in Breast Cancer: From Molecular Landscape to Clinical Aspects. Int J Mol Sci. 2020;22(1):173. Published 2020 Dec 26. doi:10.3390/ijms22010173
[11]Chiara Corti, et al. Differential genomic landscape of estrogen receptor (ER)-low versus ER-positive (ER+) and ER-negative (ER-) metastatic breast cancer (MBC).2025 ASCO 1071.
[12]Zhu, Kunrui et al. PI3K/AKT/mTOR-Targeted Therapy for Breast Cancer. Cells vol. 11,16 2508. 12 Aug. 2022, doi:10.3390/cells11162508
[13] Khoury K, et al. Prevalence of Phosphatidylinositol-3-Kinase (PI3K) Pathway Alterations and Co-alteration of Other Molecular Markers in Breast Cancer. Front Oncol. 2020 Aug 31;10:1475.
[14] Capivasertib–fulvestrant for patients with HRpositive/HER2-negative advanced breast cancer who had relapsed or progressed during or after aromatase inhibitor treatment: exploratory analysis of PTEN deficiency by IHC from the Phase III CAPItello-291 trial.2024 SABCS P2-03-19.
[15] Jiang YZ, Ma D, Jin X, et al. Integrated multiomic profiling of breast cancer in the Chinese population reveals patient stratification and therapeutic vulnerabilities. Nat Cancer 2024;5(4):673-690.
[16] Turner NC, Oliveira M, Howell SJ, et al. Capivasertib in Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med. 2023 Jun 1;388(22):2058-2070.
排版编辑:肿瘤资讯-zxy











 苏公网安备32059002004080号
苏公网安备32059002004080号


