肺癌靶向治疗为患者带来生存希望,但耐药问题始终是悬在医患头上的达摩克利斯之剑。国际权威期刊《J Thorac Oncol》2025年4月最新发表的研究发现,MET激酶结构域(TKD)的激活突变不仅会与其他致癌驱动基因"狼狈为奸",更会在EGFR、ALK、ROS1等常见驱动基因阳性肺癌中介导耐药。这项涉及11.5万例患者的大规模研究首次揭示,约半数MET TKD突变存在于其他癌基因驱动肿瘤中,88%的病例突变是在治疗后新发。更重要的是,研究团队通过精巧的体外实验验证了"双靶点联合打击"的治疗策略,为破解耐药困局提供了新思路。本文将带您直击这项突破性研究的核心发现。
研究背景
随着精准医疗发展,针对EGFR、ALK等驱动基因的靶向药物显著改善了非小细胞肺癌(NSCLC)患者预后,但耐药问题仍不可避免。既往研究显示,MET信号通路的异常活化是重要的旁路耐药机制,其中MET扩增(METamp)最为常见,在EGFR、KRAS等突变型肺癌的耐药中屡见报道。然而,MET激酶结构域(TKD)点突变作为耐药机制的研究仍存空白。
MET TKD突变最初在肾乳头状癌中被发现具有致癌作用。本团队前期研究证实,这类突变在0.15%的NSCLC中独立驱动肿瘤生长,但另有半数病例同时存在其他致癌驱动基因。值得注意的是,临床观察发现部分患者在靶向治疗进展后新发MET TKD突变,提示其可能作为获得性耐药机制。然而,这种突变在不同癌基因背景下的分布特征、获得性演变规律及其耐药机制的系统研究仍属空白。
研究方法
研究团队整合了来自GENIE、TCGA等数据库及Dana-Farber、MSKCC等机构的115,601例NSCLC基因组数据,筛选出173例携带致癌性MET TKD突变的病例。通过排除MET外显子14跳跃突变及治疗相关突变后,最终确定69例伴随其他致癌驱动基因的病例进行深入分析。
体外实验构建了EGFR(PC9)、KRAS G12C(H358)、ROS1融合(HCC78)、ALK融合(H3122)四种致癌驱动基因驱动的细胞模型,通过慢病毒转染引入常见MET突变(H1094Y/D1228N)。采用细胞增殖实验、信号通路分析及协同效应评估,系统研究突变对靶向药物敏感性的影响,并探索联合治疗策略。突变特征分析采用SigMA算法,追溯APOBEC等突变印记的贡献。
结果
1、不同致致癌驱动基因驱动的NSCLC中MET TKD突变的频率和类型
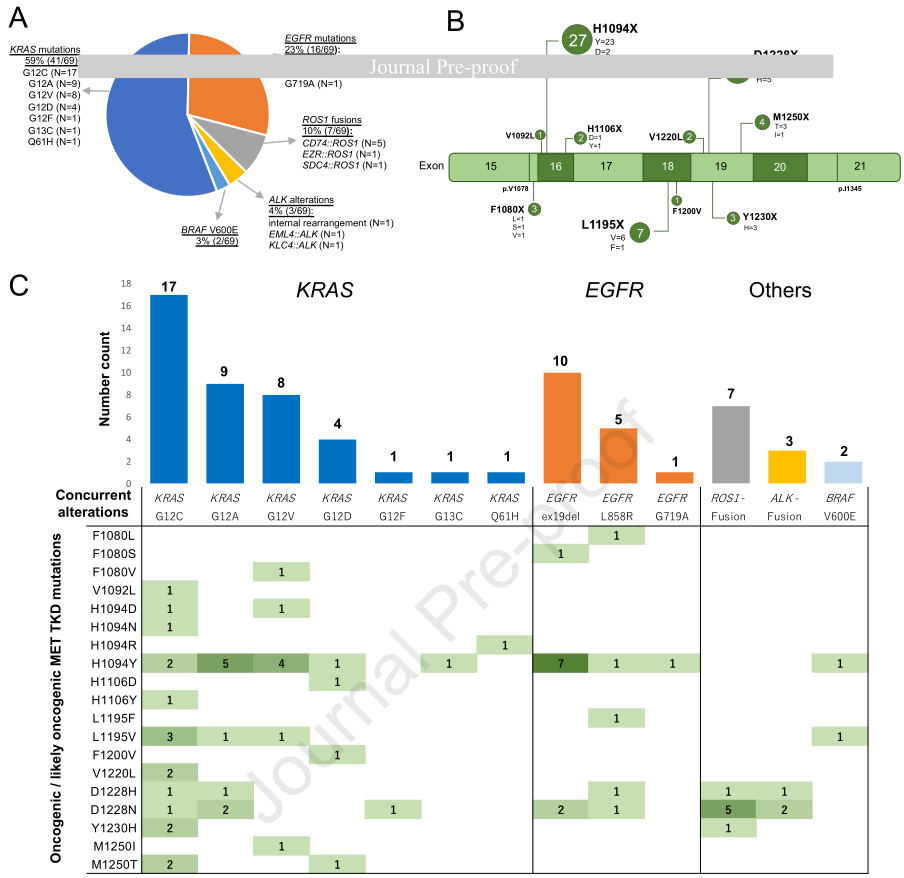
共对115,601例NSCLC患者进行了MET TKD突变筛查。为避免在接受MET酪氨酸激酶抑制剂(TKI)治疗后,MET TKD突变成为潜在的靶向耐药机制的情况,研究排除了同时存在MET第14号外显子跳跃(METex14)突变的病例。最终,在合并队列中,有706例(0.6%)NSCLC患者携带MET TKD突变且无同时发生的METex14改变。根据OncoKB注释确定MET TKD突变的致癌性,结果显示,在合并队列中,有173例(0.15%)NSCLC患者携带致癌或可能致癌的MET TKD突变。在这173例NSCLC病例中,43%(74/173)存在涉及KRAS、EGFR、ROS1、ALK或BRAF的同时性致癌变异,而57%(99/173)没有同时致癌变异。并非所有病例都可获得MET扩增(METamp)状态,但对这173例病例的治疗史进行详细回顾后发现,有5例MET TKD突变是在针对METamp靶向治疗后获得的,且均发生在EGFR突变的NSCLC中,因此这些病例被排除在外。最终,有69例NSCLC患者具有致癌/可能致癌的MET TKD突变,且同时存在与MET无关的致癌变异。
最常见的同时性致癌变异是KRAS突变(41/69,59%),其次是EGFR突变(16/69,23%)、ROS1融合(7/69,10%)、ALK重排(3/69,4%)和BRAF V600E突变(2/69,3%)(图1A)。在KRAS突变的NSCLC中,最常见的突变是KRAS G12C(41%,17/41),其次是KRAS G12A(22%,9/41)等。在EGFR突变的NSCLC中,EGFR突变主要是19号外显子缺失(63%,10/16)和L858R突变(31%,5/16)。在ROS1变异的NSCLC中,CD74::ROS1融合是最常见的变异(71%,5/7),而在ALK变异的NSCLC中,分别检测到1例内部重排、EML4::ALK融合和KLC4::ALK融合。MET TKD突变最常出现在H1094位点(n=27),其次是D1228位点(n=19)、L1195位点(n=7)、M1250位点(n=4)、Y1230位点(n=3)等(图1B)。虽然大多数致癌/可能致癌的MET TKD突变在有或无同时性致癌变异的情况下均可检测到,但F1080位点的突变仅在合并其他致癌变异时被检测到。
重要的是,MET TKD突变的分布因同时存在的致癌变异而异(图1C)。在KRAS和EGFR突变的NSCLC中,MET H1094都是最常发生突变的位点,在KRAS突变的NSCLC中占41%(17/41),在EGFR突变的NSCLC中占56%(9/16);而在ROS1和ALK变异的NSCLC中,D1228是最常发生突变的位点,在ROS1变异的NSCLC中占86%(6/7),在ALK变异的NSCLC中占100%(3/3),相反,这些病例中没有涉及MET H1094的突变。有趣的是,在这些ROS1和ALK驱动的亚组中检测到的所有MET TKD突变,如D1228N/H和Y1230H,都被定义为对克唑替尼耐药的突变,且没有克唑替尼敏感的突变,如H1094Y。
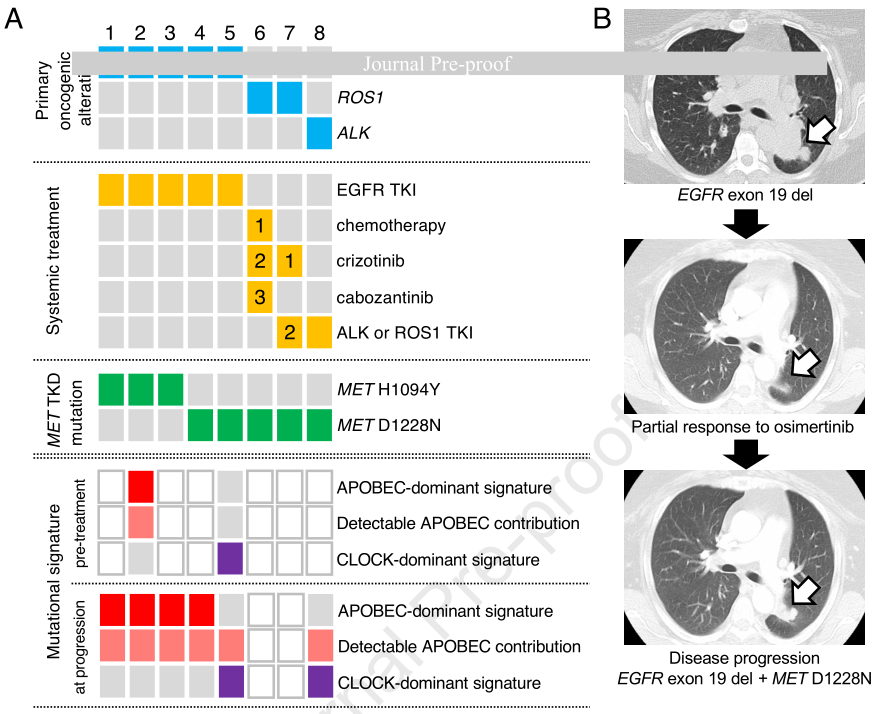
2、致癌基因驱动的NSCLC中获得性MET TKD突变的病例系列
DFCI/MSKCC患者队列提供了临床病理和治疗史注释。从这两个机构确定了8例携带MET TKD突变且伴有同时性致癌变异的NSCLC病例(图2A)。在8例病例中,有7例(88%)在基线时不存在MET TKD突变,而是在疾病进展时获得,且未发现其他耐药机制,这支持了MET TKD突变作为对系统治疗获得性耐药的脱靶机制的作用。在这7例病例中,5例EGFR突变的NSCLC患者在接受EGFR TKI治疗后获得了MET H1094Y(n=3)或D1228N(n=2)突变;2例ROS1融合阳性的NSCLC患者在接受ROS1-TKIs治疗后发生了MET D1228N突变。第8例患者在检测到KLC4::ALK融合的同时检测到MET D1228N突变,但只有治疗后的二代测序(NGS)数据,无法确定MET TKD突变是在基线时就存在还是在治疗后获得的。图2B展示了1例EGFR突变的NSCLC中获得性MET TKD突变的代表性病例(病例4),该患者在接受奥希替尼治疗27个月后出现疾病进展,NGS检测显示存在获得性MET D1228N突变,且无其他耐药机制。
使用SigMA算法对突变特征评估:2例治疗前病例(病例2和病例5)和6例治疗后病例(病例1 - 5和病例8)。对于治疗前病例,病例2具有APOBEC主导的特征,病例5具有CLOCK主导的特征。在6例治疗后样本中,67%(病例1 - 4)具有APOBEC主导的特征,33%(病例5和病例8)具有CLOCK主导的特征,且所有病例中均检测到APOBEC的贡献。更具体地说,MET H1094Y(TCA>TTA)和MET D1228N(AGA>AAA,互补链TCT>TTT)所涉及的三核苷酸背景均与APOBEC诱变一致。
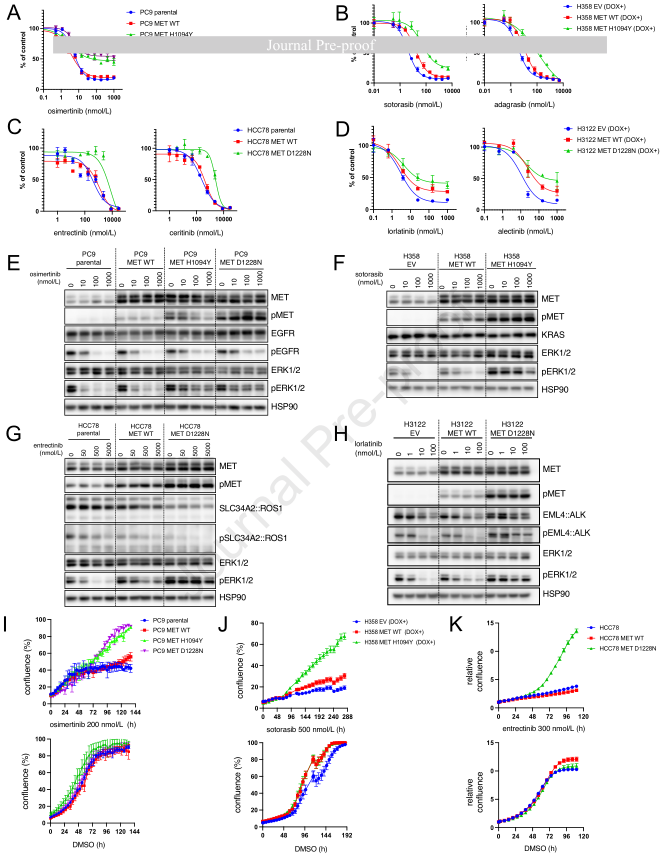
3、致癌基因阳性NSCLC细胞系中MET TKD突变对靶向治疗的耐药性
通过将最常检出的MET TKD突变(MET H1094Y或D1228N)转染至相应的致癌驱动基因阳性细胞系中,在体外模拟了MET TKD突变在致癌驱动基因阳性NSCLC中的作用。两种MET TKD突变均被转染到EGFR 19号外显子缺失的细胞系PC9中,MET H1094Y还被转染到KRAS G12C突变的细胞系H358中。此外,在SLC34A2::ROS1融合阳性细胞系HCC78和EML4::ALK融合阳性细胞系H3122中模拟了MET D1228N突变。由于即使在没有TKD突变的情况下,MET过表达也可介导耐药,因此除了仅表达内源性MET的亲本细胞外,转染了野生型MET(MET WT)的细胞也被用作对照。有趣的是,在转染了MET WT和D1228N的HCC78细胞中观察到SLC34A2::ROS1表达下降。在1例携带SLC34A2::ROS1的NSCLC患者中,当肿瘤在接受劳拉替尼治疗后因METamp介导的耐药而进展时,也报道了在MET介导的耐药背景下ROS1表达的丧失。
在所有四种细胞系中,转染了MET H1094Y或D1228N的细胞对靶向治疗产生了耐药性(图3)。与对照细胞或PC9 MET WT细胞相比,转染了MET H1094Y或D1228N的PC9细胞在奥希替尼治疗下细胞活力增加(图3A)。在H358细胞中,使用索托拉西布或阿达格拉西布治疗时,细胞活力也有所增加(图3B);在HCC78细胞中,使用恩曲替尼或色瑞替尼治疗时,细胞活力增加(图3C);在H3122细胞中,使用劳拉替尼或阿来替尼治疗时,细胞活力增加(图3D)。在H358和H3122细胞中,单独的MET WT也导致细胞活力略有增加,这表明当MET WT过表达时,可能会导致耐药(图3B和3D)。信号分析表明,在亲本或对照细胞中,每种靶向治疗都能有效抑制原发性致致癌驱动基因和下游ERK1/2信号的激活(图3E - H)。然而,转染了MET H1094Y或D1228N的细胞即使在高药物浓度下仍显示出持续的ERK1/2激活。与PC9亲本细胞和PC9 MET WT细胞相比,在奥希替尼治疗下,PC9 MET H1094Y和D1228N细胞的增殖也有所增加(图3I)。在索托拉西布治疗下,H358 MET H1094Y细胞也观察到类似结果(图3J),在恩曲替尼治疗下,HCC78 MET D1228N细胞同样如此(图3K)。
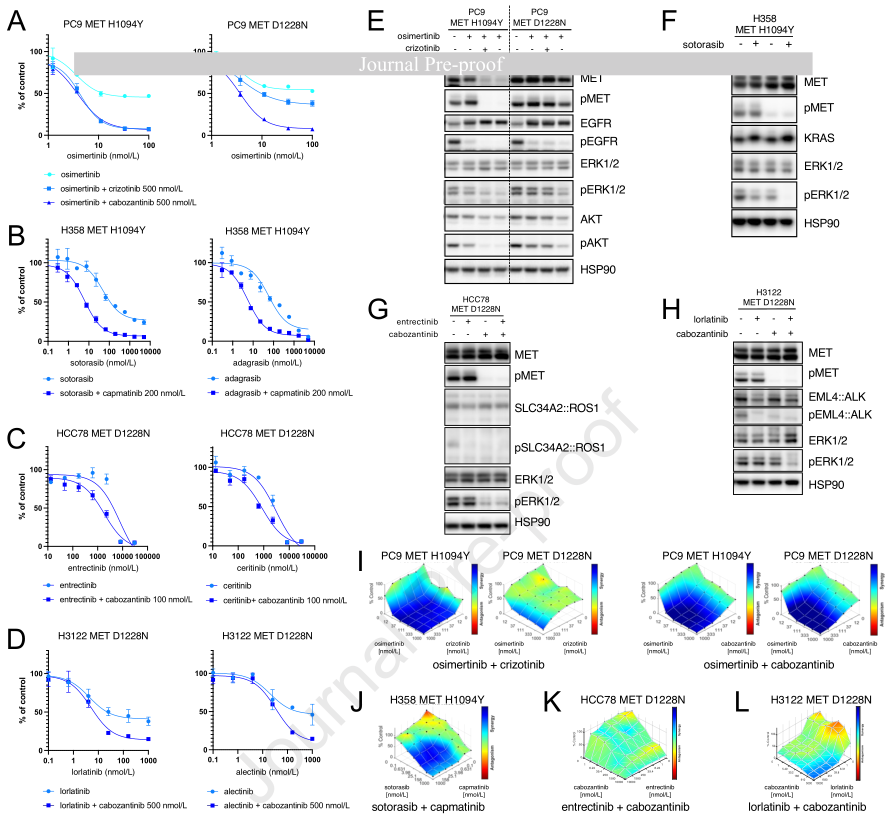
4、联合MET TKI与靶向治疗克服MET TKD介导的耐药性
接下来,研究探讨了联合靶向治疗与有效的MET TKI是否能够克服由MET TKD诱导的耐药性。对于克唑替尼敏感的MET H1094Y突变体,联合使用I型MET TKI;对于克唑替尼耐药的MET D1228N突变体,联合使用II型MET TKI。在PC9细胞中,I型MET TKI联合用药使PC9 MET H1094Y细胞对奥希替尼重新敏感,II型MET TKI联合用药使PC9 MET D1228N细胞对奥希替尼重新敏感(图4A)。研究还观察到,I型MET TKI联合用药不能使PC9 MET D1228N细胞重新敏感,但II型MET TKI联合用药可以使PC9 MET H1094Y和D1228N细胞均重新敏感。临床前模型也证实了根据获得的MET TKD突变选择有效MET TKI以及在I型和II型MET TKI之间切换的重要性。先前关于MET TKD突变对特定类型MET TKI敏感性差异的数据,大多来自对METex14变异的NSCLC中针对MET TKI的靶向耐药机制的研究。临床前模型结果再次证实了这些先前的研究,即MET TKD突变对I型或II型MET TKI的敏感性因突变而异,例如D1228突变对I型MET TKI耐药,但对II型MET TKI仍保持敏感性。研究结果最终可为在非MET致致癌驱动基因驱动的NSCLC中,检测到MET TKD突变作为脱靶耐药机制的临床病例的治疗选择提供指导。同样,I型MET TKI联合用药使H358 MET H1094Y细胞对索托拉西布重新敏感(图4B)。对于HCC78 MET D1228N和H3122 MET D1228N细胞,联合II型MET TKI使细胞对ROS1抑制剂(图4C)和ALK抑制剂(图4D)重新敏感。信号分析表明,联合治疗在PC9、H358、HCC78和H3122细胞中有效地抑制了下游ERK1/2的激活(图4E - F)。在HCC78细胞中,不仅联合治疗,II型MET TKI单药治疗也观察到对下游ERK1/2的抑制,这可能是由于II型MET TKI对ROS1和MET的双重抑制作用(图4G)。最后,在PC9 MET H1094Y和D1228N细胞(图4I)以及H358 MET H1094Y细胞(图4J)中观察到联合治疗有很强的协同效应。在HCC78 MET D1228N细胞(图4K)和H3122 MET D1228N细胞(图4L)中,协同效应则较为微弱。
结论
本研究首次系统揭示MET TKD突变作为跨致癌驱动基因耐药机制的临床意义:它不仅常与KRAS、EGFR等驱动基因突变共存,更可通过获得性演变介导靶向治疗耐药。体外实验证实,根据突变类型选择相应MET抑制剂(I型或II型),为临床破解耐药提供了切实可行的策略。
研究的局限性在于:1)部分数据存在样本选择偏倚,不同机构的测序标准差异可能影响突变检出率;2)缺乏PDX模型等体内实验验证;3)临床治疗随访数据有限,联合方案的实际疗效需进一步验证。未来需要开展前瞻性研究,建立MET TKD突变的标准化检测流程,并探索其在液体活检中的应用价值,最终推动个体化联合治疗方案的临床转化。
这项突破性研究为肺癌耐药机制增添了重要拼图,也为"双靶点打击"策略提供了理论依据。随着更多MET抑制剂的临床应用,我们有理由相信,精准识别耐药机制并制定针对性方案,将助力更多患者跨越耐药鸿沟,延长生存获益。
Nakazawa S, Pecci F, Ricciuti B, et al. Activating mutations in the MET kinase domain co-occur with other driver oncogenes and mediate resistance to targeted therapy in NSCLC. J Thorac Oncol. Published online April 2, 2025. doi:10.1016/j.jtho.2025.03.045。
审批编号:CN-159471 有效期:2025-08-07
声明:本材料由阿斯利康提供,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


