【导言】
既往这个话题属于零散的Case report为主,由于目前靶向治疗的生存期越来越长,这个话题也像“房间里的大象”,是一个我们不得不重视的一个问题。既往细胞毒性药物和怀孕的指导方针已经很完善。然而,之前尚未整理关于怀孕或取卵期间的肺癌靶向治疗的可获得数据,也没有广泛讨论特定致癌基因成瘾的晚期NSCLC环境中的生育问题。今年《 JTO 》中发布了一篇: 对体外胎盘灌注研究、药理学特征、致突变性、动物胚胎-胎儿发育研究以及接受EGFR、ALK或ROS1靶向治疗期间的母性、怀孕和取卵途径的病例报告进行了叙述性回顾

致癌基因驱动的NSCLC通常在年轻患者中富集,因此对具有生育能力的女性的影响尤为严重。在一项病例系列中(围产期定义为怀孕期间或怀孕后1年内),52名18至44岁患有致癌基因驱动的NSCLC的女性中,有9名(17%)在围产期诊断出肺癌。EGFR和ALK是年轻女性中最常发生改变的可操作致癌基因,其次是ROS1和KRASG12C,BRAF、MET、NRTK和RET改变罕见。在靶向治疗和免疫治疗出现之前,妊娠期诊断出的晚期肺癌预后很糟糕,可能比非妊娠患者更差,大多数母亲在分娩后一年内死亡。部分患有EGFR、ALK或ROS1变异肺癌的女性,其潜在生存期已达5至10年,尽管确诊,但其中一些女性仍在寻求生育。
指南通常建议在妊娠前三个月的器官形成期间避免使用细胞毒性化疗。在妊娠中期和晚期,许多细胞毒性化疗被认为是安全的。自从第一种针对肺癌的致癌基因靶向疗法问世以来,尚未制定针对妊娠期肺癌使用靶向疗法的官方指南。国际癌症、不孕和妊娠网络(INCIP)建议,适合接受癌症靶向治疗的女性的妊娠应由多学科团队管理,最好在国家癌症妊娠咨询委员会的协助下进行,尽管目前很少有国家有这样的咨询委员会。
由于癌症中激活的一些致癌通路可能参与胚胎发生或生育和妊娠的其他方面,因此使用针对此类通路的靶向药物可能会对生育和胎儿发育产生不利影响。 EGFR信号传导早已被证实参与胎盘发育。 ALK通路参与动物模型中的神经和胃肠道系统发育。小鼠中ROS1的消融会损害附睾的分化,导致男性不育。 NTRK1的先天性失活突变与一种发育障碍有因果关系,这种发育障碍的特征是不同程度的智力障碍、对疼痛不敏感和无汗症。
本报告回顾了ALK、EGFR或ROS1靶向治疗对NSCLC患者在生殖、妊娠和卵子提取方面的证据和问题。所回顾的证据包括体外胎盘灌注研究、药理学特征、动物胚胎-胎儿发育研究以及接受靶向治疗期间妊娠和卵子提取的病例报告。
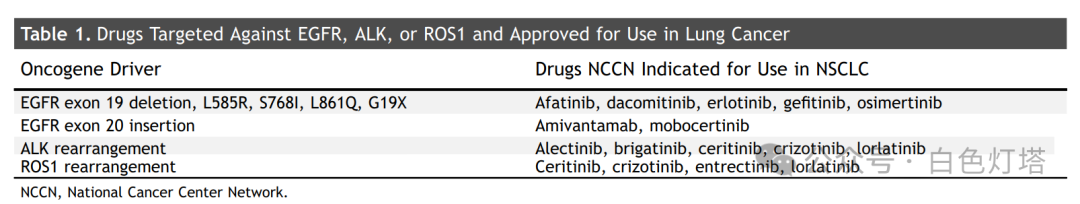
信息来源:美国食品和药物管理局(FDA)的药品标签、全文发表的胎盘研究以及人类怀孕期间进行致癌基因靶向肺癌治疗的全文发表病例报告。我们纳入了表1中列出的经美国FDA批准且具有截至2022年12月国家癌症中心网络治疗指南中说明书内或说明书外适应症的药物。
👉 生育能力
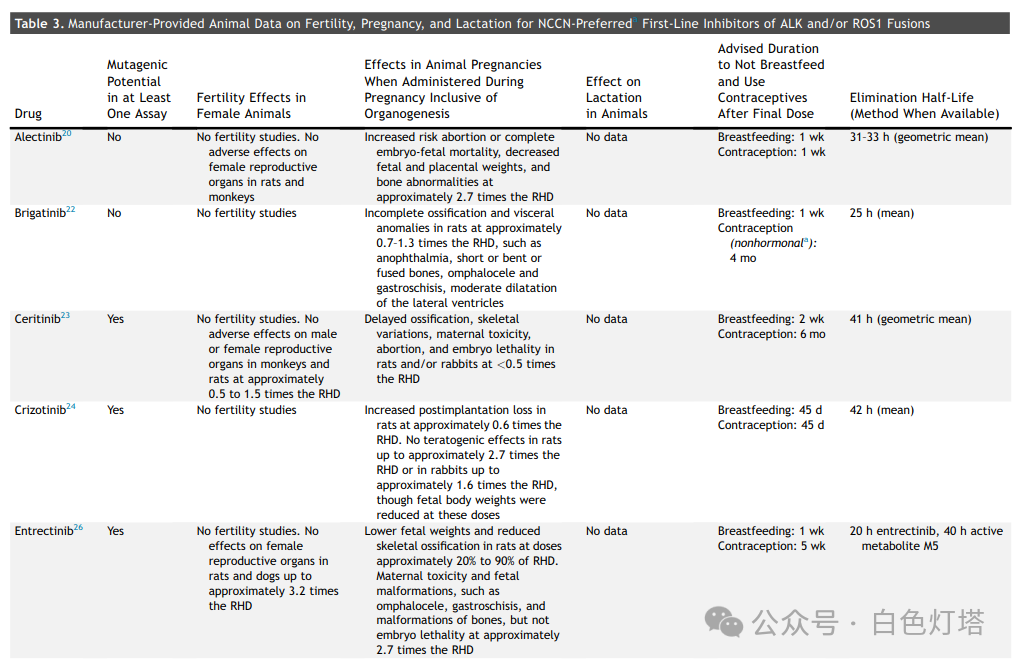
动物雄性和雌性生育力研究并不常见,13个药物标签中有4个报告了该研究,这些药物均为EGFR抑制剂(阿法替尼、厄洛替尼、吉非替尼和奥希替尼)。 给大鼠服用阿法替尼、吉非替尼或奥希替尼会导致黄体减少,而厄洛替尼“不会损害雄性或雌性大鼠的生育力” 。
👉 药理学和胎盘灌注研究
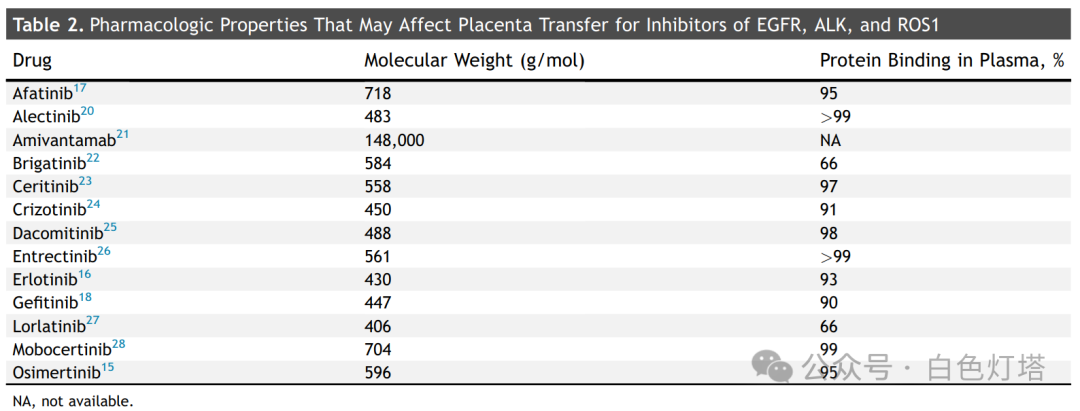
与母体血浆相比,许多药物特性都会影响胎儿血浆中的药物浓度水平,包括分子量、蛋白质结合、离子电荷和脂溶性。然而,预测药理特性的相互作用具有挑战性。 用于治疗肺癌的TKI往往分子量较小,这有利于胎盘渗透,但同时也高度与蛋白质结合,这往往会降低胎盘渗透性(表2) 。离体胎盘灌注研究表明,吉非替尼、厄洛替尼和克唑替尼的胎儿药物浓度分别约为母体血清药物浓度的20%、30%和40%。这与来自5名服用TKI的女性的人胎盘的数据一致,该数据显示,与出生时母体血液浓度相比,脐带血药物浓度为吉非替尼的20%,厄洛替尼的25%;该研究还发现,脐带血至母体血药浓度为奥希替尼的35%,阿来替尼的7%至8%。人类体外胎盘灌注和克唑替尼动物模型研究均显示,药物在胎盘中沉积水平高,并提示滋养层细胞活力降低。这被认为是克唑替尼导致植入后丢失增加的一个因素。EGFR抑制剂吉非替尼和厄洛替尼不会在胎盘组织中大量积聚,抑制滋养层样细胞活力的效力可能低10倍,但在动物研究中仍与植入后丢失增加有关。
👉 致突变性和胚胎-胎儿发育研究
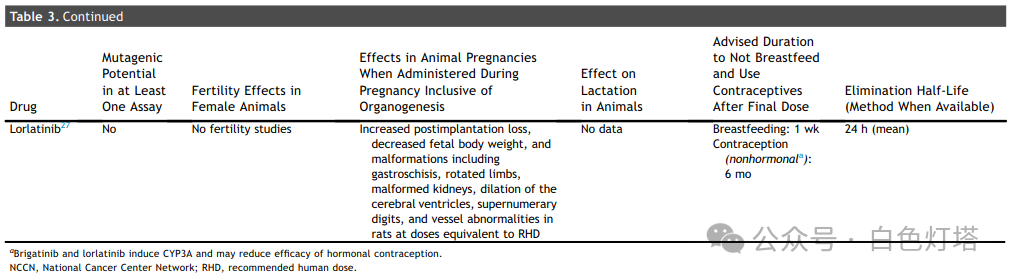
在已确定的13种FDA药品标签中,11种提供了体外或体内致突变性研究, 其中3种药物具有致突变潜力(塞瑞替尼、克唑替尼和恩曲替尼)(表3和表4) 。除一种药物(amivantamab)外,所有药物均描述了动物胚胎-胎儿发育研究。在12种进行动物胚胎-胎儿发育研究的药物中,有10种药物报告了植入后或早期胚胎丢失,剂量为推荐人体剂量(RHD)的0.2至2.7倍。总共12种药物中有8种报告了胎儿体重减轻(表3和表4)。 有5种药物(阿法替尼、阿来替尼、布格替尼、塞瑞替尼、恩曲替尼)报告了EGFR、ALK、ROS1和NTRK靶点的异常骨化。 有报道称,布格替尼和洛拉替尼在接近或低于RHD的剂量下会导致先天性异常。 没有关于器官形成完成后专门进行靶向治疗的数据报告 。
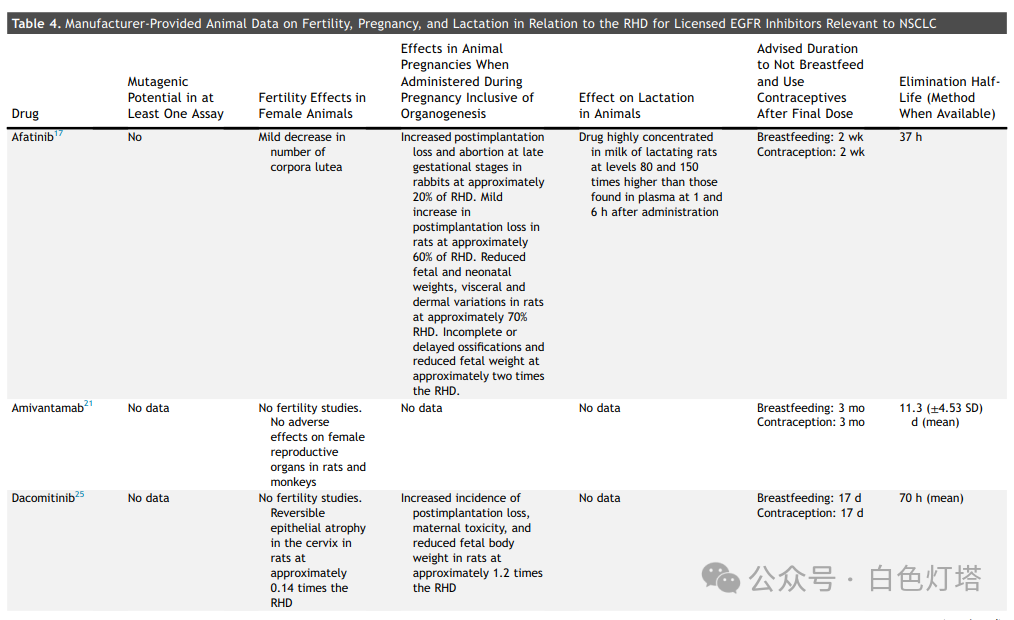
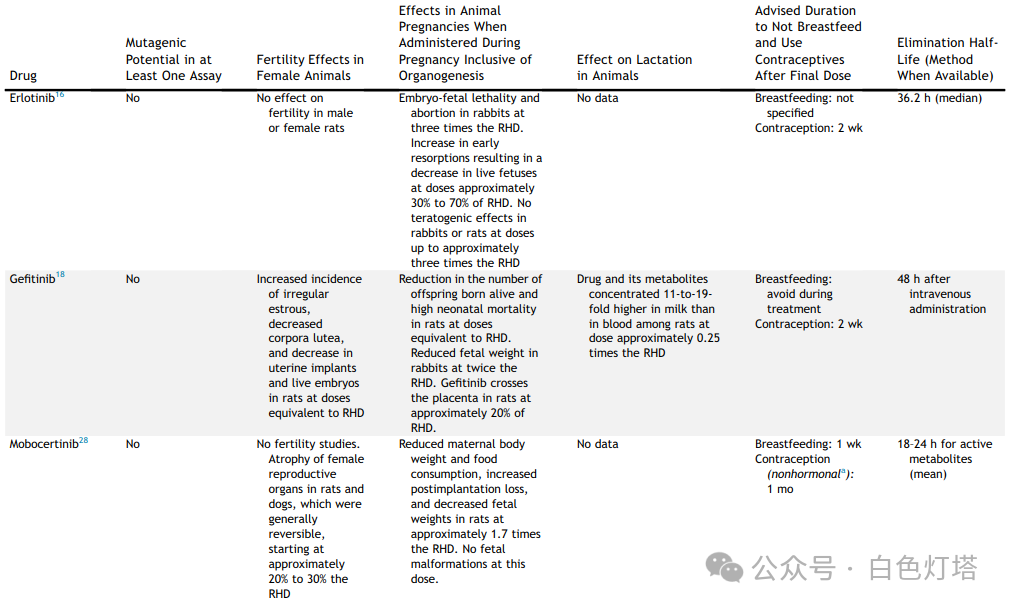
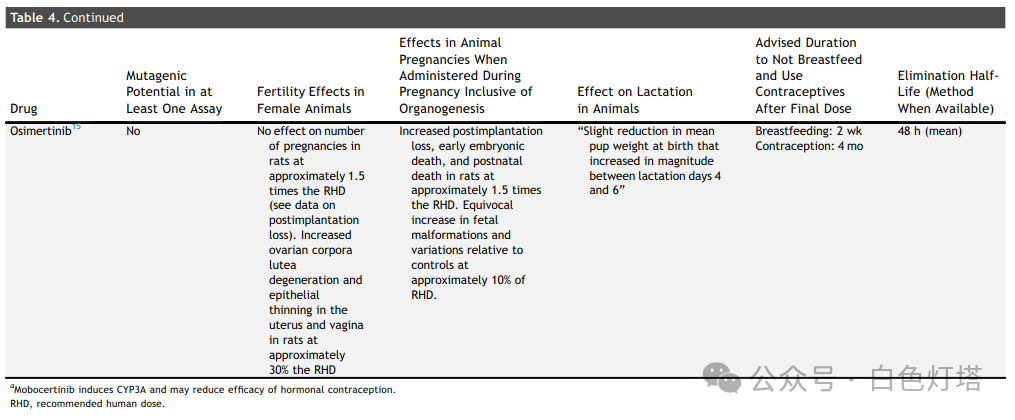
👉 避孕和母乳喂养
这13种药品标签中均未明确建议妊娠期间使用,而是建议讨论妊娠对胎儿的潜在风险。然而, 制造商普遍建议在治疗期间和治疗后一段时间内使用避孕药 。制造商 建议在服用布格替尼、洛拉替尼和莫博替尼时采取非激素避孕措施。这三种药物是CYP3A诱导剂;雌激素和孕酮是CYP3A底物,CYP3A诱导剂可能会降低其水平 。厄洛替尼是一种弱CYP3A诱导剂,制造商未指定避孕方法。制造商没有将其余9种药物描述为CYP3A诱导剂。
对于表1中列出的13种已获批用于治疗NSCLC的靶向药物,制造商建议不要进行母乳喂养。 这13种药物中有两种提供了动物哺乳期间的药物水平数据; 对于阿法替尼和吉非替尼,与血清药物水平相比,其在哺乳大鼠乳汁中的浓度明显升高 。这13种药物中有 8种药物从最后一次服药到开始母乳喂养的建议洗脱期通常为1至2周(表3和表4) 。母乳喂养前的建议洗脱期无法完全用消除半衰期来解释。例如,克唑替尼和奥希替尼的消除半衰期分别为42小时和48小时,但克唑替尼的建议母乳喂养洗脱期为45天,奥希替尼的建议母乳喂养洗脱期为2周。建议继续使用避孕药的时间从最后一次服药后1周到6个月不等。一些ALK抑制剂(如布格替尼和洛拉替尼)的激素避孕效果降低,导致避孕建议出现部分变化。
👉 产妇结局
晚期NSCLC妊娠患者靶向治疗的疗效仅限于病例报告数据。妊娠期的生理变化可能会影响治疗效果。例如, 妊娠期间母体血浆量增加约40%,肾清除率增加30%至50%,白蛋白浓度降低20%至30% 。 与治疗窗口较窄的药物相比,妊娠期的代谢和生理影响对治疗窗口较宽的药物疗效的影响较小。 由于癌症药物开发的性质侧重于最大耐受剂量,因此TKI的治疗窗口被低估了。例如,有传闻称,在我们的诊所,由于毒性,许多ALK重排肺癌患者使用ALK抑制剂(剂量为推荐剂量的50%至75%)已达到或继续达到良好的疾病控制效果。
在最近发表的一篇关于11例接受肺癌靶向治疗的妊娠的评论中,2名女性在整个妊娠期间均接受了厄洛替尼或阿来替尼治疗,并且两人均对治疗产生了临床和/或放射学反应。 在7名于妊娠中期或晚期(孕龄从23至33周不等)开始接受靶向治疗的女性中,5名在接受阿来替尼、塞瑞替尼、厄洛替尼、吉非替尼或奥希替尼治疗后产生了癌症反应。对于这些女性,没有特别评论与妊娠有关的药物不良反应。在7名于妊娠中期开始接受靶向治疗的女性中,有2名对治疗没有反应或反应很小,她们均接受了克唑替尼治疗。1名患有ALK重排肺癌的女性在孕龄26周时开始使用克唑替尼,没有产生不良反应;然而,她没有临床或放射学反应,病情迅速恶化,导致孕30周时剖宫产,产后30天产妇死亡。1名患有ALK重排肺癌的妇女在孕23周时开始使用克唑替尼,用克唑替尼治疗3周后癌症稳定,但出现溶血、肝酶升高和血小板减少综合征,导致孕26周时剖宫产,产后3天产妇死亡。2份关于接受克唑替尼治疗的孕妇的报告都没有描述分子检测方法,也没有评论可能的耐药机制。
👉 胎儿结局
在接受肺癌靶向治疗的12个胎儿中(之前描述的11个妊娠中有一个是双胞胎妊娠),所有胎儿均与EGFR或ALK抑制剂有关。只有3个胎儿在妊娠前三个月接受过治疗。在1个胎儿中,厄洛替尼在大部分器官形成后于妊娠11周(发现怀孕时)停止使用,1周龄时未报告胎儿或婴儿异常。1个胎儿在整个妊娠期间都接受厄洛替尼治疗,并出现羊水过少和宫内生长受限(IUGR),导致妊娠33周时早产;该婴儿在24个月大时未报告任何异常。第3个胎儿在整个妊娠期间都接受过阿来替尼治疗;婴儿在3个月大时出现小的宫颈侧瘘,但在20个月大时没有其他发育异常。
9个胎儿在器官形成后接受了靶向治疗。5个胎儿在妊娠前三个月后接受了EGFR抑制剂治疗。双胞胎胎儿在孕龄14至37周(共130天)接受厄洛替尼治疗,其中一个双胞胎出现IUGR,导致在孕龄37周时剖宫产;2个双胞胎在12个月大时随访时均被描述为“茁壮成长”。1个婴儿在孕龄28至35周接受吉非替尼治疗55天,胎儿检查结果正常,24个月大时发育正常。另1个婴儿在孕龄28至36周接受厄洛替尼和吉非替尼治疗,胎儿小于胎龄(部分原因可能是母亲体重“急剧”下降),但未受到羊水过少的影响;婴儿体重在6周大时恢复到第十百分位,没有发现其他异常。1名婴儿同时暴露于奥希替尼和曲妥珠单抗21天,出现羊水过少和短暂性肾衰竭,这是曲妥珠单抗的已知影响;该婴儿在8个月大时随访时没有发现发育异常。
4例妊娠在器官形成后暴露于ALK抑制剂。1名暴露于塞瑞替尼五周的婴儿患有六指畸形。2名暴露于克唑替尼3周的婴儿在18个月和29个月时的最后一次随访中发育正常。1名暴露于阿来替尼3周的婴儿在11个月大时发育正常。
总之,在器官形成前和/或后暴露于ALK或EGFR抑制剂的所有12名婴儿均未报告持续的重大异常,随访时间限制在1周至29个月大。
【 Discussion 】
本报告旨在汇总有关肺癌靶向治疗的现有信息,为患有晚期肺癌且已怀孕或希望怀孕的女性提供护理,重点关注目前与晚期疾病中最长的治疗相关生存期相关的可操作致癌基因。 根据动物模型,EGFR抑制剂可能通过异常卵子发育降低生育能力。对接受靶向治疗的男性精子发生的研究仍大部分未得到探索。 服用EGFR和ALK抑制剂的女性怀孕的几率也可能降低 ,因为植入后损失可能会增加,但尚未获得人体数据。有记录显示克唑替尼和恩曲替尼具有致突变潜力,据报道,在母亲使用克唑替尼缺乏疗效或药物毒性的情况下,有两例产妇死亡。已经注意到对妊娠的许多影响,例如宫内生长受限导致一些在宫内接触EGFR和ALK抑制剂的婴儿早产。尽管如此,在记录的12名在宫内暴露于EGFR和ALK抑制剂后出生的婴儿中,截至上次报告的随访,所有婴儿似乎均未出现相关的不良健康影响。妊娠代已经取得成功,但是否需要停药以及停药后多久才能取卵仍未得到充分研究。例如,接受奥希替尼等EGFR抑制剂治疗的动物的黄体减少提示,继续使用奥希替尼而不间断治疗可能会对取卵率产生不利影响。
随着生存率的不断提高,在被诊断为致癌基因驱动的肺癌后寻求生育的患者数量可能会增加。事实上,在本报告所含文献的截止日期之后,又发表了一例服用ALK抑制剂的女性怀孕的病例。需要对接受靶向治疗的男性和女性生育能力进行研究。收养是成为母亲的另一种途径。我们诊所接受治疗的两名患者在诊断后成功收养了孩子。然而,我们的一名患者报告说,尽管她的伴侣健康,但她因被诊断为转移性癌症而被收养机构拒绝。在多个新兴肺癌患者权益组织的意见下,收养政策可以说已经成熟,需要进行更新的讨论。
在接受靶向治疗期间,应与有生育能力的患者讨论避孕预防措施、对妊娠风险的认识以及考虑进行妊娠测试。使用洛拉替尼、布格替尼和莫博赛替尼时应使用非激素避孕药。 在诊断时发现的或治疗期间意外终止妊娠的决定在很大程度上受到有关药物对胎儿健康影响的现有数据以及对母亲个人癌症预后的担忧的影响。 在三项病例系列中,八名在胎儿存活前被诊断为致癌基因驱动肺癌的孕妇中有七名接受了人工终止妊娠。未接受终止妊娠的患者仅在妊娠期间接受了细胞毒性化疗,并在分娩后转为靶向治疗;在诊断后3年的最后一次报告随访中,她仍然活着。
需要对靶向治疗对妊娠和取卵的影响和最佳时机进行额外的临床前探索。由于药理学和脱靶效应的差异,一种药物作用于一个靶点的数据可能无法自动转移到另一种作用于同一靶点的药物。还需要对这种疗法对男性和女性生育能力进行临床分析。由于部分患者也能从免疫疗法中长期受益,因此还需要对其他类别的疗法进行可比研究。











 苏公网安备32059002004080号
苏公网安备32059002004080号


