
胰腺神经内分泌瘤(pNET)是一类较为罕见且异质性较高的恶性肿瘤,很多患者确诊时已经伴有肝转移,发生肝转移的患者预后更差。对于肝转移的pNET患者的治疗,强调外科治疗、介入治疗和系统治疗等多手段、多学科的综合治疗。在系统治疗的基础上,在恰当的时间联合局部治疗可以帮助患者得到更好的预后。本期【望岳谈】由青岛大学附属医院胡维昱教授分享一例胰腺神经内分泌瘤肝转移综合治疗病例,并邀请青岛大学附属医院韩冰教授进行点评。
医学博士、主任医师,硕士生导师
青岛大学附属医院肝胆胰外科西海岸病区主任
中国抗癌协会胰腺肿瘤整合康复专业委员会常委
中国老年保健协会肝癌委员会委员
中国医促会肝脏肿瘤分会青委会委员
中国医促会胰腺疾病分会青委会委员
欧美同学会青委会常委
山东省医学会普外科分会委员
山东省抗癌协会肝胆肿瘤青委会副主任委员
基本信息
患者女,46岁。
诊疗经过
2022-05-09 因“腹泻伴间歇性腹痛20余天”于消化内科就诊,给予止泻对症治疗。
2022-06-30 因此前治疗效果不佳,就诊于我科。
血常规:90g/L,甲功:抗甲状腺球蛋白(TG-Ab):341IU/ml,粪便常规:潜血阴性。
上腹部增强CT示:考虑胰腺尾部肿瘤性病变并肝内多发转移可能,不除外侵犯脾动静脉致脾梗死可能,肝左外叶血管瘤。

图1. 2022-06-30 上腹部动态增强CT
癌胚抗原(CEA):13.34 ng/ml ,其余肿瘤标记物正常。
2022-07-05 患者入住我科,行消化系统超声+肝肿瘤穿刺活检。
超声提示:胰腺尾部低回声肿块,考虑Ca可能性大;肝脏多发肿块,考虑“M”性可能性大;脾脏内仅见少许血流信号,考虑脾梗死可能性大。
(肝肿物穿刺)恶性肿瘤,结合免疫组化结果,符合神经内分泌肿瘤(G2)。
免疫组化结果:CKpan(+),CD99(-),CgA(+),Syn(+),SSTR2(3+),β-Catenin(膜+),CD56(+),Ki-67(+,热点区5%),Hepatocyte(-),p53(个别弱+),INSM1(+),CDX-2(散在膜+),PR(++,70%)。
其他辅助检查项目:血常规:83g/L,红细胞压积:28.5。
粪便常规及菌群分析:潜血阴性。
癌胚抗原(CEA):11.54 ng/ml ,余肿瘤标记物正常。
肝功:r-GGT 66.5 U/L ,其余指标正常。
皮质醇+胰岛素测定+胰高血糖素++胃泌素:正常。
人嗜铬粒蛋白:>800ng/ml ,5-羟色胺:983 (查体未见明显脸部潮红,血压120/90mmHg),神经元特异性烯醇化酶(NSE):正常。
2020-11-07 行乙肝表面抗原检查(-)。
临床诊断:胰腺神经内分泌肿瘤(功能型,G2,IV期);肝继发恶性肿瘤(弥漫型);腹泻;贫血。
治疗经过:
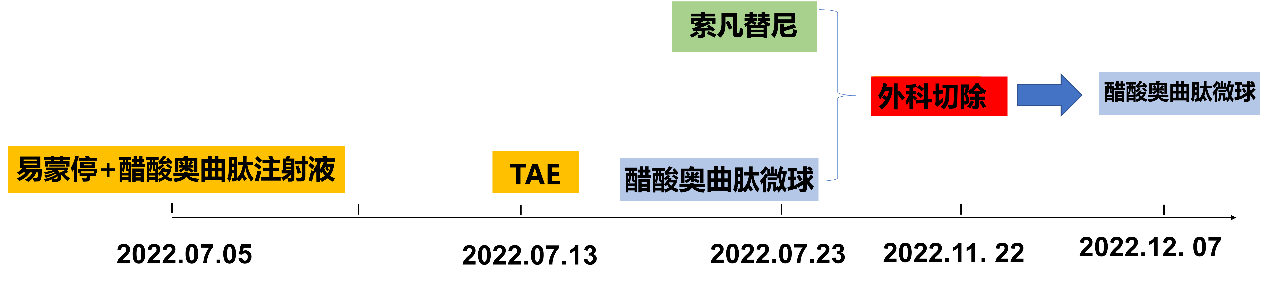
经肝胆胰外科、肿瘤科、消化内科、病理科、影像科、介入科、内分泌科、中医科等相关科室组成的神经内分泌瘤MDT团队讨论,制定治疗目标为控制症状、局部肝脏治疗与抗肿瘤治疗。
2022-07-05 行盐酸洛哌丁胺胶囊+醋酸奥曲肽注射液控制症状。
2022-07-13行肝动脉栓塞术(TAE)
术中见:全肝大片肿瘤染色,超选各支肿瘤供血动脉。
术中用药:栓塞微球(Embosphere)+碘化油5ml。
2022-07-23起口服索凡替尼(300mg qd),醋酸奥曲肽微球(30mg im q28d)。
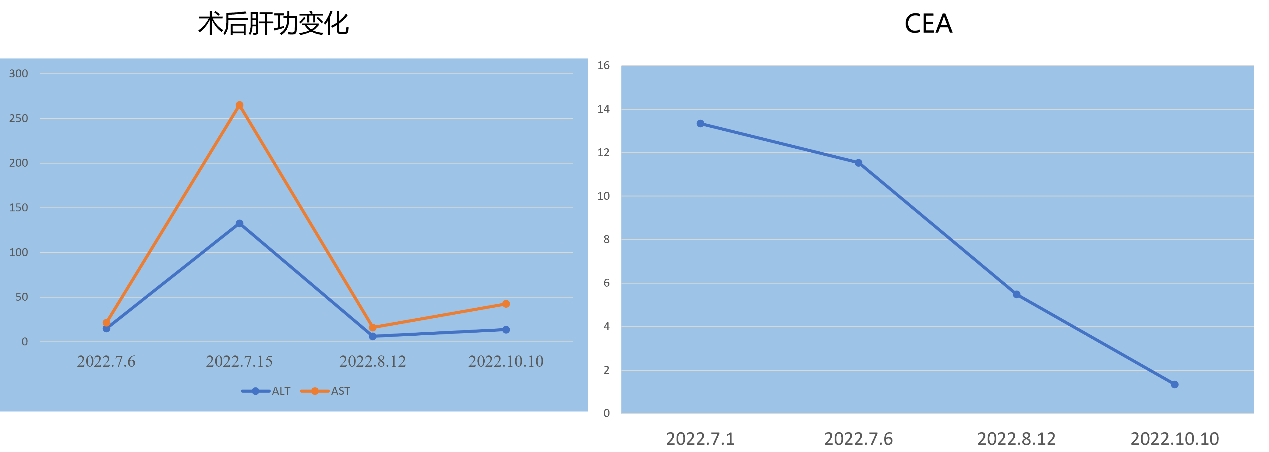
图2. 患者术后肝功能及CEA变化曲线

图3. TAE术后1月(左)3月(右)复查

图4. 肝脏转移瘤直径对比
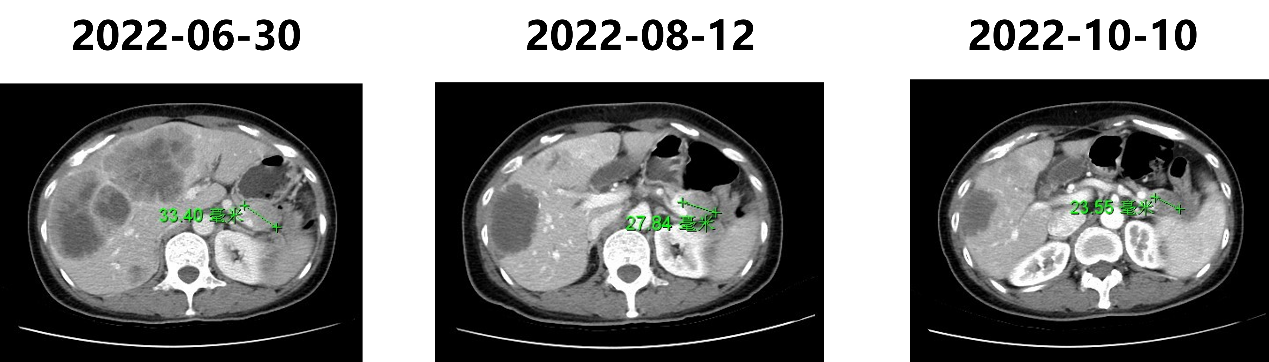
图5. 胰腺主瘤直径对比
2022-10-31 患者因“恶心伴上腹痛4天”再次入院,血常规88g/L,血小板101×109/L,白蛋白22.8g/L,血钾5.84mmol/L,肝功正常,高敏肌鈣蛋白0.048ng/ml,BNP772.7pg/ml,CA125 36.78。
2022-11-04 复查肝脏特异性增强MR,提示胰腺肿瘤,不除外侵犯脾动、静脉致脾梗死可能,较前次CT变化不大。

图6. 2022-11-04 肝脏特异性增强MR
2022-11-07 复查FDS-SSA双PET-CT,胰腺尾部软组织灶,侵犯脾门区血管及胃体后壁,示踪剂明显摄取增高,SUVmax约21.1;肝转移瘤介入治疗术后,肝内多发大小不等低密度灶,部分边缘见高密度碘油沉积,示踪剂不均匀明显摄取增高,SUVmax约18.8;肝右叶囊性低密度结节,边缘见示踪剂摄取增高,SUVmax约8.8;以上考虑胰腺神经内分泌肿瘤并肝多发转移,病灶呈生长抑素受体高表达。

图7. 2022-11-07 18F-FDG-PET-CT与68Ga-SSA-PET-CT
经再次MDT讨论,考虑患者出现胃肠道反应及心肌损伤,不除外肿瘤坏死导致类癌综合征可能,因此停用奥曲肽微球及索凡替尼,优先改善心脏功能及全身营养状态;考虑患者在局部及全身系统治疗没有继续获益,并出现严重不良反应,可在改善全身状态下评估外科手术指征,通过G1/G2级pNET切除原发灶及转移灶有助于改善患者全身症状。
术前评估:血常规:108g/L,血小板:232×109/L;白蛋白:39g/L,电解质、肝功正常;高敏肌钙蛋白:0.029ng/ml ,BNP:正常;ECOG评分:2级。
手术治疗:2022-11-22 行肝部分切除(IV、V、VI、VII、VIII段)+胰体尾部切除+左侧肾上腺切除+胃部分切除+脾切除+区域淋巴结清扫+胆囊切除术。患者术后恢复顺利,术后14天出院。
1. (胰体尾)神经内分泌肿瘤,符合神经内分泌瘤(G2,范围4.5*3.5cm),神经侵犯(+),可见广泛神经侵犯,局灶见厚壁血管侵犯。侵及胃壁组织至黏膜下层,未累及肾上腺及脾脏,未累及胰体尾断端
2. 胆囊结石伴慢性胆囊炎,未见肿瘤累及。
免疫结果:CKpan(+),Syn(+),CgA(+),CD56(部分+),SSTR2(3+),INSM1(+),ATRX(+),p53(+,约5%),Rb(+),CD31、D2-40示脉管癌栓(+),Ki-67(+,约5%),CK7(-),PD-L1-22C3(CPS:<1); 错配修复蛋白 MLH1(+),PMS2(+),MSH2(+),MSH6(+)。
3.(肝转移瘤1.2、3.4、5、6)肝组织内见肿瘤转移。
4. 送检13(1/1)淋巴结内见肿瘤转移,7+8+12(0/11)淋巴结内未见肿瘤转移。
患者出院后2周复查,血常规123g/L,肝功r-GGT8 2.5U/L,肿瘤标记物正常。
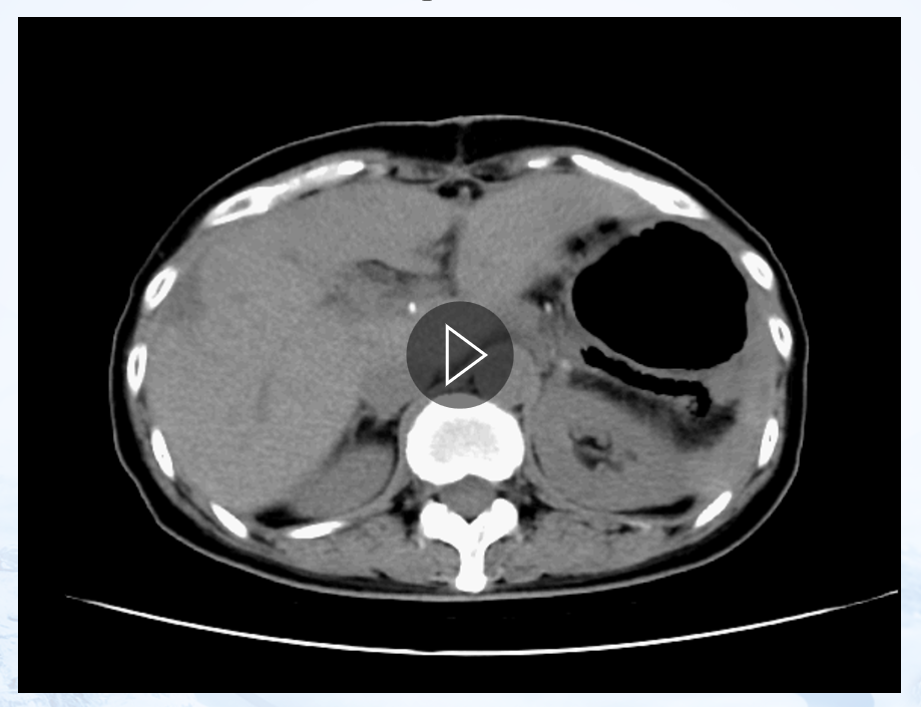
图8. 出院后两周复查CT
术后辅助治疗:术后1周起使用醋酸奥曲肽微球(30mg im q28d)至今。
术后3个月复查:患者目前一般情况好,无明显不适症状;CoA、5-羟色胺、胃泌素、胰高血糖素正常;复查上腹部动态增强CT:胰腺、肝脏、胃术后改变,腹腔少量积液较2022-12-19较少,肝左外叶海绵状血管瘤;肿瘤标记物正常。
术后8个月复查:患者目前一般情况好,无明显不适症状;CoA、5-羟色胺、胃泌素、胰高血糖素正常;复查上腹部动态增强CT:胰腺、肝脏、胃术后改变,肝左外叶海绵状血管瘤;肿瘤标记物正常。
2024-01-12 术后14个月复查:患者目前一般情况好,无明显不适症状;CoA、5-羟色胺、胃泌素、胰高血糖素正常;复查上腹部动态增强CT:胰腺、肝脏、胃术后改变,肝左外叶海绵状血管瘤;肿瘤标记物正常。

图9 .术后3个月(左)、8个月(中)与14个月(右)复查腹部增强CT
治疗小结
专家点评
青岛大学附属医院,肝胆胰外科副主任兼市南病区主任
主任医师,博士生及博士后导师,斯坦福大学访问学者
中国医师协会外科分会机器人外科工作组 委员
中国医师协会外科分会肝胆青年工作组委员
中国医师协会外科分会胆道外科工作组青年委员
山东省医学会外科分会脾与门脉高压学组 副组长
山东省医学会肝脏肿瘤多学科联合委员会 委员
山东省医师协会肝胆胰腔镜微创医师分会 常委
山东省抗癌协会肝胆胰肿瘤分会 常委
青岛市医疗卫生优秀学科带头人
《中华外科杂志》通讯编委
韩冰教授:胰腺神经内分泌肿瘤(pNET)是一类相对少见的肿瘤,近年来,其发病率逐渐上升,需要引起更多关注。功能性NET可分泌5-羟色胺等血管活性激素而导致患者出现相关症状而就诊,而大多非功能性pNET可能无相关症状,导致发现时已经处于晚期,患者预后较差。
本病例中,患者首发症状为腹泻伴腹痛,属于功能性pNET,但初诊时已出现广泛肝脏转移。肝穿刺活检结果提示pNET-G2,Ki-67约5%,生长抑素受体阳性表达SSTR2(3+),CgA(+)。尽管肝脏转移是pNET的独立预后不良因素,但通过胡教授领衔的MDT团队积极制定的正确、详尽的治疗方案,通过易蒙停+奥曲肽成功控制患者腹泻症状,使用TAE控制肝转移灶,奥曲肽微球联合索凡替尼进行抗肿瘤治疗。经过三个月的治疗成功达到手术治疗指征,进行了胰体尾、肝部分、胆囊、胃部分和脾切除,同时清扫了淋巴结。术后继续使用奥曲肽微球进行辅助治疗,保持密切随访,患者术后14个月依然处于无瘤状态。
尽管当下pNET无一线标准治疗方案,然而该病例通过MDT讨论,基于循证医学证据,制定了个体化、精准化治疗方案,处理得当,取得了良好的治疗效果。当下,精准治疗、系统治疗和个体化治疗的多学科协作综合治疗模式已成为pNET标准治疗模式,需要充分重视pNET的内在生物学行为,这是肿瘤预后、治疗手段选择以及药物治疗反应的根本决定因素。
排版编辑:肿瘤资讯-Zika











 苏公网安备32059002004080号
苏公网安备32059002004080号


