本期精选5篇在2024年9月份发表的结直肠癌领域文献,部分研究邀请到复旦大学附属肿瘤医院陈治宇教授进行深入解读。
专家介绍
复旦大学附属肿瘤医院 消化肿瘤内科
CSCO神经内分泌肿瘤专家委员会委员
CSCO胃肠间质瘤专家委员会委员
中国医药教育协会疑难肿瘤专业委员会副主任委员
上海市抗癌协会神经内分泌肿瘤专委会副主任委员
中国抗癌协会整合肿瘤学分会委员
中国抗癌协会肿瘤精准治疗专委会委员
中国医师协会外科医师分会多学科综合治疗专家组委员
上海市抗癌协会癌症康复与姑息治疗专业委员会委员
上海市抗癌协会大肠癌专委会委员
上海市抗癌协会第九届理事
《肿瘤学年鉴》中文版胃肠肿瘤专刊编委
肝移植联合化疗对比单独化疗用于不可切除结直肠癌肝转移患者(TransMet):一项多中心、开放标签、前瞻性、随机对照试验结果[1]
尽管化疗的疗效不断提高,但永久性不可切除的结直肠癌肝转移仍与较差的长期生存率相关。该研究的目的是评估肝脏移植联合化疗是否能够改善总体生存率。
TransMet是一项在欧洲20个权威医疗机构开展的多中心、开放标签、前瞻性、随机对照试验。研究入组条件为年龄在18~65岁,ECOG评分0~1,无法手术切除的BRAF未突变的结直肠癌肝转移,系统性化疗治疗有效(≥3个月,≤3线),无肝外病灶。采用随机化(1∶1)分组的方法将患者分入肝移植联合化疗组或单独化疗组。肝脏移植加化疗组在最后一次化疗周期后2个月或更短时间内接受了肝脏移植。在随机分组时,肝脏移植加化疗组中位化疗周期为21.0个周期(四分位数范围18.0~29.0个),而单独化疗组为17.0个周期(12.0~24.0个),最多接受三线化疗。在一线化疗期间,94例患者中有64例(68%)接受了双药化疗,30例(32%)接受了三药方案;94例患者中有76例(80%)接受了靶向治疗。移植患者接受了个体化的免疫抑制治疗(在第0天静脉注射甲基泼尼松龙10 mg/kg;在第0天通过胃管给予他克莫司0.1 mg/kg,1~14天维持在6~10 ng/ml;在第0天静脉注射吗替麦考酯10 mg/kg,持续不超过2个月,并切换至依维莫司5~8 ng/ml),以及术后化疗,而化疗组则继续进行化疗。主要终点是5年总生存率,在意向治疗(ITT)和符合方案人群中进行分析。安全事件在按实际治疗人群中评估。该研究已在ClinicalTrials.gov注册(NCT02597348),招募已完成。
在2016年2月18日至2021年7月5日期间,共有94例患者被随机分配并纳入意向治疗人群,其中肝脏移植联合化疗组47例,单独化疗组47例。肝脏移植联合化疗组的11例患者和单独化疗组的9例患者未接受分配的治疗;每组分别有36例和38例患者被纳入符合方案分析。纳入研究患者的中位年龄为54.0岁(四分位数范围47.0~59.0岁),94例患者中有55例(59%)为男性,39例(41%)为女性。中位随访时间为59.3个月(四分位数范围42.4~60.2个月)。在意向治疗人群中,肝脏移植联合化疗的5年总生存率为56.6%(95% CI 43.2%~74.1%),而单独化疗组为12.6%(5.2%~30.1%)[HR 0.37 (95% CI 0.21~0.65); P=0.0003];在符合方案治疗人群中分析两组的5年总生存率分别为73.3%(95% CI 59.6%~90.0%)和9.3%(3.2%~26.8%)(图1)。40例接受肝脏移植的患者中有32例(80%)发生了严重不良事件,而54例接受单独化疗的患者中有45例(83%)被观察到发生了总计69个严重不良事件。肝脏移植联合化疗组中有3例患者进行了二次移植,其中一例患者在术后因多脏器衰竭死亡。
对于筛选的具有永久性不可切除的结直肠癌肝转移的患者,与接受单独化疗相比,接受肝脏移植联合化疗并给予器官分配优先权可显著改善总生存。该研究的结果支持将肝脏移植作为永久性不可切除的肝转移患者的新标准治疗选择。
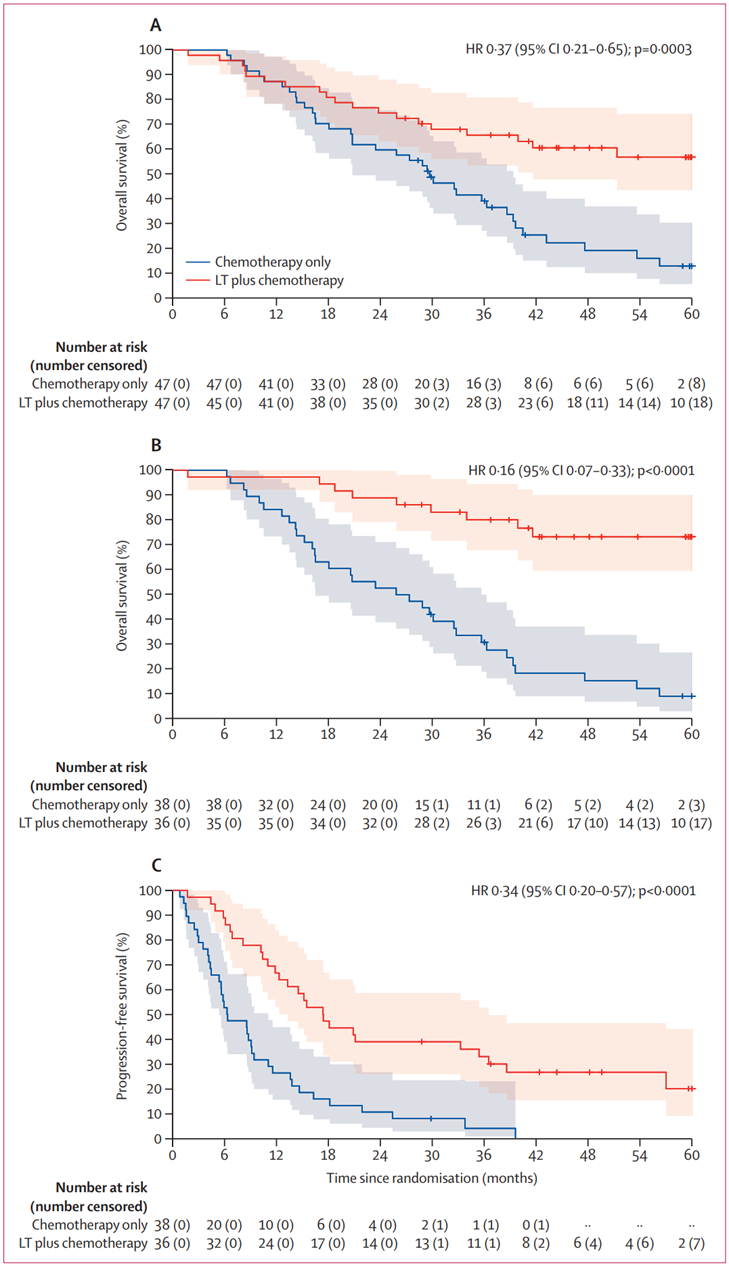
图1. 单独化疗组与化疗联合肝脏移植组的生存分析结果
(A)意向治疗人群中的总生存率;(B)按方案治疗人群的总生存率;(C)按方案治疗人群的无进展生存率
陈治宇教授:肝移植在不可切除结直肠癌肝转移(CRLM)中的治疗地位一直存在质疑,主要是受制于既往研究的回顾性特点以及开展大样本随机对照临床研究的困难。作为第一项在CRLM中评价肝移植的随机对照研究,TransMet研究显示出在ITT人群中肝移植联合化疗组取得了高达56.6%的5年生存率,而在单纯化疗组仅为12.6%,在符合方案人群中,分别为73.3%对比9.3%,生存差异非常显著,肝移植联合化疗组遥遥领先于单纯化疗组。
TransMet研究的成功来自于严格的患者入选标准、优先分配移植供体,同时结合多学科诊治的联合优势,在肝移植联合化疗对比单独化疗中取得了近乎完美的结果。TransMet研究在患者的入组筛选过程中,排除了接受化疗后进展的患者,获得部分缓解(PR)以及疾病稳定(SD)的疗效是入组的先决条件,此外,BRAF基因V600E突变以及三线治疗后的患者也被排除在外。我们在该研究的入组患者特征中,可以看到,最终入组的患者左半及直肠原发的比例高达85%,RAS基因野生型的患者比例超过了60%,随机前接受抗EGFR单抗治疗的患者比例达到60%,因此说明入组的患者大部分是目前认为预后良好的左半野生型患者。在本研究入组评估到随机的过程中,有40%左右的患者不符合随机条件而筛选失败,其中约60%的患者是因为疾病进展所致,因此,也在一定的程度上说明,那些在化疗过程中快速进展的患者实际上是排除在本研究之外的。
其次,在接受肝移植的患者中,通过优先的供体分配保证了患者末次化疗后能及时进行移植手术,因此移植的时效性也非常重要,过长的等待时间,可能会导致肝脏病灶的进展,进而改变疾病的生物学行为,例如本研究中,79%的患者在中断化疗后2个月内进行了移植手术,只有1例患者等待移植的时间超过3个月。
在接受移植的患者中能获得长期生存,还和移植术后再次转移的方式有关。移植后的生存时间长,复发率仍然高达74%,但是复发或转移患者,超过一半是在肺部,通过手术或者消融治疗可以再次获得缓解,因此在移植联合化疗组中有42%的患者,在5年随访时仍然维持无病状态。移植后的复发转移特征超出了我们既往的认知,TransMet研究中肺为移植后失败的主要转移部位,说明在一定的程度上肝移植改变了不可切除CRLM患者的自然病程,移植后的肺转移高发,避免了未进行移植患者肝内病灶进展后侵袭性更强、疾病进展更迅速的局面,从而延长了总的生存时间。
总而言之,TransMet研究确定了不可切除CRLM患者一种新的治疗标准,也就是在经过严格筛选的患者中,肝移植为这部分患者提供了新的治疗选择,也带来了潜在治愈的可能。
可切除结直肠癌中基于ctDNA 检测的分子残留病灶与生存率的关系[2]
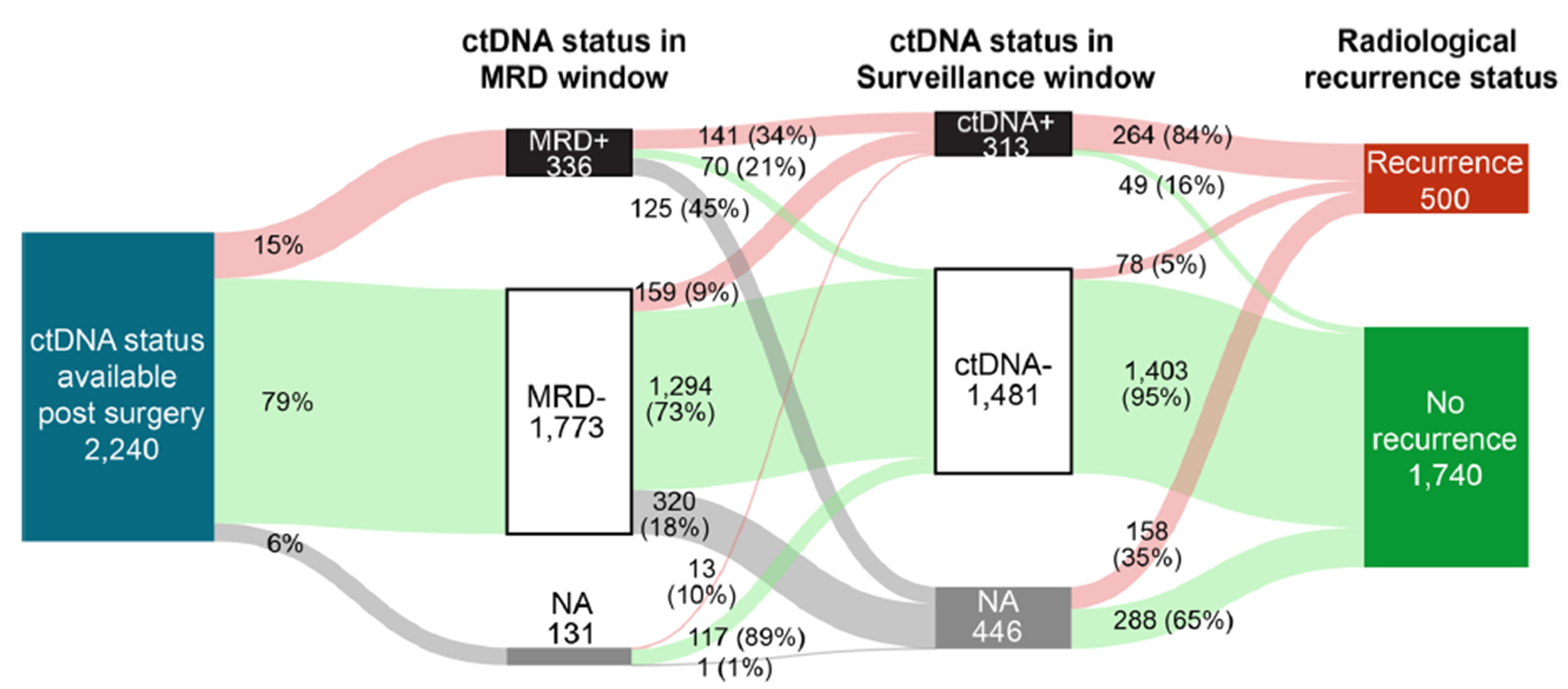
CIRCULATE-Japan GALAXY观察性研究的中期分析显示,基于循环肿瘤DNA(ctDNA)的分子残留病灶(MRD)检测与可切除结直肠癌(CRC)的复发风险及辅助化疗(ACT)获益相关。这项更新分析的中位随访时间为23个月,期间共纳入了2240例Ⅱ~Ⅲ期结直肠癌患者或经过手术治疗的Ⅳ期患者,进一步验证了MRD窗口期内ctDNA阳性的预后价值(图2)。
结果显示MRD窗口期内ctDNA阳性的患者与显著较差的无病生存期(DFS;HR:11.99,P < 0.0001)和总生存期(OS;HR:9.68,P < 0.0001)相关。在经历复发的患者中,ctDNA阳性与较短的OS相关(HR:2.71,P < 0.0001)。此外,MRD阳性患者的DFS显著较短,这一结果与根据不同的生物标志物分组分析得到的对应患者的DFS差异趋势相一致。MRD阳性患者经ACT治疗后出现持续ctDNA清除相比于出现短暂ctDNA清除具有更优的DFS和OS(24个月DFS率:89.0% vs 3.3%;24个月OS率:100.0% vs 82.3%)。MRD阳性患者未经治疗出现自发性ctDNA清除并且后续未出现临床复发的比例为1.9%(2/105)。
总体而言,该研究结果为ctDNA监测应用于在术后复发预测和死亡风险分层评估提供了证据,同时也可以用于指导辅助治疗。
陈治宇教授:ctDNA作为近年来新发现的、在结直肠癌诊治领域中,检测方便的外周血分子标记物,在预测可切除结直肠癌术后复发,指导术后辅助治疗,以及检测转移性结直肠癌(mCRC)患者系统性治疗的疾病缓解及药物耐药方面,体现出重要的预测及预后价值。来自于日本开展的CIRCULATE-Japan GALAXY研究是一项最大规模观察基于ctDNA检测的分子残留病变(MRD)在不同分期的进行根治性手术的结肠癌患者的预后及预测价值的前瞻性研究。始于2020年的这项研究,前期报告了纳入1039例患者的初步结果,显示ctDNA-MRD阳性患者的预后更差,而且MRD阳性患者更获益于术后辅助治疗。
本次报告将研究队列扩大到2240例CRC患者,包括Ⅱ~Ⅲ期可切除结肠癌或Ⅳ期转移性患者,随访时间延长到23个月。研究结果进一步夯实了既往的研究结论:在术后2~10周到辅助治疗开始前的MRD窗口进行检测,MRD阳性的患者其无复发生存和总生存时间更短,HR分别达到了11.99和9.68,而在包括BRAF突变、淋巴结阳性、RAS突变和更晚的T分期等多因素分析中,MRD阳性是具有独立预后价值的唯一因素。
在本研究更新的报告中,还观察到了MRD在不同的基因变异亚型中预测DFS的价值。2240例患者中,50.22%为RAS/BRAF野生、10.27%是高TMB、9.55%为MSI-H,BRAF突变为7.94%,而KRAS G12C突变为2.19%,HER2扩增为1.61%等,几乎在所有不同的分子亚型者,MRD阳性患者的DFS时间更短;而MRD阳性率在不同分子亚型中不等,MSI-H亚型中最低为2.8%,HER2阳性亚型最高为27.8%,KRAS G12C亚型阳性率次之;而BRAF突变MRD阳性率为6.2%,但在BRAF突变患者中,如果术后MRD阳性,其复发的比例和阴性患者相比,差距极大,分别是100%和7.89%。因此,结合不同的分子亚型,如常规利用ctDNA进行MRD检测,其阳性与否,对个体化预测患者的复发和整体预后具有精准指导的意义。
再次,在本研究中还发现MRD阳性患者在接受辅助治疗后ctDNA 转归的三种模式,即术后MRD阳性,辅助治疗后持续MRD阳性;术后MRD阳性,辅助治疗后持续MRD阴性;以及术后MRD阳性,短暂MRD转阴,在这三种转归模式中,持续MRD阳性的患者预后最差,DFS及OS最短,MRD短暂转阴次之,而持续MRD转阴的患者预后最好。术后短暂MRD转阴的患者,在术后1年半时,MRD转阳率达到了96%,说明辅助治疗可能是推迟了肿瘤复发而不是完全治愈了肿瘤的微转移。在术后MRD阳性的105例患者中,未经术后辅助治疗发生“自发性转阴”的比例为6例,这6例中,只有2例患者是持续转阴,因此自发性转阴的比例,其实非常低,只有2%不到。
因此,GALAXY研究进一步的更新,再次验证了ctDNA检测的MRD对于手术切除后的结直肠癌患者,对于预后的判断和疾病的复发或者进展,是一个可靠、灵敏度高且非常一致的分子标记物,尽管MRD的阳性率可能受到检测的技术方法、不同的病理分期、不同的基因亚型以及复发转移后的部位影响,但不可否认的是,基于ctDNA检测的MRD阳性与否,未来将对可切除性结直肠癌的精准、个体化辅助治疗产生深远影响。
纳武利尤单抗联合relatlimab 新辅助治疗局部晚期微卫星不稳定型结肠癌:Ⅱ期临床试验[3]
大约15%的非转移性结肠癌(CC)存在错配修复缺陷(dMMR),其特征是DNA错配修复系统缺陷导致肿瘤高突变率且具有很强的免疫原性。尽管dMMR CC患者对化疗的获益有限,但研究显示这类肿瘤对抗PD-1联合抗CTLA-4新辅助治疗的反应极佳,可获得高病理缓解率。
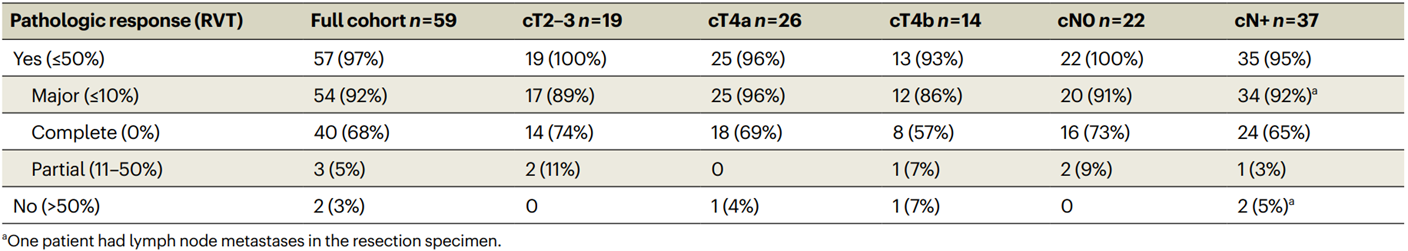
在NICHE-3研究中,共有59例局部晚期dMMR CC患者在手术前接受了2个周期(4周治疗为一个周期)的纳武利尤单抗(480 mg)联合relatlimab(480 mg)治疗。其中57例(97%;95%置信区间(CI):88%~100%)观察到病理缓解,达到了主要终点。其中54例(92%;95% CI:81%~97%)为主要病理缓解(≤10%残余活性肿瘤),40例(68%;95% CI:54%~79%)达到了病理完全缓解(表1)。在中位随访8个月(范围2~19个月)内,仅有1例患者复发。该治疗显示出可接受的安全性,所有级别和3~4级免疫相关不良事件(irAE)分别发生在80%和10%的患者中。最常见的irAE包括输注相关反应(29%)、甲状腺功能障碍(22%)和疲劳(20%)。
表1. 所有接受治疗患者的病理缓解情况(n = 59)
总之,该研究结果表明纳武利尤单抗/relatlimab新辅助治疗能获得高病理缓解率,值得在更大规模的研究中进一步探讨。这些数据为dMMR CC的新辅助免疫治疗方案提供了支持。(临床试验注册号:NCT03026140)
陈治宇教授:尽管在局部晚期结肠癌中新辅助治疗的地位仍存一定争议,既往FoxTROT和OPTICAL研究显示新辅助化疗能带来的获益有限,特别是在dMMR的患者,接受新辅助化疗后分别只有7%和5%的病理学缓解率,说明这类患者对化疗的敏感性较低。而如果给予局晚期dMMR结肠癌患者免疫药物治疗,则会带来革命性的疗效结果;NICHE和NICHE-2的研究显示在接受纳武利尤单抗+伊匹木单抗新辅助免疫治疗的dMMR患者,病理学缓解率高达98%~100%,病理学完全缓解率(pCR)高达60%~68%,术后3年的DFS率为100%,这些结果说明新辅助免疫治疗在优势人群中的疗效不仅带来了更高的pCR率,在未来更长的随访时间内带来了治愈的可能。
LAG-3也是一种免疫检查点,在接受抗原长期刺激后常表达于T细胞表面,是T细胞耗竭状态的标志,如果同时阻断PD-1和LAG-3,临床前研究显示能导致CD8+T细胞共表达细胞毒性和耗竭模块,从而促进抗肿瘤免疫。虽然对于PD-1和LAG-3如何协同抑制抗肿瘤活性的机制仍然了解有限,但是在恶性黑色素瘤中的RELATIVITY-047的Ⅲ期随机对照研究,显示出两者的联合,和单用纳武利尤单抗相比,在初治的转移性恶黑患者中,无进展生存时间(PFS)获得了翻倍的临床获益,分别为10.2个月vs 4.6个月。因此,在免疫治疗优势人群中,不同免疫检查点抑制剂的联合可能给临床患者带来新的选择。
基于RELATIVITY-047的良好结果,和NICHE及NICHE-2研究采用PD-1和CTLA-4的双重阻断不同的是,NICHE-3研究在局部晚期dMMR结肠癌患者中给与纳武利尤单抗和LAG-3抑制剂-relatlimab的同时阻断治疗,每4周1次,共2次后去进行手术切除。结果显示97%的患者获得了病理学缓解,pCR率为68%,和NICHE-2研究相同,中位随访期为8个月时,有1例患者复发。
在NICHE-3入组的患者中,基本特征和NICHE-2非常类似,cT4率为68%,cN+率为63%,后者分别为65%和67%,林奇综合征比例分别为19%和31%。从免疫治疗相关毒性来看,纳武利尤单抗联合relatlimab略高于纳武利尤单抗+伊匹木单抗,3级以上的毒性发生率分别为10%和4%,NICHE-3研究的毒性略高于NICHE-2,主要表现在甲状腺功能失调、肾上腺功能不全和结肠炎的发生率增加,可能和在此研究中采用480 mg的Relatlimab剂量,高于既往研究中的80或160 mg的剂量有关。在此研究中,有1例患者术后出现了复发,和NICHE-2研究3年DFS为100%相比,NICHE-3研究的长期疗效仍有待于时间来考证。
因此,尽管两个研究中的pCR率是相等的,但是pCR的获益是否能转化为长期的生存获益,pCR能否作为生存的替代指标,在新辅助免疫治疗当中需要进一步确定。
在高危Ⅱ期结肠癌患者中评估奥沙利铂联合氟嘧啶类药物辅助化疗的疗效:一项ACCENT 汇总分析[4]
氟嘧啶(FP)联合奥沙利铂(OX)的化疗是Ⅲ期结肠癌(CC)的辅助治疗方案。FP联合OX(FPOX)也可能对具有高危因素的Ⅱ期CC术后治疗有效。该文章对MOSAIC和C-07研究进行了汇总分析,依据预后因素、高危因素数量以及当前的临床病理风险分类(基于T分期、肿瘤穿孔和检查的淋巴结数量)对FPOX治疗高危Ⅱ期CC的有效性进行了评估。将1595例接受FP或FPOX治疗的Ⅱ期CC患者的数据进行汇总。通过Kaplan-Meier曲线和未调整的Cox模型对每项研究中奥沙利铂带来的总生存(OS)获益进行分层分析。3059例Ⅲ期CC患者仅用于分析肿瘤分期与化疗间的关联关系。
在该项对Ⅱ期患者的汇总分析中,性别、年龄、穿孔/梗阻和肿瘤侧别作为多变量分析中的独立预后因素。结果发现添加OX到FP中的化疗方案对OS的影像与不同肿瘤分期存在显著相关性,Ⅱ期患者的风险比(HR)为1.03(95% CI,0.82~1.29;P = 0.813),III期患者为0.82(95% CI,0.73~0.92;P = 0.001;Pint = 0.073)。对于伴随任何预后因素的Ⅱ期患者,添加OX到FP均未显示获益。该研究检验的各项Ⅱ期高危因素均未能预测OX的获益。根据当前公认的临床病理风险分类也未在Ⅱ期患者中观察到OX带来的OS获益(HR为0.86,95% CI,0.63~1.18;P = 0.349)(图3)。
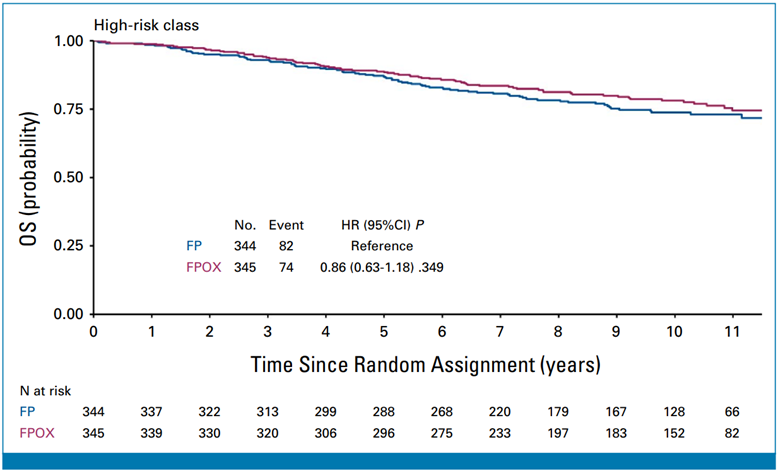
在高危Ⅱ期CC中,无论使用何种定义来表征肿瘤的高复发风险,均未发现将OX加入辅助治疗带来的额外OS获益。因此该研究建议,OX不应成为Ⅱ期CC患者辅助化疗的标准治疗,即使在高危患者中亦是如此。
Ⅲ期BEACON CRC研究中BRAF V600E突变型转移性结直肠癌的分子分析[5]
BEACON CRC研究表明,康奈非尼(Enco)+西妥昔单抗(Cetux)±比美替尼(Bini)的方案可显著改善经治的BRAF-V600E突变型转移性结直肠癌(mCRC)患者的总体生存(OS),并为Enco+Cetux方案在美国和欧盟的批准提供了依据。因此,进一步对预测Enco+Cetux±Bini治疗反应的生物标志物展开深入分析具有临床意义。
在BEACON CRC研究预设的探索性生物标志物分析中,研究人员通过整合临床信息和分子分析数据,描述了基因组和转录组(包括通过组织测序获得的全外显子组和转录组以及循环肿瘤DNA基因组的分析数据)与临床结局和获得性耐药机制间的相关性。具有较显著免疫特征的肿瘤在接受Enco+Bini+Cetux治疗时显示出OS获益的趋势。RAS、MAP2K1和MET的突变是接受Enco+Cetux±Bini治疗的患者最常见的突变类型(图4),尤其在那些基线时细胞周期基因高表达的患者中表现更为显著。基线TP53突变与获得性MET扩增存在相关性。获得性突变呈现亚克隆和多克隆的特征,且在接受Enco+Cetux±Bini治疗的患者中观察到肿瘤突变率增加及SBS17a/b的特征性突变。
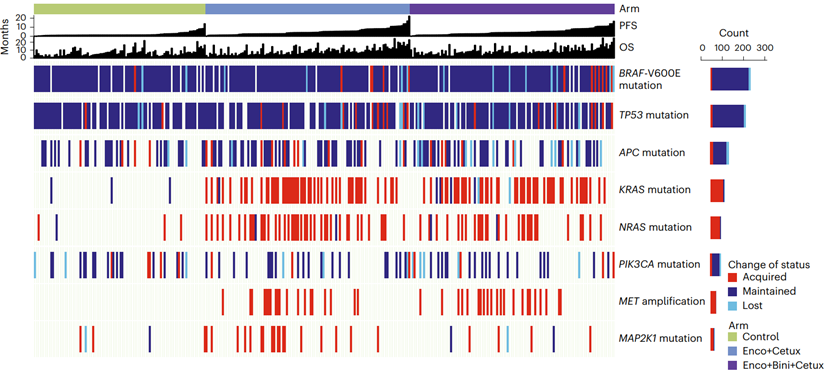
这些发现支持了Enco+Cetux±Bini治疗在BRAF-V600E突变型mCRC患者中的应用,同时也提供了对MAPK通路靶向治疗反应和生物学耐药机制的参考。(临床试验注册号:NCT02928224)
本期看点:
1、一项多中心前瞻性随机对照试验(TransMet),旨在评估肝脏移植联合化疗是否能够改善永久性不可切除的结直肠癌肝转移患者的总体生存。结果发现,与接受单独化疗相比,接受肝脏移植联合化疗并给予器官分配优先权可显著提高该类患者的5年生存率,建议考虑将肝脏移植作为该类患者的新标准治疗选择。
2、一项前瞻性研究的中期分析(CIRCULATE-Japan GALAXY),旨在深入探讨ctDNA-MRD检测与可切除结直肠癌患者的复发风险及接受辅助化疗获益的相关性。该研究结果为ctDNA监测应用于在术后复发预测和死亡风险分层评估提供了证据,同时也可以用于指导辅助治疗。
3、一项随机Ⅱ期试验(NICHE-3),研究中97%的患者获得病理缓解,68%的患者达到pCR。该研究结果表明纳武利尤单抗/relatlimab新辅助治疗能获得高病理缓解率,值得在更大规模的研究中展开验证。
4、一项对既往研究的汇总分析(ACCENT),旨在明确将奥沙利铂加入到氟嘧啶类药物辅助化疗中是否可能为高危Ⅱ期结肠癌患者术后患者带来额外生存获益。结果表明,对于Ⅱ期患者不论合并任何高危因素,联合奥沙利铂的辅助治疗都没有显示出OS 的改善,并指出奥沙利铂不应成为Ⅱ期结肠癌患者辅助化疗的标准方案。
5、一项生物标志物分析(来自BEACON CRC研究),旨在探索预测康奈非尼+西妥昔单抗±比美替尼治疗反应的生物标志物与临床结局和获得性耐药机制间的相关性。结果进一步支持了康奈非尼+西妥昔单抗±比美替尼治疗在BRAF-V600E突变型mCRC患者中的应用,揭示了潜在的获得性耐药机制以及免疫相关基因状态和细胞周期基因表达与患者预后和治疗反应间的可能关联。
1. Adam R, Piedvache C, Chiche L, et al. Liver transplantation plus chemotherapy versus chemotherapy alone in patients with permanently unresectable colorectal liver metastases (TransMet): results from a multicentre, open-label, prospective, randomised controlled trial. Lancet. 2024 Sep 21;404(10458):1107-1118.
2. Nakamura Y, Watanabe J, Akazawa N, et al. ctDNA-based molecular residual disease and survival in resectable colorectal cancer. Nat Med. 2024 Sep 16.
3. de Gooyer PGM, Verschoor YL, van den Dungen LDW, et al. Neoadjuvant nivolumab and relatlimab in locally advanced MMR-deficient colon cancer: a phase 2 trial. Nat Med. 2024 Sep 15.
4. Chibaudel B, Raeisi M, Cohen R, et al. Assessment of the Addition of Oxaliplatin to Fluoropyrimidine-Based Adjuvant Chemotherapy in Patients With High-Risk Stage II Colon Cancer: An ACCENT Pooled Analysis. J Clin Oncol. 2024 Sep 4:JCO2400394.
5. Kopetz S, Murphy DA, Pu J, et al. Molecular profiling of BRAF-V600E-mutant metastatic colorectal cancer in the phase 3 BEACON CRC trial. Nat Med. 2024 Sep 23.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


