抗体偶联药物(ADC)是抗肿瘤治疗尤其是肺癌治疗领域的耀眼新星,针对多种不同靶点的ADC药物不断涌现出令人鼓舞的研究成果。德曲妥珠单抗(DS-8201/T-DXd)是肺癌领域目前首个且唯一获得FDA批准的HER2(ERBB2)ADC,开启了HER2(ERBB2)突变晚期非小细胞肺癌(NSCLC)患者治疗的新时代。
【肿瘤资讯】特邀四川大学华西医院田攀文教授精读DESTINY-Lung系列研究结果。
特邀专家
四川大学华西医院 肺癌中心 副主任
四川大学华西医院 呼吸与危重症医学科 医疗组长
四川省学术与技术带头人后备人选
中国抗癌协会肺癌专业委员会青年委员
四川省抗癌协会肿瘤呼吸病学专委会副主任委员
四川省医学会呼吸专委会肺癌学组副组长
参与获得国家科技进步奖二等奖,四川省科技进步奖一等奖
主持国家自然科学基金面上项目、四川省科技厅重点项目等
DESTINY-Lung01研究结果盘点:
德曲妥珠单抗在HER2变异人群中疗效初现
【2020 ASCO】DESTINY-Lung01研究首次公布中期分析[1]
DESTINY-Lung01是一项开放标签、多中心、双队列、II期临床研究,旨在评估6.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)用于HER2(ERBB2)过表达(队列1)和HER2(ERBB2)突变(队列2)转移性NSCLC的疗效。2020 ASCO大会上,DESTINY-Lung01首次公布了中期分析结果。其中队列2纳入42例HER2(ERBB2)突变晚期NSCLC患者,有54.8%的患者既往接受过PD-1/PD-L1单抗治疗,45.2%的患者基线时有脑转移。结果显示,HER2(ERBB2)突变患者的客观缓解率(ORR)为61.9%,疾病控制率(DCR)为90.5%,中位缓解持续时间(DoR)未达到,中位无进展生存期(PFS)为14个月,中位总生存期(OS)未达到,提示德曲妥珠单抗在HER2变异非小细胞肺癌中的疗效优异。
表1 疗效分析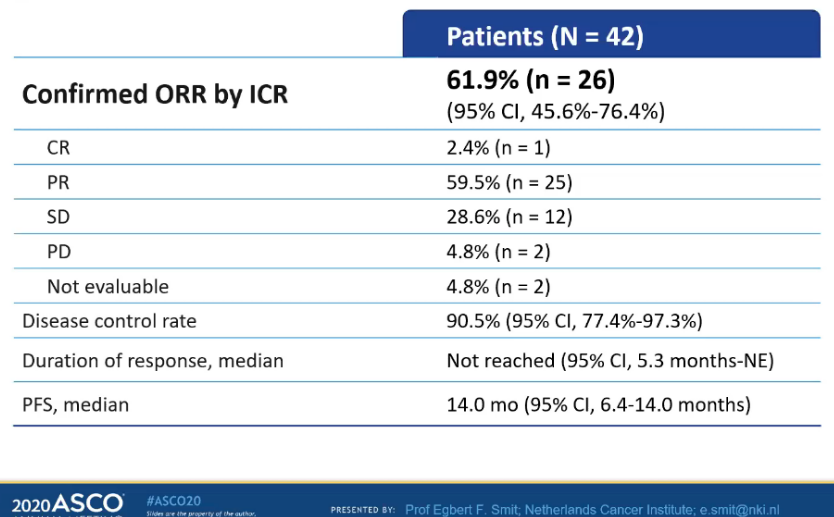
【2021 ESMO】DESTINY-Lung01公布主要结果,同步在线发表NEJM[2]
在本次公布的结果中,德曲妥珠单抗(DS-8201/T-DXd)(6.4mg/kg)在91例HER2(ERBB2)突变晚期NSCLC患者中展现出持久的抗肿瘤活性。确认的ORR为55%,中位DoR为9.3个月,中位PFS为8.2个月,中位OS为17.8个月。研究结果进一步支持德曲妥珠单抗(DS-8201/T-DXd)在HER2(ERBB2)突变晚期NSCLC患者中具有优异的临床疗效和获益。另外德曲妥珠单抗(DS-8201/T-DXd)在不同亚组中(包括基线脑转移亚组)均观察到一致的疗效和获益。最早前德曲妥珠单抗(DS-8201/T-DXd)在其他瘤种例如乳腺癌和胃癌中针对的是HER2(ERBB2)阳性患者人群,而德曲妥珠单抗(DS-8201/T-DXd)此次取得突破针对的是HER2(ERBB2)突变晚期NSCLC人群。因此德曲妥珠单抗(DS-8201/T-DXd)此次在肺癌领域取得突破尤其引人注目。
 图1 6.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)的抗肿瘤疗效
图1 6.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)的抗肿瘤疗效
DESTINY-Lung02研究结果盘点:
德曲妥珠单抗剂量进一步优化
疗效与安全性兼顾
【2022 ESMO】DESTINY-Lung02中期分析数据公布[3,4]
在DESTINY-Lung01研究探索中,德曲妥珠单抗(DS-8201/T-DXd)已在HER2变异非小细胞肺癌中显示出疗效,但在安全性方面仍需探索。因此研究者进一步开展了DESTINY-Lung02研究,旨在评估5.4 mg/kg、6.4 mg/kg德曲妥珠单抗(DS-8201/T-DXd)用于HER2(ERBB2)突变转移性NSCLC患者的疗效(图2)。
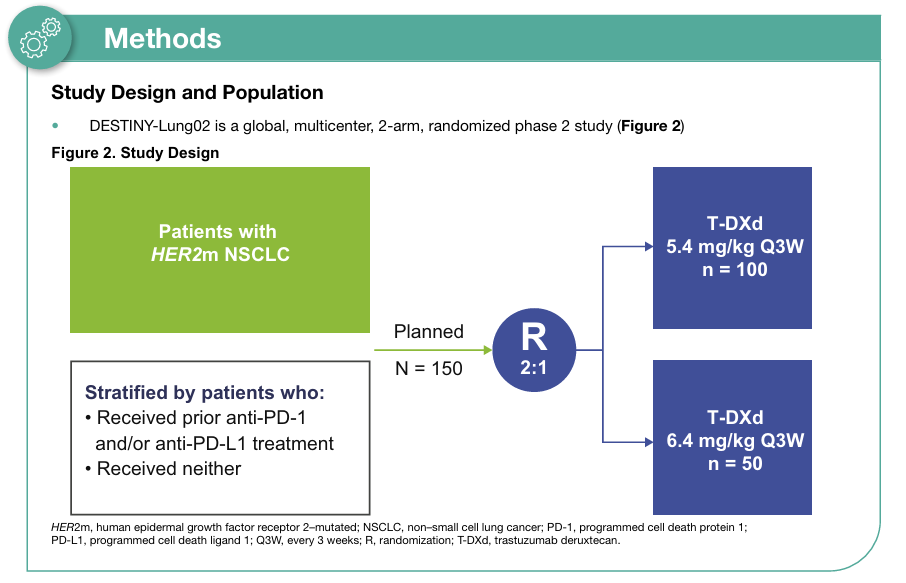 图2 研究设计
图2 研究设计
2022 ESMO大会上,DESTINY-Lung02研究公布的结果显示,预设早期队列(PEC)的中位随访时间为5.54个月,5.4mg/kg、6.4mg/kg组分别纳入52例和28例患者,安全性分析人群中分别有101例、50例患者接受 5.4mg/kg、6.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)治疗。在PEC中,5.4mg/kg、6.4mg/kg组患者的ORR分别为53.8%、42.9%,DCR分别为90.4%、92.9%,中位DoR分别为未达到、5.9个月(表2)。
表2 PEC队列疗效分析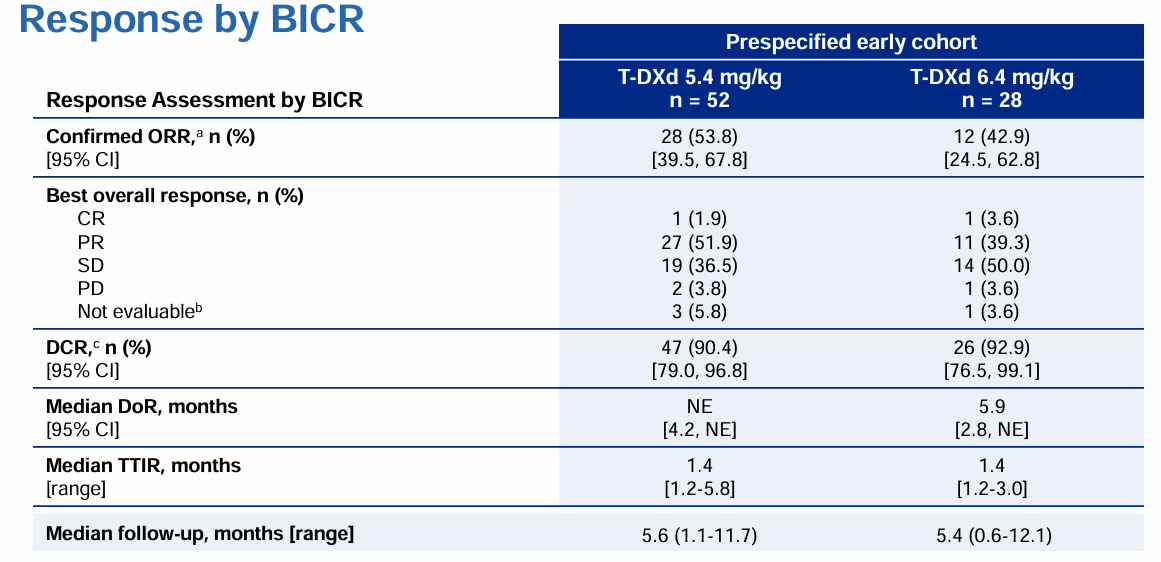
90天随访结果显示,接受5.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)治疗患者确认的ORR为57.7%,中位DoR为8.7个月(表3)。更长随访时间结果提示,5.4 mg/kg德曲妥珠单抗(DS-8201/T-DXd)用于HER2(ERBB2)突变晚期NSCLC患者二线及以上治疗时,仍显示有临床意义的抗肿瘤活性。未发现新的安全性信号,且使用5.4 mg/kg德曲妥珠单抗(DS-8201/T-DXd)的安全性更优,ILD发生率更低,大多数为1-2级事件。研究数据支持FDA批准的5.4 mg/kg剂量德曲妥珠单抗(DS-8201/T-DXd)用于经治HER2(ERBB2)突变的晚期NSCLC,并支持德曲妥珠单抗(DS-8201/T-DXd)可作为此类患者的标准治疗。
表3 90天随访结果
【2023 WCLC】DESTINY-Lung02公布主要分析结果,同步在线发表JCO[5]
此次分析截至2022年12月23日,基线特征显示,5.4mg/kg、6.4mg/kg组中女性患者分别占比63.7%、68.0%,亚洲患者分别占比61.8%、60.0%,从未吸烟者占比53.9%、58.0%,既往接受PD-(L)1治疗患者分别占比73.5%、78.0%。总体疗效显示,由BICR评估的5.4mg/kg、6.4mg/kg组确认的ORR分别为49.0%、56.0%,两组的DCR分别为93.1%、92%,两组的中位DoR分别为16.8个月、未达到(表4)。两组的中位PFS分别为9.9个月、15.4个月,1年PFS率分别为45%、53%,中位OS分别为19.5个月、未达到,1年OS率分别为67%、73%。安全性结果与既往一致,5.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)安全性更优。
表4 疗效分析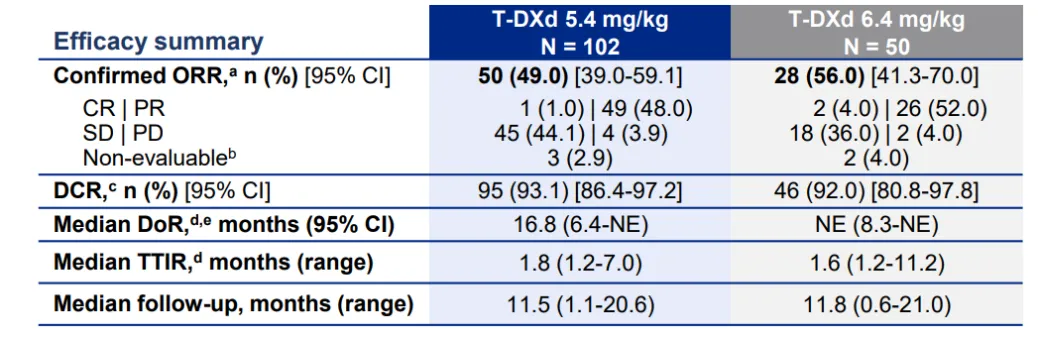
【2024 ASCO】DESTINY-Lung02研究公布最终分析结果[6]
本次最终分析时,5.4mg/kg、6.4mg/kg组的中位随访时间分别为11.5个月、11.8个月,基线特征显示,5.4mg/kg和6.4mg/kg组中亚裔患者分别占比61.8%、60%,分别有73.5%、78%的患者接受过PD-1/PD-1单抗,分别有67.6%、62%的患者接受过一线/二线治疗,分别有32.4%、38%的患者接受过3线及以上的治疗,基线伴CNS转移患者分别占比34.3%、44%。主要结果显示,两组中德曲妥珠单抗(DS-8201/T-DXd)在总人群中的ORR分别为49%、56%,DCR分别为93.1%、92%(表5),中位PFS分别为9.9个月、15.4个月,中位OS分别为19.5个月、未达到。安全性方面,德曲妥珠单抗(DS-8201/T-DXd)显示出与既往研究一致的安全谱特征,5.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)仍显示更优的安全性。
表5 最终分析疗效分析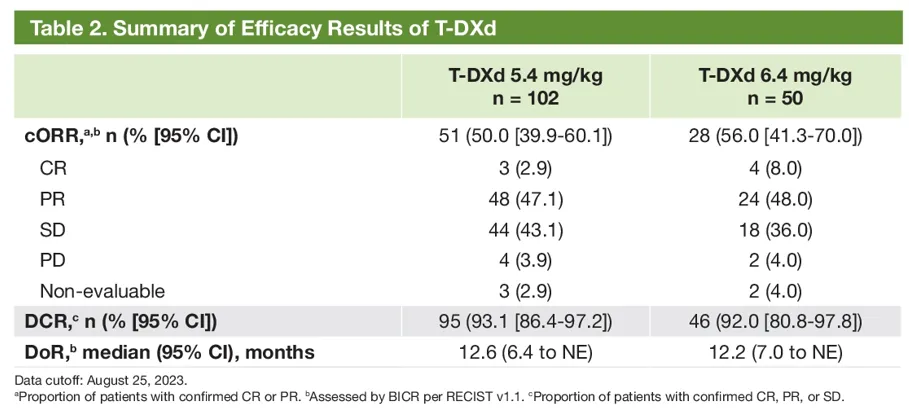
DESTINY-Lung05研究:
德曲妥珠单抗(DS-8201/T-DXd)
在中国人群具有卓越疗效
DESTINY-Lung01和DESTINY-Lung02研究证实了德曲妥珠单抗(DS-8201/T-DXd)用于HER2(ERBB2)突变晚期NSCLC后线治疗的卓越疗效,为进一步验证德曲妥珠单抗(DS-8201/T-DXd)在中国人群中的疗效,研究者在中国30多家中心开展了DESTINY-Lung05[7]试验,这是一项开放标签、单臂、II期临床研究,旨在评估5.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)用于至少一线治疗期间或治疗进展后HER2(ERBB2)突变转移性NSCLC中国患者的疗效和安全性。 2024 AACR大会上公布了中位随访9.8个月的结果。基线特征显示,分别有58.3%、41.7%的患者既往接受过2线及以上、1线治疗,分别有93.1%、90.3%、68.1%、68.1%的患者既往接受过细胞毒化疗、含铂化疗、免疫治疗、抗血管生成药物。
疗效分析显示,由ICR评估确认的ORR为58.3%,中位DoR未达到,DCR为91.7%(表7),中位PFS未达到,12个月PFS率为55.1%。由研究者评估确认的ORR为58.3%,中位DoR为9个月,DCR为93.1%,中位PFS为10.8个月,12个月PFS率为39.7%。
总体可见,与DESTINY-Lung02全球人群结果一致,5.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)在HER2(ERBB2)突突转移性NSCLC中国人群中显示出有临床意义的、强大持久的疗效及可控的安全性。研究结果支持在中国人群中使用5.4mg/kg德曲妥珠单抗(DS-8201/T-DXd)。德曲妥珠单抗(DS-8201/T-DXd)目前已被CDE纳入优先评审,期待其尽早能在中国上市,以造福中国患者。
表6 DESTINY-Lung05研究主要结果
小结
DESTINY-Lung系列研究累累硕果,自2020年开始多次在国际学术会议亮相,研究结果得到国际同道的广泛认可。德曲妥珠单抗(DS-8201/T-DXd)早在2022年即获得FDA加速批准用于HER2(ERBB2)突变晚期NSCLC患者的后线治疗,目前在中国已被CDE纳入优先评审,期待德曲妥珠单抗肺癌适应症早日中国上市,为HER2(ERBB2)突变中国晚期NSCLC患者带来新的治疗选择!
[1]Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2(ERBB2)-mutated metastatic non-small cell lung cancer (NSCLC): Interim results of DESTINY-Lung01.2020 ASCO Abstract 9504.
[2]Li BT, Smit EF, Goto Y, et al.DESTINY-Lung01 Trial Investigators. Trastuzumab Deruxtecan in HER2(ERBB2)-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2022 Jan 20;386(3):241-251. doi: 10.1056/NEJMoa2112431. Epub 2021 Sep 18.
[3]Trastuzumab Deruxtecan (T-DXd) in Patients With HER2(ERBB2)-Mutated (HER2(ERBB2)m) Metastatic Non–Small Cell Lung Cancer (NSCLC): A Phase 2 Study (DESTINY-Lung02).2021 ESMO, Abstract 1361TiP
[4]LBA55-Trastuzumab deruxtecan (T-DXd) in patients (Pts) with HER2(ERBB2)-mutant metastatic non-small cell lung cancer (NSCLC): Interim results from the phase 2 DESTINY-Lung02 trial.2022 ESMO.
[5]MA13.10-Trastuzumab Deruxtecan in Patients with HER2(ERBB2)-Mutant Metastatic Non-Small Cell Lung Cancer: Primary Results of DESTINY-Lung02.2023 WCLC.
[6] Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2(ERBB2) mutant non-small cell lung cancer (NSCLC): primary analysis from the Phase 2 DESTINY-Lung05 (DL-05) trial. Abstract CT248/7,2024 AACR.
[7] Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2(ERBB2) mutant non-small cell lung cancer (NSCLC): primary analysis from the Phase 2 DESTINY-Lung05 (DL-05) trial. Abstract CT248/7,2024 AACR.
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


