(以下内容仅供医学药学专业人士阅读参考,如您非前述专业人士,请离开本页。)
卡马替尼联合纳武利尤单抗治疗EGFR野生型晚期非小细胞肺癌[1]
Capmatinib plus nivolumab in pretreated patients with EGFR wild-type advanced non-small cell lung cancer
Enriqueta Felip, et al.(通讯作者:Enriqueta Felip)
Lung Cancer
IF = 5.3
简介:MET信号异常已被确定为非小细胞肺癌(non-small cell lung cancer,NSCLC)的致癌驱动因素。 MET信号传导也可能抑制抗癌免疫应答。 通过与卡马替尼(一种MET抑制剂)联用,能够在小鼠癌症模型中协同增强免疫疗法的疗效,而这种增强效果与肿瘤对MET信号传导的依赖程度无关。在此,我们报告了一项卡马替尼联合纳武利尤单抗(PD-1抑制剂)在既往接受过含铂化疗的EGFR野生型晚期NSCLC患者中的多中心、开放标签、II期研究的结果。
方法: 根据免疫组织化学法测定的MET表达、荧光原位杂交法确定的MET基因拷贝数以及MET 14号外显子跳跃突变的存在情况,将患者分为MET高表达组或MET低表达组,然后接受卡马替尼400 mg口服,每日2次,联合纳武利尤单抗3 mg/kg静脉注射,每2周一次。 主要终点是研究者根据RECIST v1.1评估的6个月无进展生存(PFS)率。
结果: MET高表达组(N=16)和MET低表达组(N=30)均达到了主要终点。 研究报道了MET高表达组和MET低表达组中,通过贝叶斯分析估计的平均6个月PFS率(95%可信区间)和Kaplan-Meier中位PFS,以及总体缓解率。 研究对改联合方案的安全性做了评价,整体安全性可控。
结论: 在既往接受过治疗的晚期EGFR野生型NSCLC患者中,卡马替尼联合纳武利尤单抗显示出临床活性和安全性可控,且与MET状态无关。
点评专家
浙江省抗癌协会青年理事会秘书长
浙江省抗癌协会肿瘤内科专业委员会候任主委
中国临床肿瘤学会(CSCO)理事
中国临床肿瘤学会(CSCO)射频消融专业委员会副主委
中国临床肿瘤学会(CSCO)抗肿瘤安全管理委员会委员
中国抗癌协会(CACA)靶向治疗专业委员会委员
中国抗癌协会(CACA)肿瘤微创治疗专业委员会消融治疗分会常委
中国医药教育协会肿瘤免疫专业委员会常委
中国医药教育协会腹部肿瘤专业委员会常委
浙江省数理医学会理事
浙江省数理医学会肿瘤精准诊疗专业委员会副主委
浙江省肿瘤靶向治疗技术指导中心副主任
浙江省医学会肿瘤精准治疗专业委员会副主委
卡马替尼作为全球最早开始研发的MET抑制剂,早期在MET变异实体瘤中布局了多项研究,并且是最早探索与免疫治疗联合的MET抑制剂。本研究探索了卡马替尼与PD-1抑制剂纳武利尤单抗的联合方案在EGFR野生型NSCLC患者的二线或后线治疗中的疗效和安全性,并在高MET组和低MET组中观察这种方案的获益差异。
既往临床前研究结果为这项研究提供了机制依据:MET过表达或激活可能在肿瘤免疫逃避中发挥作用,导致抗癌免疫反应被抑制 [2,3]。MET与肺癌中程序性死亡配体1 (PD-L1)的表达呈正相关。抑制MET可减轻其免疫抑制作用,恢复抗癌免疫反应。采用高效、选择性的MET抑制剂卡马替尼同时抑制MET,可通过增加肿瘤中的效应T细胞浸润,从而增强免疫检查点抑制剂的疗效[4]。
卡马替尼联合纳武利尤单抗方案,在高MET组和低MET组均达到了主要终点。研究者评估,高MET组和低MET组6个月的PFS率均比较优异。无论患者的MET变异形式如何,均观察到肿瘤缩小。ORR、DOR和中位PFS在两组间无差异,但中位OS有显著差异。尽管是非头对头比较,我们仍可从既往研究的数据中发现一些趋势。CheckMate-017和057研究中,纳武利尤单抗在NSCLC后线的ORR、1年PFS率、中位DoR和OS,与卡马替尼联合纳武利尤单抗低MET组相似,相比高MET组逊色,提示MET高表达可能是联用卡马替尼的更好生物标志物[5,6]。
值得一提的是,在高MET组的16例患者中,只有1例患者发生了MET ex14突变,3例患者的MET GCN介于6至10之间,1例患者的MET GCN超过10。在本研究开展期间,有许多证据支持METex14突变比通过IHC测定的MET过表达更能准确预测卡马替尼的获益[7]。后续需要进一步明确如何更好地定义可获益的高MET人群。
在这项研究中,卡马替尼联合纳武利尤单抗显示出可控的安全性,并且没有出现新的安全性信号。联合用药的安全性与之前报道的单药卡马替尼和单药纳武利尤单抗的安全性基本一致[5-8]。高MET组和低MET组的安全性研究结果一致。再次验证了卡马替尼是一款相对低毒的小分子MET抑制剂,具备较好的联用潜力。尽管如此,其他两项MET抑制剂联合PD-1抑制剂作为晚期NSCLC一线治疗的研究仍面临耐受性挑战,需要进一步关注[9,10]。
该研究存在一定的局限性。由于研究开展的时间较早,对于不同MET变异类型的疗效预测情况尚不明确,因此在研究设计时采用了较广泛的标准来定义高MET组,并且使用IHC和FISH来确认MET变异,而非现在更广泛使用的NGS技术。这可能会导致研究结果出现偏倚。此外,本研究是在PD-1/PD-L1抑制剂联合或不联合化疗成为PD-L1 TPS> 1%的晚期NSCLC患者一线标准治疗之前进行的,因此纳入的患者仍是一线仅接受过化疗治疗的。尽管本研究未通过PD-L1表达状态来筛选人群,但根据本研究中的探索性分析发现,联合治疗的疗效与PD-L1表达并无相关性。此外,既往在MET突变NSCLC的研究中也发现,卡马替尼的疗效不受PD-L1表达的影响[11]。
总之,这项2期研究表明,MET抑制剂和PD-1抑制剂的联合疗法在经治、EGFR野生型、PD-L1未选择的晚期NSCLC患者中显示出临床抗肿瘤活性和可管理的安全性,而不论其MET失调状态如何。鉴于MET异常的异质性较高,如何甄选出有效的可指导治疗的biomarker,是未来值得学术界继续探索的方向。
达拉非尼联合曲美替尼治疗BRAF V600突变非小细胞肺癌:一项单中心真实世界经验[12]
Dabrafenib-trametinib in BRAF V600-mutated non-small-cell lung cancer: a single center real world experience
Andrea Sbrana, et al.(通讯作者:Andrea Sbrana)
Future Oncol
IF = 3.674
目的:研究对2017年至2022年在单中心接受达拉非尼联合曲美替尼治疗的BRAF突变非小细胞肺癌(NSCLC)患者进行了回顾性评估。
患者:分析了42例患者(27例接受一线治疗,15例接受二线/后续治疗)的缓解率和安全性数据。
结果:客观缓解率为73.8%,接受一线或二线治疗的患者之间无差异。 在一线接受联合治疗的患者中观察到的中位无进展生存期(PFS)较二线/后续治疗患者(19.9个月[95% CI:19.7-20] vs 13.1个月[95% CI:8.6-17.6]; P=0.012)更长,且具有统计学意义。 一线联合治疗患者的中位总生存期(OS)为29.9个月(95% CI:14.1-45.7),二线/后续治疗患者的中位总OS为22.4个月(95% CI:14.6-3000)。 联合给药耐受性良好。
结论:研究证实了达拉非尼联合曲美替尼治疗在BRAF V600突变NSCLC中的疗效。
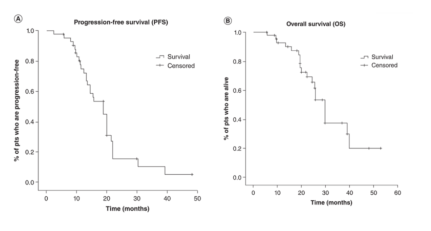 图1 达拉非尼联合曲美替尼治疗BRAF V600 NSCLC患者的疗效:A PFS; B OS
图1 达拉非尼联合曲美替尼治疗BRAF V600 NSCLC患者的疗效:A PFS; B OS
点评专家
医学博士,主任医师,科副主任
中华医学会呼吸分会胸膜与纵膈疾病学组委员
江苏省研究型医院协会肺结节和肺癌学会副主委
江苏省老年学学会中西医结合诊疗专委会副主委
江苏省抗癌协会肿瘤光动力治疗专委会副主委
江苏省医学会呼吸病分会肺癌学组副组长
中国医药教育协会呼吸康复专业委员会委员
华东介入肺脏病学协作组委员
江苏省中西医结合学会呼吸分会常务委员
江苏省区域免疫与移植专业委员会感染与检验学组委员
达拉非尼联合曲美替尼治疗BRAF V600突变非小细胞肺癌(NSCLC)已在中国获批适应症并纳入国家医保目录,成为BRAF V600突变NSCLC患者一线标准治疗。全球注册研究BRF113928研究显示,达拉非尼联合曲美替尼一线治疗BRAF V600E突变NSCLC患者的ORR达64%,mPFS 14.6个月,mOS24.6个月[13]。中国人群注册临床研究同样显示出达拉非尼联合曲美替尼治疗的优异疗效,ORR高达75%,DCR达95%,在中国人群中展现出与全球人群一致的疗效[14]。NCCN,ESMO,CSCO等多个国内外指南均将达拉非尼联合曲美替尼作为晚期BRAF V600突变一线治疗的最高级别推荐[15-17]。
真实世界研究一直被认为是注册临床研究的补充,本次真实世界研究共纳入了42例接受达拉非尼联合曲美替尼治疗的BRAF V600突变NSCLC患者,其中初治患者27例,经治患者15例。研究结果显示,总体患者ORR达73.8%,DCR 92.9%,mPFS 18.9个月,mOS 29.9个月。其中初治患者ORR74.1%,DCR 92.6%,mPFS 19.9个月,mOS 29.9个月;经治患者ORR 73.3%,DCR 93.3%,mPFS 13.1个月,mOS 22.4个月,接受达拉非尼联合曲美替尼一线治疗的患者较后线治疗显示出更多的PFS及OS获益,BRAF V600突变患者应一线优选靶向治疗。达拉非尼联合曲美替尼同样显出良好的安全性,仅有2名患者应发出出现剂量调整。大部分 不良反应是1-2级,3级发热的发生率仅4.8%。该真实世界研究显示出与注册临床研究一致的疗效及安全性。
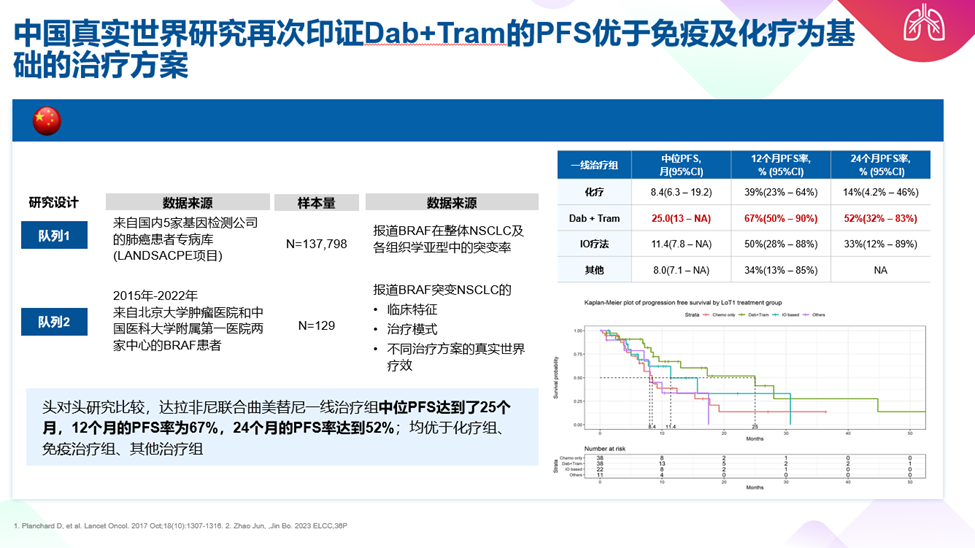
既往多项真实世界研究同样显示出一致的疗效,2021年ESMO会议报道了140例BRAF V600突变患者分别接受达拉非尼联合曲美替尼、免疫联合化疗、免疫单药及化疗治疗。研究结果显示达拉非尼联合曲美替尼治疗mOS为29.9个月,较其他三种治疗方法均显著延长[18]。中国的真实世界研究也证实了达拉非尼联合曲美替尼的良好疗效,110例BRAF突变NSCLC患者分别接受双靶治疗,免疫联合化疗,化疗及其他治疗,其中达拉非尼联合曲美替尼一线治疗组中位PFS达到了25个月,12个月的PFS率为67%,24个月的PFS率达到52%;均优于化疗组、免疫治疗组、其他治疗组[19]。
本次真实世界研究再次证实了达拉非尼联合曲美替尼治疗BRAF V600突变NSCLC的良好疗效及安全性,一线接受靶向治疗较后线获益更多,达拉非尼联合曲美替尼应作为BRAF V600突变NSCLC的首选治疗方式。
达拉非尼联合曲美替尼与PD-1单药在经手术后的III期BRAF V600突变黑色素瘤患者中作为辅助治疗的比较:一项多中心、回顾性队列研究[20]
Dabrafenib plus trametinib versus anti-PD-1 monotherapy as adjuvant therapy in BRAF V600-mutant stage III melanoma after definitive surgery: a multicenter, retrospective cohort study
Xue Bai, et al.(通讯作者:Xue Bai ,Keith T Flaherty)
eClinicalMedicine.
IF =17.033
背景:达拉非尼/曲美替尼(D/T)联合治疗和PD-1单抗治疗均被批准作为 III 期 BRAF V600 突变黑色素瘤患者的辅助疗法。然而,目前尚缺乏直接比较数据。研究旨在描述这两种标准疗法在黑色素瘤中的疗效和毒副反应结果。
方法:这项多中心、回顾性队列研究在澳大利亚、中国、德国、意大利、日本、英国和美国的15家黑色素瘤中心进行。研究纳入了在2015年7月至2022年10月期间接受D+T联合治疗或PD-1单抗辅助治疗的在经手术后的III期BRAF V600突变型黑色素瘤成人患者。主要终点是无复发生存期(RFS)。次要终点包括总生存期(OS)、复发类型和毒副作用。
发现:研究纳入598例III期BRAF V600突变黑色素瘤患者,这些患者在2015年7月至2022年10月期间的确定性手术后接受了辅助D+T联合治疗(n=393 [66%])或PD-1单抗(n=205 [34%])治疗。 中位随访33个月时(IQR 21-43),D+T联合治疗组中位RFS为51.0个月(95% CI 41.0-未达到[NR]),明显长于PD-1单抗组的44.8个月(95% CI 28.5- NR)(单变量:HR 0.66,95% CI 0.50-0.87,P=0.003;多变量:HR 0.58,95% CI 0.39-0.86,P=0.007),与PD-1组的OS相当(多变量,HR 0.90,95% CI 0.48-1.70,P=0.75)。使用限制平均生存时间模型观察到相似结果。 在发生复发的患者中,D+T联合治疗组中的远处转移比例较高。与PD-1单抗组相比,D+T联合治疗组因不良事件(AE)而调整治疗的发生率较高,但持续性AE较少。
解释:在接受手术治疗后的III期BRAF V600突变黑色素瘤患者中, D+T联合治疗相较于PD-1单抗表现出更好的无复发生存期,具有更高的一过性但更低的持续性毒性,以及相当的OS。与PD-1单抗相比, D+T联合似乎提供了更好的治疗效果,但需要更长时间的随访和进行大型前瞻性试验来进一步确认。
BRAF抑制剂靶向治疗能募集活化树突状细胞,促进黑色素瘤的肿瘤免疫[21]
Tumor-targeted therapy with BRAF-inhibitor recruits activated dendritic cells to promote tumor immunity in melanoma.
Florian Hornsteiner, et al.(通讯作者:Patrizia Stoitzner)
J Immunother Cancer
IF = 12.469
背景:靶向治疗能够使肿瘤显著消退,但耐药的出现限制了患者的长期生存获益。 关于骨髓细胞网络,特别是树突状细胞(DC)在靶向治疗中的作用,目前尚缺乏更多信息。
方法:研究通过使用多维多色流式细胞术结合多重免疫组化,研究了在D4M.3A临床前黑素瘤小鼠模型(携带V-Raf鼠肉瘤病毒癌基因同源物B(BRAF)V600 E突变)中治疗介导的肿瘤微环境(TME)与肿瘤引流淋巴结(LN)中的免疫组学变化。研究补充了RNA测序和细胞因子定量研究,以表征肿瘤的免疫状态。 通过在携带肿瘤的小鼠中消耗CD4+或CD8+ T细胞来探讨T细胞在靶向治疗中的重要性。通过进行体内T细胞增殖实验来表征肿瘤抗原特异性T细胞反应,并使用缺乏1型DC(cDC1)的Batf3-/-小鼠评估了传统cDC1对T细胞免疫在靶向治疗中的贡献。
结果:我们的研究结果揭示,BRAF抑制剂治疗增加了肿瘤的免疫原性,这反映在与免疫激活相关的基因上调。T细胞炎症的TME含有更高数量的活化的cDC1和cDC2,同时也有表达CCR2的炎症性单核细胞。同时,肿瘤靶向治疗增强了肿瘤引流LN中迁移性、活化的DC亚群的频率。此外,我们在肿瘤和LN中鉴定了一种表达Fcγ受体I(FcγRI)/CD64的cDC2群体,它们显示出高水平的CD40和CCR7,表明它们参与了T细胞介导的肿瘤免疫。cDC 2的重要性通过在cDC 1缺陷型小鼠模型中治疗应答的部分丧失而得到强调。 CD4+和CD8+ T细胞对于治疗应答都是必不可少的,因为它们各自的耗竭会损害治疗成功。在耐药形成时,肿瘤恢复到免疫惰性状态,伴随DC和炎症性单核细胞的损失以及调节性T细胞的积累。此外,肿瘤抗原特异性的CD8+ T细胞在增殖和干扰素-γ产生方面也受到了损害。
结论:该研究结果为靶向治疗对髓样细胞景观的重塑提供了新颖的见解。研究展示了瞬时免疫原肿瘤环境中包含更多活化的树突状细胞。这一发现对未来联合疗法的开发具有重要意义。
TWIST1是HGF/MET途径的一个关键下游靶点,并且对于由致癌基因驱动的肺癌中MET诱导的获得性耐药是必需的[22]
TWIST1 is a critical downstream target of the HGF/MET pathway and is required for MET driven acquired resistance in oncogene driven lung cancer.
Vinod Kumar, et al.(通讯作者:Timothy F. Burns)
Oncogene
IF = 8.756
MET扩增/突变是NSCLC中重要的靶向致癌驱动因素,然而,获得性耐药难以避免,大多数具有靶向MET突变的患者对MET酪氨酸激酶抑制剂(TKI)无效。 此外,MET扩增是TKI耐药最常见的介导因素之一。 因此,明确需要靶向MET通路并克服MET TKI耐药的新疗法。 我们发现上皮-间充质转化(EMT)转录因子TWIST 1是HGF/MET通过抑制p27诱导耐药的关键下游介导因子,靶向TWIST 1可以克服耐药。 研究发现在多个MET依赖性TKI获得性耐药PDX模型中,TWIST 1在TKI耐药时过表达。研究首次证明MET直接稳定TWIST蛋白导致TKI耐药,并且TWIST1对于MET驱动的肺癌发生是必需的,并且当过表达时可以诱导MET TKI耐药。TWIST1通过抑制p27的表达介导MET TKI的耐药性,并且通过遗传或药理学手段抑制TWIST1能够克服体外和体内的TKI耐药性。研究结果表明,靶向TWIST1可能是一种有效的治疗策略,用于克服MET驱动的NSCLC以及其他由致癌基因驱动(以MET扩增作为耐药机制)的亚型中的耐药性。
[1] Enriqueta Felip, et al. Lung Cancer. 2024 Jun: 192: 107820.
[2] H.K. Ahn, et al, Int. J. Mol. Sci. 20 (17) (2019).
[3] W.C.M. Dempke, et al, Transl Lung Cancer Res 10 (6) (2021) 2667–2682.
[4] N. Glodde, T. Bald, et al, Immunity 47 (4) (2017) 789–802 e9.
[5] J. Brahmer, et al, N Engl J Med 373(2) (2015) 123-35.
[6] H. Borghaei, et al, N Engl J Med 373(17) (2015) 1627-39.
[7] M. Schuler, et al, Ann. Oncol. 31 (6) (2020) 789–797.
[8] J. Wolf, et al, N Engl J Med 383(10) (2020) 944-957.
[9] J. Wolf, et al, Ann. Oncol. 33 (2022) S1007–S1008.
[10] T.S. Mok, et al, American Society of Clinical Oncology, 2022.
[11] Sabari JK, et al. Ann Oncol. 2018; 29:2085-91.
[12] Andrea Sbrana, et al. Future Oncol. 2024 May 6:1-7.
[13] Planchard D, et al. Lancet Oncol 2017; 18: 1307–16.
[14] Fan Y, et al .2022 WCLC . EP08.02-052.
[15] 2024年非小细胞肺癌CSCO指南.
[16] NCCN NSCLC guideline 2024 V6.
[17] Hendriks LE, et al. Ann Oncol. 2023 Jan 3: S0923-7534(22)04785-8.
[18] Elosky B, et al .2021 ESMO 1260P.
[19] Zhao Jun, et al. 2023 ELCC,36P.
[20] Xue Bai, et al. EClinicalMedicine. 2023 Oct 31:65:102290.
[21] Florian Hornsteiner, et al. J Immunother Cancer. 2024 Apr 17;12(4): e008606.
[22] Vinod Kumar, et al. Oncogene. 2024 May;43(19):1431-1444.
排版编辑: winnie











 苏公网安备32059002004080号
苏公网安备32059002004080号


