随着药物结构的不断优化,抗体药物偶联物(ADC)在肿瘤学领域取得了突破性进展,特别是在肺癌治疗方面,针对HER2、HER3、TROP2、MET、B7-H3等靶点的ADC研发正如火如荼地进行。在2024年美国临床肿瘤学会(ASCO)年会上,一系列关于ADC在NSCLC治疗中的创新研究成果得以展示,为患者带来了新的治疗选择。
本文对ASCO年会上公布的NSCLC领域ADC药物的重磅研究进展进行汇总梳理,希望能为临床实践提供指导,为NSCLC治疗的未来发展趋势提供洞见。
103: Telisotuzumab vedotin单药治疗既往接受过治疗的c-Met过表达非鳞状EGFR野生型晚期NSCLC患者:LUMINOSITY试验的主要分析
背景:约25%的非鳞状(NSQ)EGFR野生型(WT)NSCLC患者存在c-Met蛋白过度表达(Ansell等人,2022年CRUK),这与预后不良相关(Liang, Wang. Onco Targets Ther. 2020)。Telisotuzumab vedotin(Teliso-V)是一种c-Met导向的抗体药物偶联物,由mAb telisotuzumab和微管聚合抑制剂单甲基auristatin E组成。2期LUMINOSITY试验(NCT03539536)旨在确定最适合Teliso-V的c-Met过度表达(OE)NSCLC人群,并扩展选定组别以进一步评估疗效。我们报告了c-Met OE NSQ EGFRWT NSCLC患者的主要分析结果。
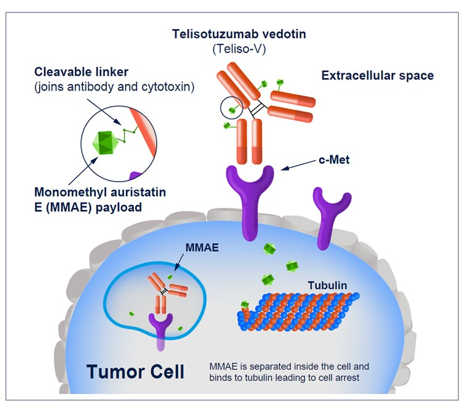
方法:这项2期、非随机、多中心研究招募了局部晚期/转移性c-Met OE NSCLC患者,接受过≤2线的治疗方案(化疗[CTx]+免疫治疗[IO]或序贯CTx+IO),以及≤1线的化疗。c-Met OE(Ventana MET [SP44]临床试验分析[CTA])定义为≥25%的肿瘤细胞具有3+染色(高:≥50% 3+;中:25%至<50% 3+)。Teliso-V剂量为1.9 mg/kg IV Q2W。主要终点是独立中心审查根据RECIST v1.1评估的总缓解率(ORR)。
结果:172例NSQ EGFR WT NSCLC患者接受了≥1个剂量Teliso-V治疗,构成了安全人群;161例(c-Met高,78;c-Met中,83)包括在基线和疗效分析中。中位年龄为64岁(范围33-83),69%为男性,70%的ECOG PS为1。97.5%的患者之前接受过铂类治疗,82.0%的患者之前接受过免疫检查点抑制剂。ORR为34.6%(c-Met高),22.9%(c-Met中),28.6%(总体)。中位DOR为9.0个月(c-Met高),7.2个月(c-Met中),8.3个月(总体)。最常见的任何级别的治疗相关不良事件(TRAEs)是周围感觉神经病变(30%),外周水肿(16%)和疲劳(14%)。2例患者出现5级TRAEs(间质性肺病、呼吸衰竭)。
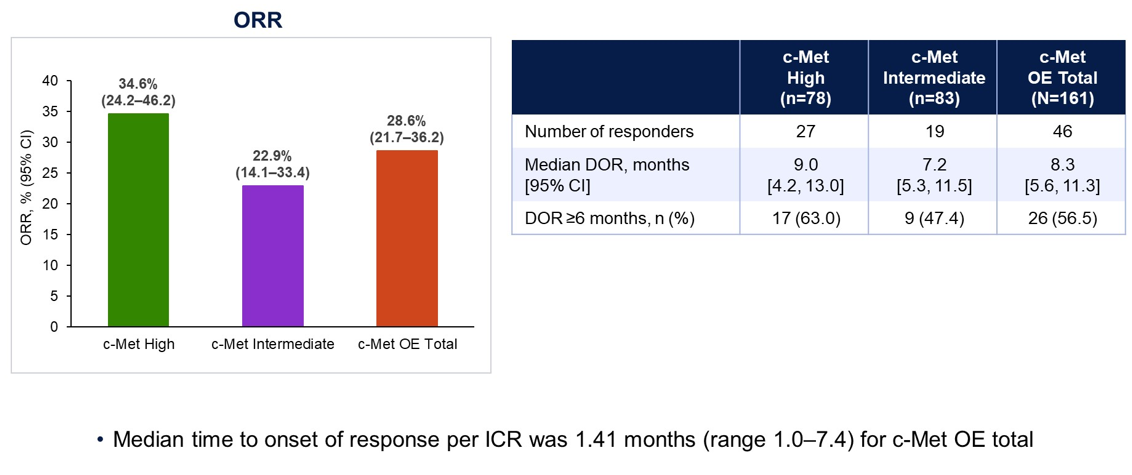
结论:Teliso-V在c-Met过度表达的非鳞状EGFR野生型NSCLC患者中显示出令人信服且持久的反应,特别是在c-Met高的患者中。Teliso-V具有可接受的安全性,临床可控,与之前的数据一致。
8521: Sigvotatug vedotin(一种正在研究的ADC)在NSCLC中的疗效和安全性:更新的I期结果(SGNB6A-001)
背景:IB6是一种肿瘤相关膜蛋白,在发病机制和侵袭性中起重要作用,其表达与不良预后相关。Sigvotatug vedotin (SV),以前称为SGN-B6A,是一种靶向 IB6的ADC,在1期研究SGNB6A-001 (NCT04389632) (Hollebecque 2023) 中对NSCLC表现出具有令人鼓舞的活性。本研究报告了SV在NSCLC中的最新疗效和安全性。

方法:SGNB6A-001是一项开放标签、多中心、1期研究,评估SV在晚期实体瘤患者中的安全性、药代动力学 (PK) 和抗肿瘤活性 (cORR、DOR和PFS和OS)。在剂量递增期间探索了多剂量方案 (A部分)。剂量扩展(B部分)正在针对包括NSCLC在内的各种肿瘤的选定方案进行。C部分和D部分将评估SV与帕博利珠单抗联合治疗NSCLC和HNSCC的效果。符合条件的患者没有治疗选择(A部分)或已接受过铂类和抗 PD-(L)1治疗(除非有禁忌症)(B部分),并在21天周期的D1和D8(2Q3W;1.2/1.25 mg/kg 总体重 [TBW])或28 天周期的D1和D15(2Q4W;1.5 mg/kg TBW,1.8 mg/kg 调整后理想体重 [AiBW])接受SV扩展方案治疗。
结果:截至2024年3月6日,317例患者接受了SV治疗。117例NSCLC患者接受了A部分和B部分的扩展方案。所有NSCLC患者的cORR为19%,非鳞状(nsq)/紫杉烷初治NSCLC患者的cORR为31%。在NSCLC患者中,TEAE、≥G3 TEAE、SAE和导致停药的TEAE发生率分别为98.3%、47.0%、34.2%和12.0%,并且在所有接受治疗的患者中均一致。NSCLC患者最常见的≥3级TEAE 是呼吸困难 (9.4%)、疲劳 (6.8%) 和中性粒细胞减少症 (6.0%)。1例NSCLC患者发生治疗相关死亡(肺炎)。
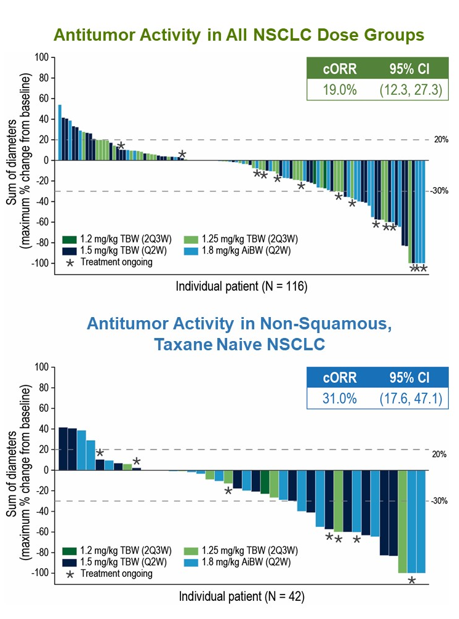
结论:SV在NSCLC患者中继续显示出令人鼓舞的抗肿瘤活性和可控的安全性。1.8mg/kg AiBW 2Q4W的数据支持启动3期研究。
LBA8500:戈沙妥珠单抗对比多西他赛治疗既往接受过铂类化疗和PD(L)-1抑制剂治疗的mNSCLC患者:3期EVOKE-01研究的主要结果
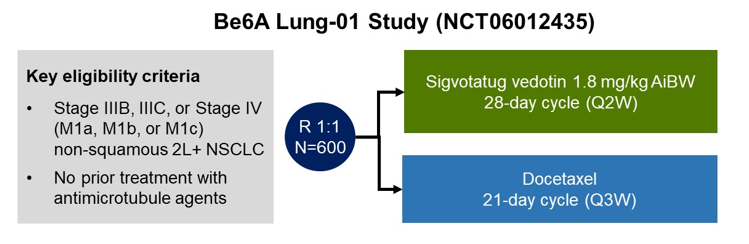
背景:mNSCLC患者在铂类化疗(PT)和免疫治疗(IO)后病情进展时,多西他赛(doc)是标准治疗选择,但疗效并不理想。戈沙妥珠单抗(SG),一种靶向Trop-2的抗体药物偶联物,在经预处理的mNSCLC患者中表现出了持久的疗效和良好的耐受性。我们在此报告了III期EVOKE-01研究的结果,该试验是一项随机、开放标签的研究,旨在比较SG与多西他赛的疗效和安全性。
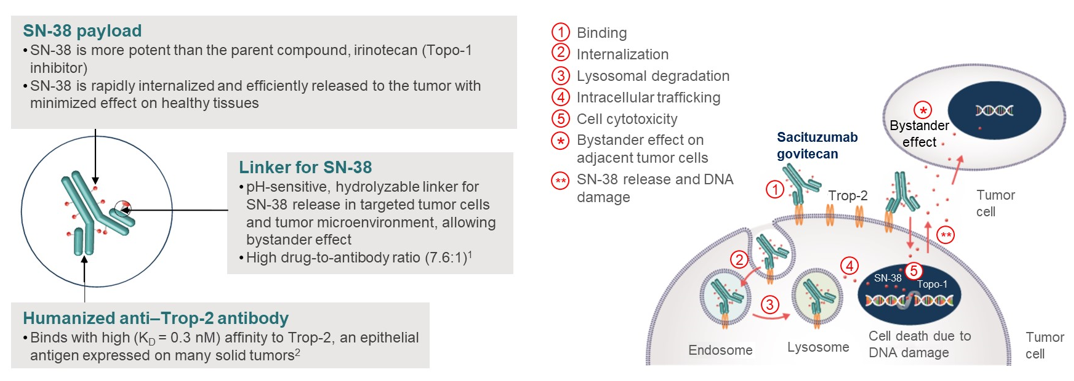
方法:在基于PT的化疗和IO后疾病进展的mNSCLC患者中,研究者按照组织学、对最近一次免疫治疗的最佳反应以及是否接受过针对可操作基因组变异的治疗等因素进行了分层,并以1:1的比例随机分配患者接受SG(10 mg/kg IV,第1天和第8天)或doc(75 mg/m2 IV,第1天)治疗,每21天为一个治疗周期,直至疾病进展或出现不可接受的毒性。主要终点是总生存期(OS);关键次要终点是研究者评估的无进展生存期(PFS)和客观缓解率(ORR)、患者报告结局(PRO)和安全性。
结果:截至2023年11月29日,603例患者接受了随机化。中位年龄为65(31-84)岁; 55%的患者既往接受过1线治疗。该研究在OS上未达到统计学上的显著性。但在鳞状和非鳞状组织学患者中均观察到SG组OS的改善趋势。PFS和ORR如图。在最近一次IO无应答的患者中,SG组的中位OS有3.5个月的临床意义上的改善。与doc相比,SG组患者PRO得到改善。SG组和doc组≥3级治疗后出现的不良事件(TEAE)发生率分别为66.6%和75.7%。SG组和doc组治疗相关AE导致停药发生率分别为 9.8%和16.7%。
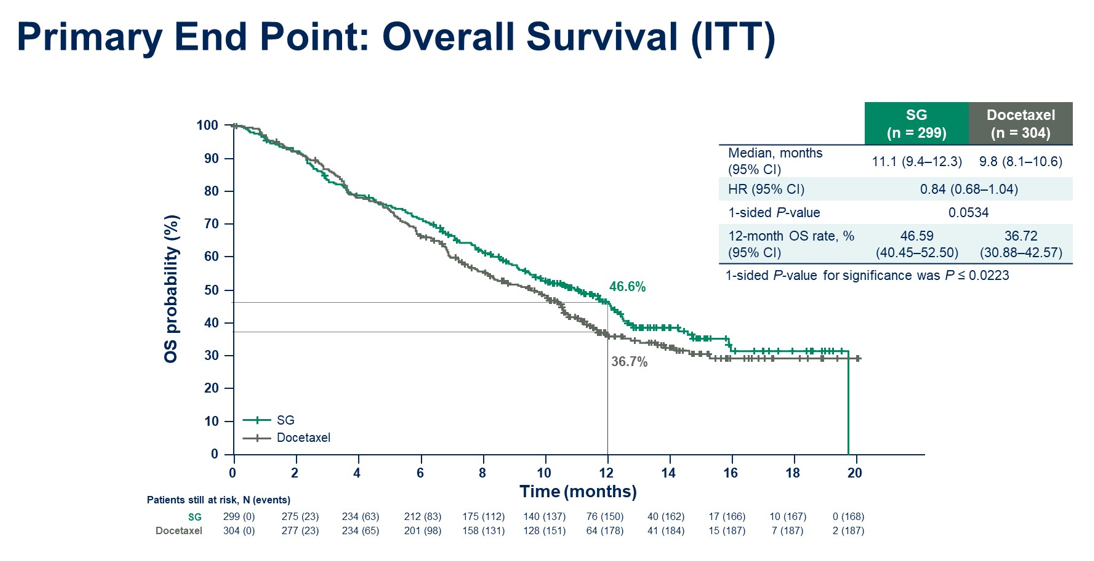
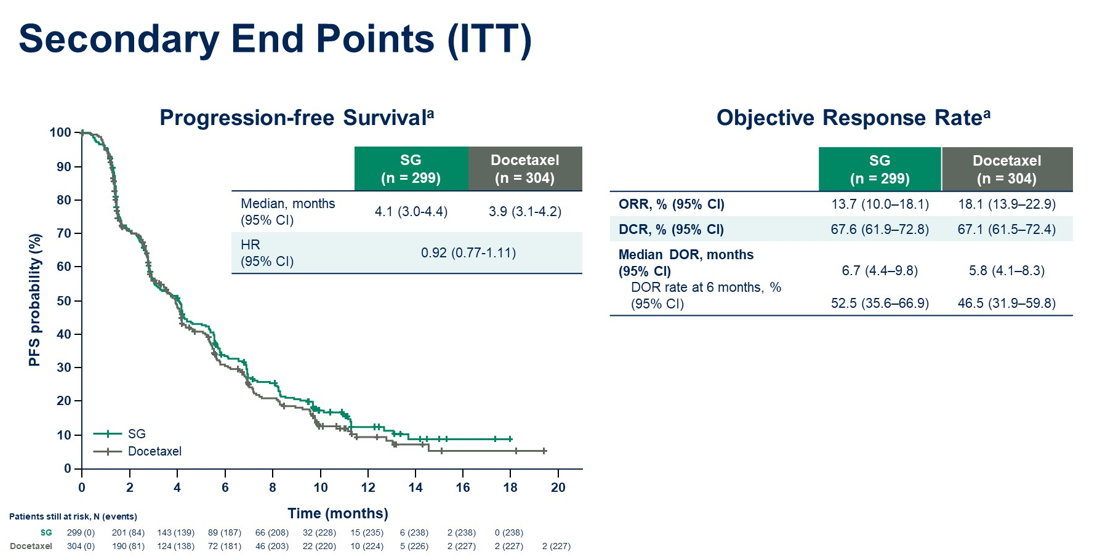
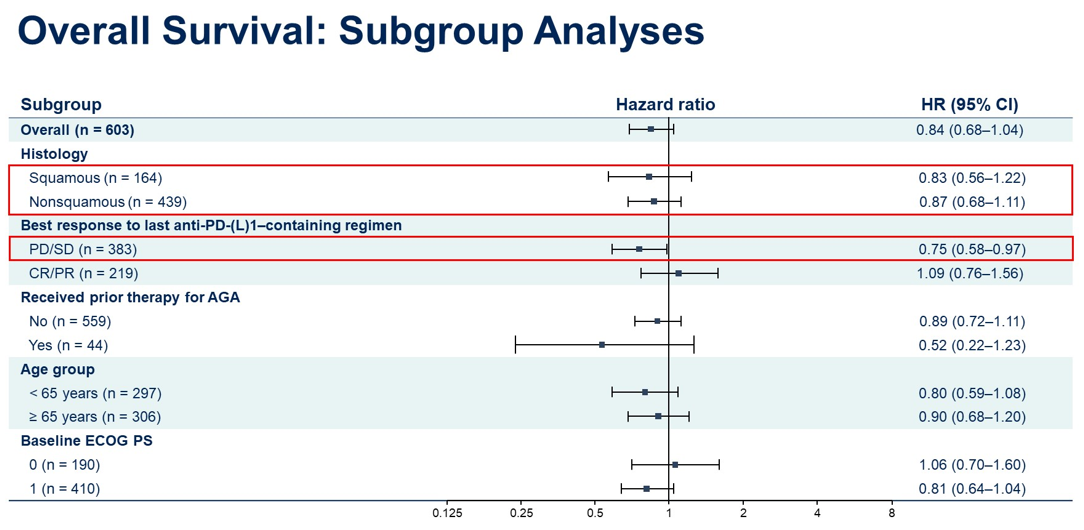
结论:相比于doc,尽管SG组OS未达到统计学差异,但在数值上有改善优势。 所有主要亚组(包括组织学)结果显示一致。在既往IO无应答的患者中观察到OS有临床意义的改善。此外,与doc相比,SG显示出更好的耐受性,其安全性表现与已知药物安全特性一致。
8501:ICARUS-LUNG01:一项针对既往接受过治疗的晚期NSCLC患者的datopotomab deruxtecan (Dato-DXd)2期研究,通过连续组织活检和生物标记物分析来预测治疗效果
背景:目前,在靶向治疗、免疫治疗和基于铂的化疗失败后,对晚期NSCLC患者的有限治疗效果的治疗选择非常有限。Dato-DXd是一种ADC,由一种针对TROP-2的单克隆抗体与一种拓扑异构酶I抑制剂通过可被肽酶裂解的连接子连接而成。在3期TROPION-Lung01研究中,Dato-DXd在既往接受过治疗的晚期NSCLC患者中,与多西他赛相比,显示出统计学上显著的无进展生存期(PFS)改善。在此,我们报告ICARUS-Lung01(NCT04940325)的研究结果,这是一项多中心、单臂、2期研究,评估Dato-DXd在既往接受过治疗的晚期NSCLC患者中的活性、安全性和应答/耐药生物标志物。
方法:接受1-3线治疗(包括针对可靶向基因组改变(AGA)特异性治疗,如有指征)后进展的晚期NSCLC(ECOG 0/1)患者每21天静脉注射Dato-DXd 6 mg/kg。所有患者均在基线、治疗期间(第3或6周)和治疗结束时接受新鲜肿瘤组织活检。主要终点:研究者评估的确认客观缓解率(ORR)。进行了一系列的转化分析,以确定与应答/耐药相关的生物标志物,包括TROP2肿瘤膜表达、TROP2动态和空间分布(通过AI数字病理学)、基因组学、转录组学、空间蛋白质组学(通过成像质谱细胞术)和CTCs。
结果:共有100名患者接受了≥1次治疗:中位年龄为60岁(26-83);62%为男性,89%为吸烟者,82%为非鳞癌(NSQ),23%为AGA,中位既往治疗线数为2(1-5)。在数据截止日(2024年4月18日),94%的患者停止了治疗。中位治疗持续时间为3.5个月(0.7;25.8),中位随访时间为21.5个月(95%CI,19.4-23.4)。非鳞癌患者似乎获益最大(ORR:30.5%;mPFS:4.8个月)。具有广泛TROP2表达的患者可能从Dato-DXd中受益。在这项研究中,TROP2 H-Score ≥ 100的患者似乎获得了最大的临床益处(H-score <100:n=13)。尽管存在小样本量的限制:基线时没有基因驱动变异似乎与对Dato-DXd的反应/耐药性有关。在Dato-DXd治疗1-2周期后,DNA修复的激活和免疫相关途径的抑制可能与治疗耐药性有关。进一步的生物标志物分析正在进行中:疾病进展时的基因组分析,TROP-2的空间分布(Al-数字病理),免疫调节和Dato-DXd的内化(IMC),以及循环肿瘤细胞(CTC)和循环肿瘤DNA(ctDNA)。
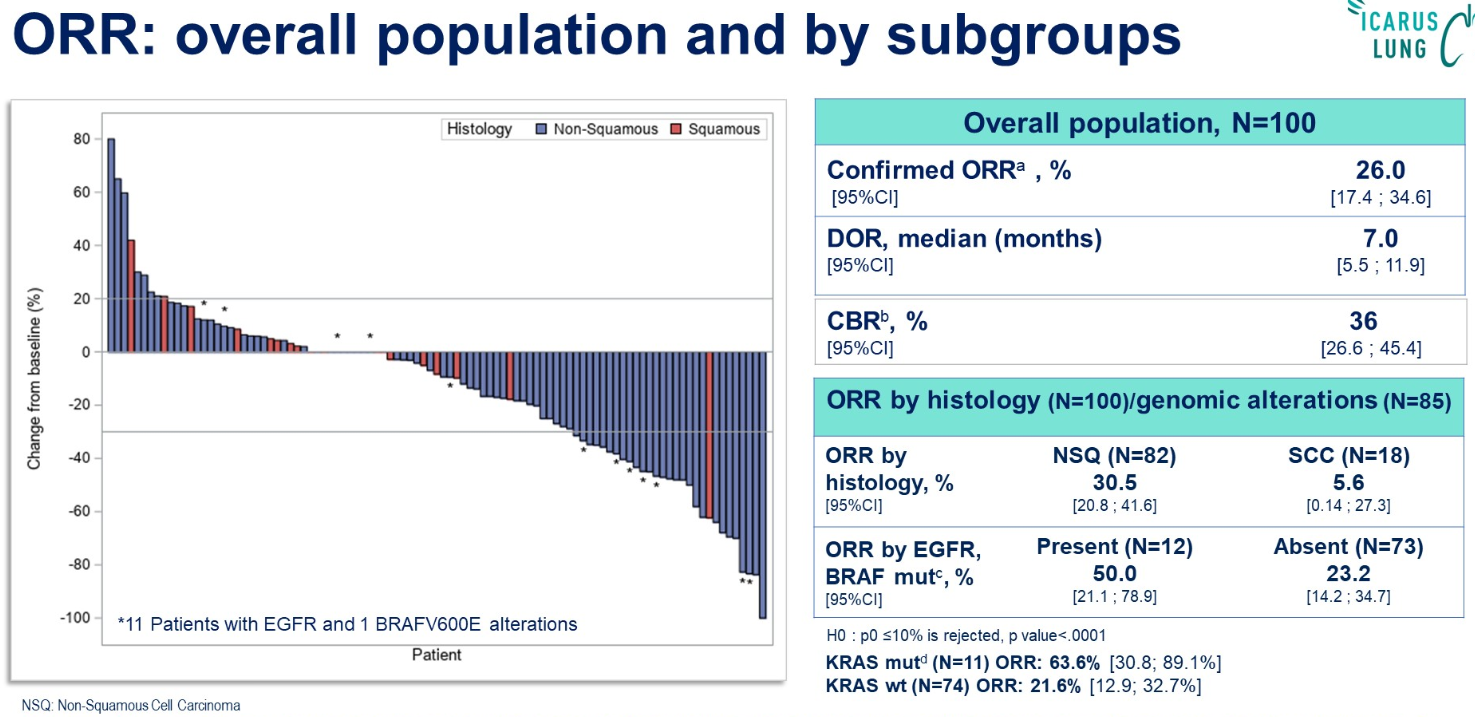
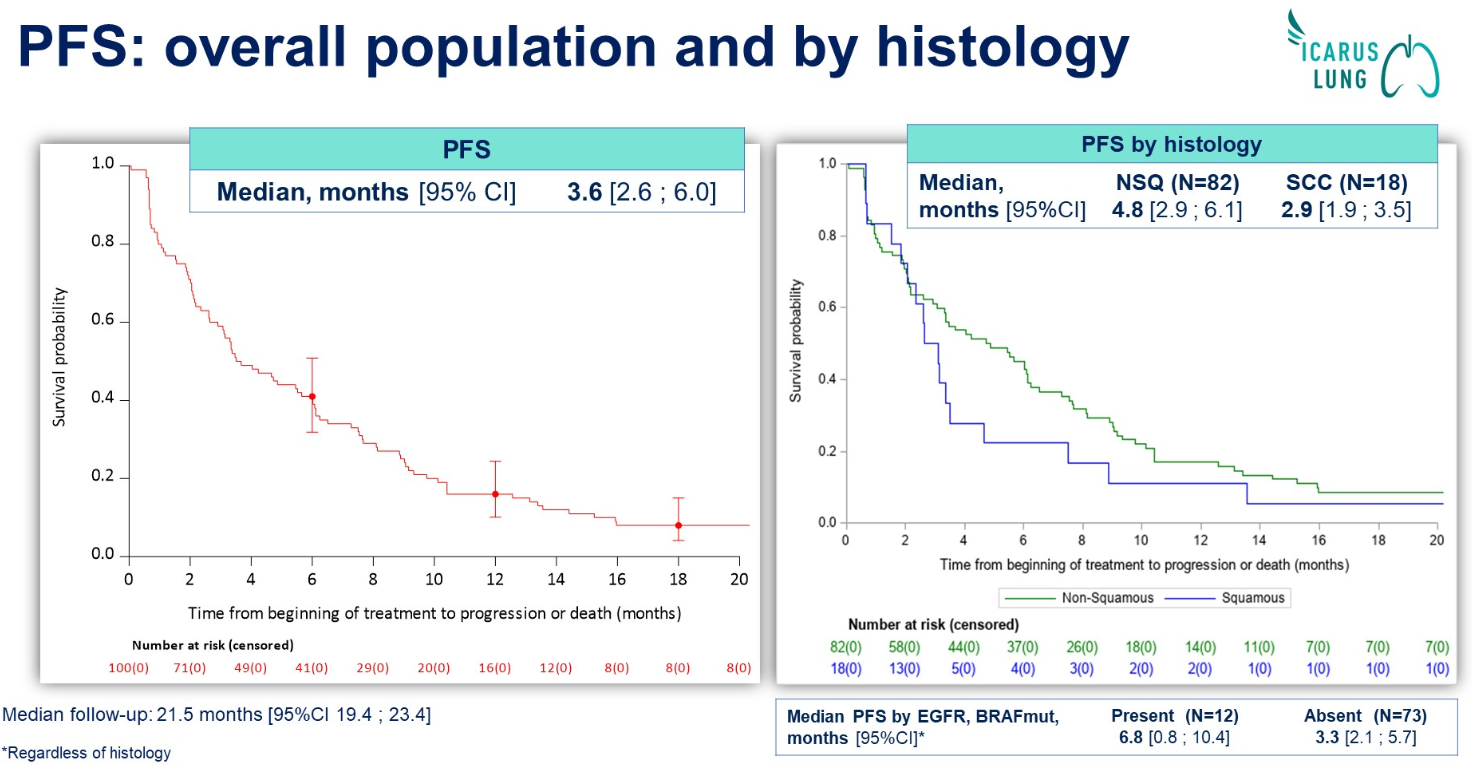
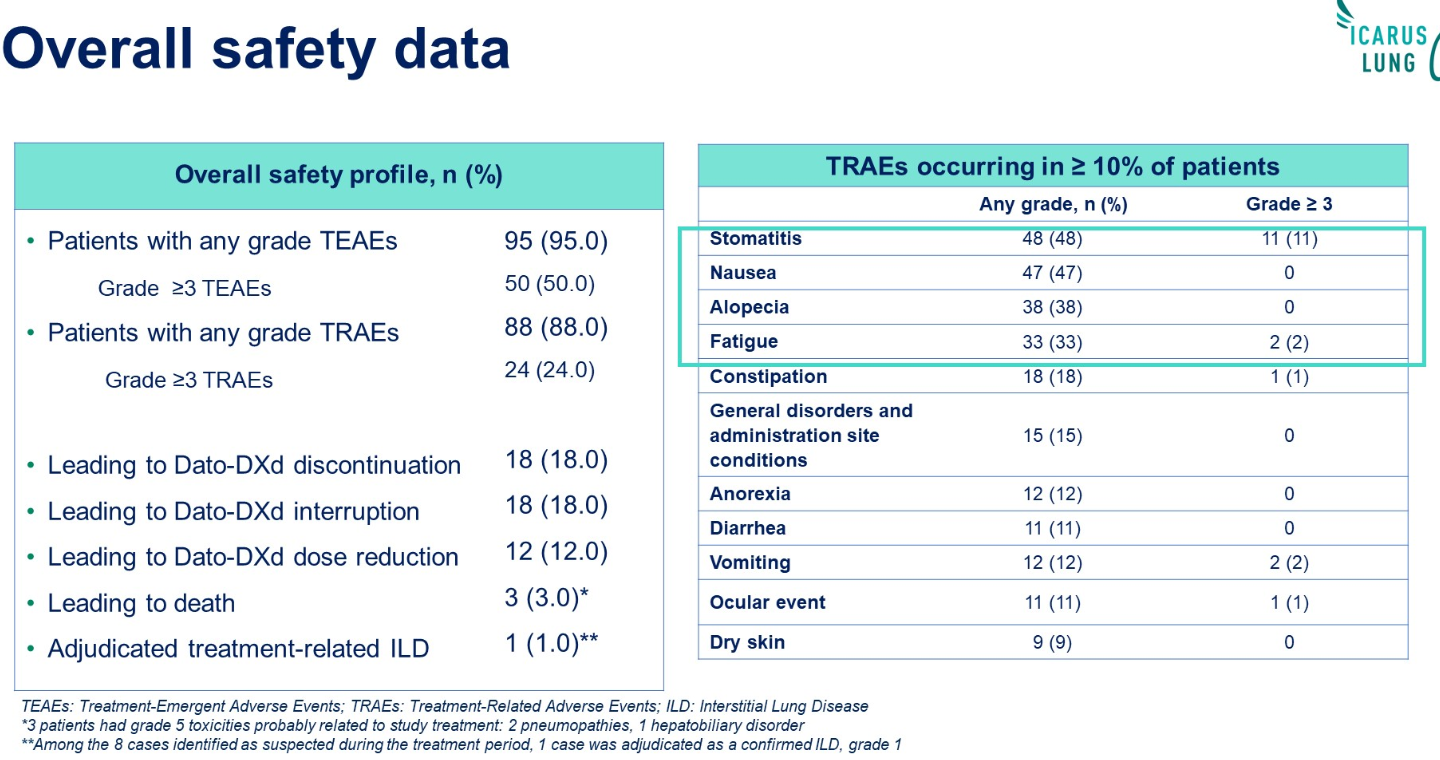
结论:在这一接受过大量既往治疗的人群中,Dato-DXd显示出与TROPION-Lung01中报告的相似的疗效和安全性。NSQ患者似乎获益最大。
8502:Sacituzumab tirumotecan (SKB264/MK-2870)联合KL-A167(PD-L1单抗)一线治疗晚期NSCLC II期OptiTROP-Lung01研究
背景:Sacituzumab Tirumotecan(SKB 264/MK-2870)是一种TROP2 ADC,其通过新型连接子将有效载荷(贝洛替康衍生的拓扑异构酶I抑制剂)进行偶联。 这种水解性连接子允许在细胞外pH敏感性切割和细胞内酶促切割,以释放可穿透细胞膜的有效载荷,实现“旁观者效应”。此次,报告了SKB264与KL-A167联合治疗晚期NSCLC患者的II期研究(OptiTROPLung01,NCT05351788)的初步结果。
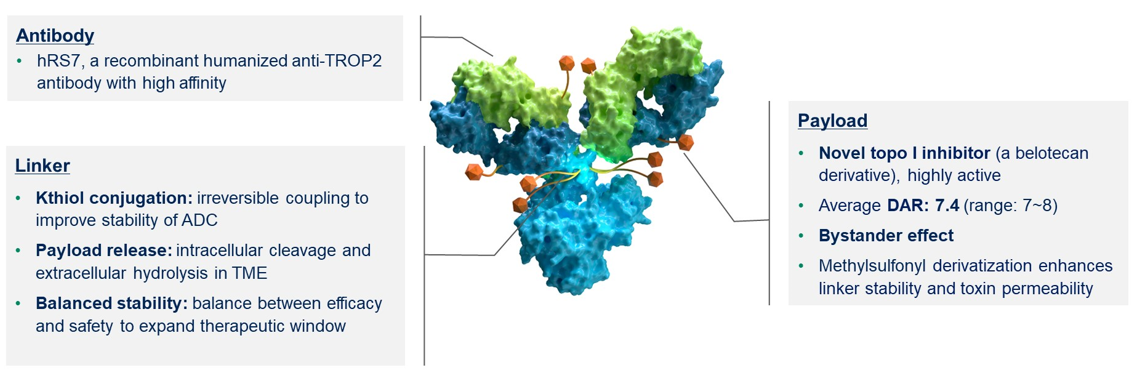
方法:未接受过治疗且无可操作基因组改变的晚期NSCLC患者入组,以非随机方式接受SKB 264 5mg/kg Q3W + KL-A167 1200mg Q3W(队列1A)或SKB 264 5mg/kg Q2W+KL-A167 900mg Q2W(队列1B),直至疾病进展或出现不可接受的毒性。每6周由研究者根据RECIST 1.1标准进行肿瘤评估。
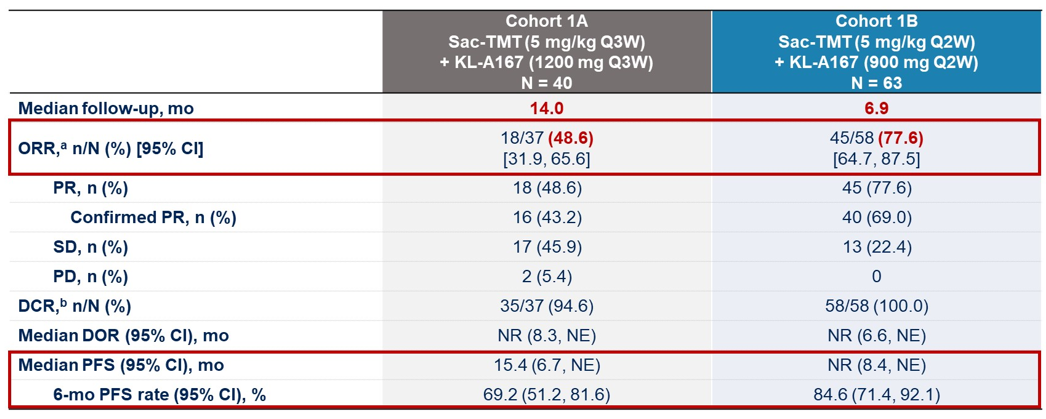
结果:截至2024年1月2日,队列1A和1B分别有40名和63名患者入组。两组的中位年龄分别为63岁和63岁;97.5%和85.7%的患者ECOG评分为1;PD-L1表达为1%、1%-49%和≥50%的比例分别为30.0%/33.3%、32.5%/30.2%和37.5%/36.5%。
在1A/1B队列中,最常见的3级及以上治疗相关不良事件(TRAEs)包括中性粒细胞降低(30.0%/30.2%)、白细胞降低(5.0%/17.5%)、贫血(5.0%/15.9%)、皮疹(5.0%/6.3%)和药物性皮疹(7.5%/0)。由于药物过敏,1B队列中有1名患者中断了SKB264治疗,无治疗相关死亡。
1A队列和1B队列的中位随访时间分别为14.0个月和6.9个月,1A队列的ORR为48.6%(18/37,2例待确认),DCR为94.6%,中位PFS为15.4个月(95% CI:6.7,未达到),6个月PFS率为69.2%;1B队列的ORR为77.6%(45/58,5例待确认),DCR为100%,中位PFS未达到,6个月PFS率为84.6%。额外的亚组分析如图。
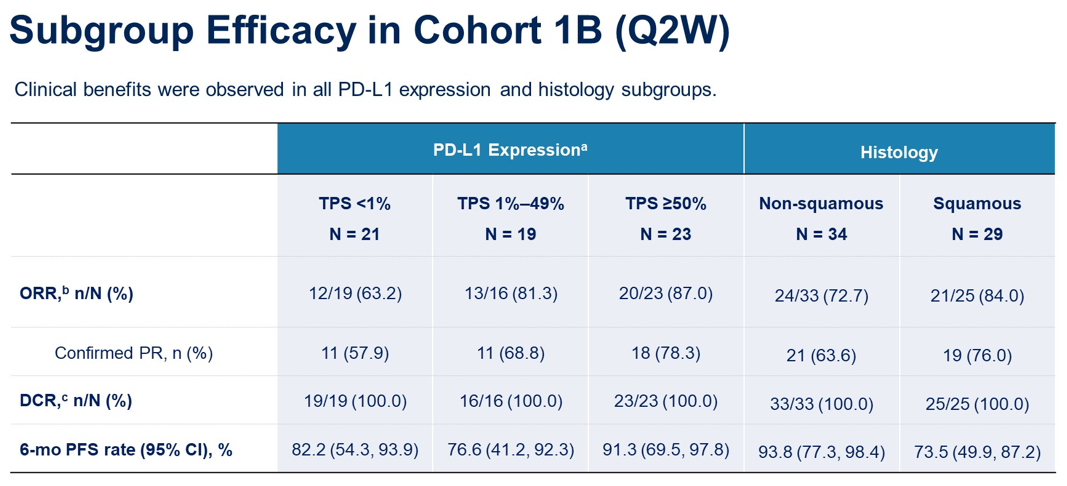
结论:SKB264联合KL-A167在初治晚期NSCLC中显示出有希望的疗效结果,安全性特征可控。建议对SKB264 Q2W进行进一步研究。一项SKB264 Q2W联合帕博利珠单抗与帕博利珠单抗治疗PD-L1 TPS≥50%的1L转移性NSCLC的III期研究(NCT06170788)正在进行中。
1. David Ross Camidge,et al.Telisotuzumab vedotin monotherapy in patients with previously treated c-Met–overexpressing non-squamous EGFR wildtype advanced NSCLC: Primary analysis of the LUMINOSITY trial.2024 ASCO abstr103.
2. Solange Peters,Efficacy and safety of sigvotatug vedotin, an investigational ADC, in NSCLC: Updated phase 1 results (SGNB6A-001).2024 ASCO abstr.8521.
3. Luis G. Paz-Ares, et al. Sacituzumab govitecan (SG) vs docetaxel (doc) in patients (pts) with metastatic non-small cell lung cancer (mNSCLC) previously treated with platinum (PT)-based chemotherapy (chemo) and PD(L)-1inhibitors (IO): Primary results from the phase 3 EVOKE-01 study. 2024 ASCO abstr.LBA8500.
4. David Planchard, et al.ICARUS-LUNG01: A phase 2 study of datopotomab deruxtecan (Dato-DXd) in patients with previously treated advanced non-small cell lung cancer (NSCLC), with sequential tissue biopsies and biomarkers analysis to predict treatment outcome.2024 ASCO abstr8501.
5. Wenfeng Fang, et al.Sacituzumab tirumotecan (SKB264/MK-2870) in combination with KLA167(anti-PD-L1) as first-line treatment for patients with advanced NSCLC from the phase II OptiTROP-Lung01 study. 2024 ASCO abstr.8502.
排版编辑:TY
本文专供医学专业人士参考,未经著作人许可,不可出版发行。同时,欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。
点击下方图片关注【2024 ASCO】专栏,及时查看最新国际大会资讯!












 苏公网安备32059002004080号
苏公网安备32059002004080号


