2017年ESMO大会今日落幕,今天的ESMO大会,重磅研究云集。其中,肺癌领域有多项重磅研究推出。在ESMO会议期间,中国肺癌专家相聚西班牙马德里,召开2017 ESMO肺癌专家座谈会,分享交流最新研究进展,并探讨这些研究结果对我国临床实践的影响。
开幕式上,上海交通大学附属胸科医院姜教授分享道,在ESMO第一场的主席研讨会上,肺癌领域两大重磅研究发布。场内场外,人山人海,多次响起雷鸣般的掌声。FLAURA和PACIFIC两大研究结果将改变肺癌临床实践。借此机会,在西班牙马德里,我们特意邀请了前来参会的中国肺癌专家,分享最新研究进展,并讨论这些研究结果对中国临床实践的影响。
EGFR突变阳性晚期NSCLC一线治疗策略和展望
讲者:中国医学科学院肿瘤医院 胡兴胜 教授
胡教授详细回顾了EGFR作为治疗靶点的研究历程。以2004年EGFR突变的发现为分水岭,开启了从未选择的人群到驱动基因指导下的靶向治疗新时代。IPASS研究首次证明EGFR基因突变比组织学类型更重要,对于EGFR突变的患者,一线EGFR-TKI相比于化疗,显著延长PFS,改善患者生活质量。2008年IPASS研究发布后,此后10年间,研究结果被不断验证。目前,已经有11项随机对照研究奠定了EGFR-TKI在EGFR敏感突变患者中的一线治疗地位。目前,已经有多个EGFR-TKIs可供选择。
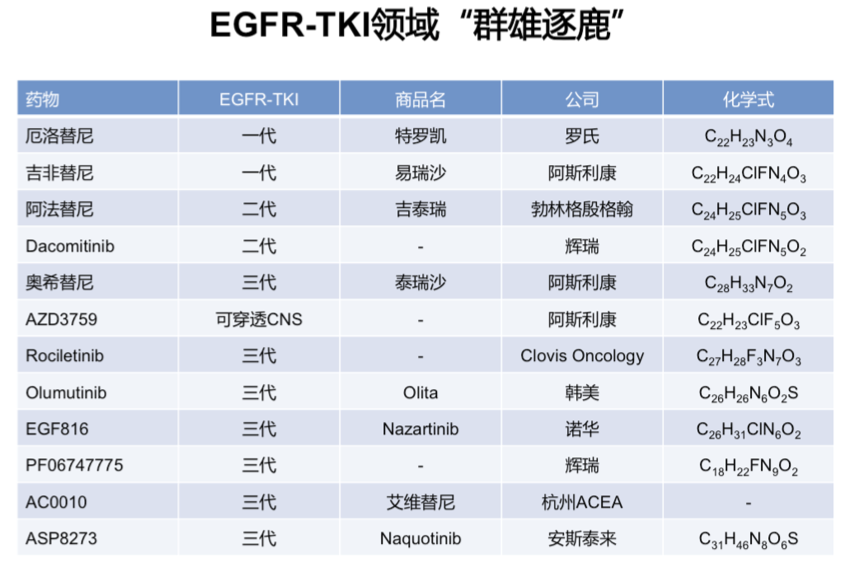
EGFR-TKI一线治疗的“纵横”优化--不同TKI之间的横向比较
目前,已经进行了多项一代EGFR-TKIs之间和不同代EGFR-TKIs之间的头对头比较:
1. WJTOG5108L研究:吉非替尼 vs. 厄洛替尼的头对头比较,主要研究终点为PFS,分别为6.5m vs. 7.5m;P>0.05;HR=1.125(0.940-1.347)。
2. Lux-LUNG7研究:吉非替尼 vs. 阿法替尼(一代与二代)的头对头比较,主要研究终点为PFS,分别为10.9m vs. 11.0m;P>0.017;HR=0.73(0.57-0.95)。安全性对比,常见的>=3级的AE,阿法替尼组分别为腹泻(13%)、皮疹或痤疮(9%)、乏力(6%);吉非替尼组为ALT/AST升高(9%)、皮疹或痤疮(3%)。
3. ARCHER1050研究:吉非替尼 vs. 达可替尼(一代与二代)的头对头比较,主要研究终点为PFS。研究入组了无CNS转移的患者。两组mPFS分别为14.7 vs. 9.2m。值得注意的是,达克替尼组的接受剂量调整的患者比例为66%;而吉非替尼组仅为8%。
2017 NCCN指南推荐了治疗价值的综合考量,需要从疗效、安全性、证据质量、证据一致性和药物经济性等多方面进行对比。一线治疗选择需要综合考虑疗效及安全性,二代TKI安全性上的劣势极大的限制其成为一线新标准。
EGFR-TKI一线治疗的“纵横”优化--不同优势人群之间的纵向比较
Lux-LUNG3和Lux-LUNG6研究的汇总分析,首次发现对于EGFR exon19del的患者,一线使用阿法替尼对比含铂双药化疗,可以显著延长OS。此外,阿法替尼对于罕见突变,如原发性T790M突变、exon20插入突变等有一定疗效,优于一代EGFR-TKI。因此,阿法替尼在EGFR罕见突变人群,有一定价值。
三代EGFR-TKI 对EGFR敏感突变及T790M耐药突变的肿瘤具有显著抑制作用,同时,能最大程度上减少对野生型EGFR的抑制,减少不良反应。目前已经获批用于一代或二代EGFR-TKI耐药后T790M突变的患者。此外,从ARUA3研究中,我们还看到了奥希替尼用于脑转移患者的卓越疗效。奥希替尼用于T790M突变的患者表现出高效、低毒、对脑转移有效的特征,是T790M突变NSCLC患者治疗的“新高度、新标杆”。
EGFR-TKI一线治疗的“纵横”优化--不同TKI的时空转化
三代EGFR-TKI进军一线治疗
FLAURA研究是一项评估奥希替尼对比EGFR TKI标准治疗在局部晚期或转移性EGFR阳性NSCLC中一线治疗安全性与疗效的III期、双盲、随机研究。主要研究终点是PFS。初步的研究结果在ESMO大会上公布,FLAURA研究达到主要终点,奥希替尼显著延长中位PFS至18.9个月,对比EGFR TKI标准治疗中位PFS 10.2个月,降低54%疾病进展或死亡风险,所有亚组均观察到一致获益。18.9个月的中位PFS刷新既往所有系统性治疗记录,KM曲线从很早就分开。预设的OS中期分析显示,奥希替尼对比SOC风险比(HR)0.63,p=0.0068(未低于统计学显著性阈值0.0015),奥希替尼组表现出初步的具有临床意义的OS获益,后续将进行最终OS分析进一步证实。安全性方面与既往研究相一致,奥希替尼较标准治疗表现出更好的耐受性,3度及以上的不良事件发生率更低。基于FLAURA研究结果,奥希替尼应该被推荐作为EGFR阳性晚期NSCLC患者的一线治疗。值得期待的是,中国多家研究中心参与了FLAURA研究中国人群患者入组,本次报道仅包括部分中国患者数据,所有中国人群数据将在2018年数据截止后报道。
EGFR-TKI向早期NSCLC的迈进影响术后辅助治疗策略:
1. ADJUANT研究:入组完全切除且病理分期为II-IIIA(N1-N2)期NSCLC的EGFR活化突变患者,1:1随机,一组接受吉非替尼,另一组接受证据级别最高的VP化疗,研究的主要终点为DFS。研究达到主要终点,吉非替尼组的DFS显著优于VP化疗组(28.7 vs. 18.0月;HR 0.60;P=0.005),吉非替尼组DFS延长了10.7个月。3年的DFS率比较,吉非替尼和化疗组分别为34%和27%。亚组分析显现,各亚型患者均能从吉非替尼的辅助治疗中获益。目前OS数据尚不成熟,对于N1/N2 EGFR突变型NSCLC切除术后,辅助吉非替尼治疗是一个更加值得推荐的方案。
2. ADAURA研究是一项III期双盲、随机、安慰剂对照研究,在携带中心试验室确认最常见敏感性EGFR突变(Ex19Del和L858R)伴或不伴其他EGFR突变(经中心检测确认)的IB- IIIA期非小细胞肺癌(NSCLC)患者中评估奥希替尼与安慰剂相比的疗效和安全性,这些患者已经接受肿瘤完全切除,伴或不伴术后辅助化疗。目前,该研究正在招募进行中。
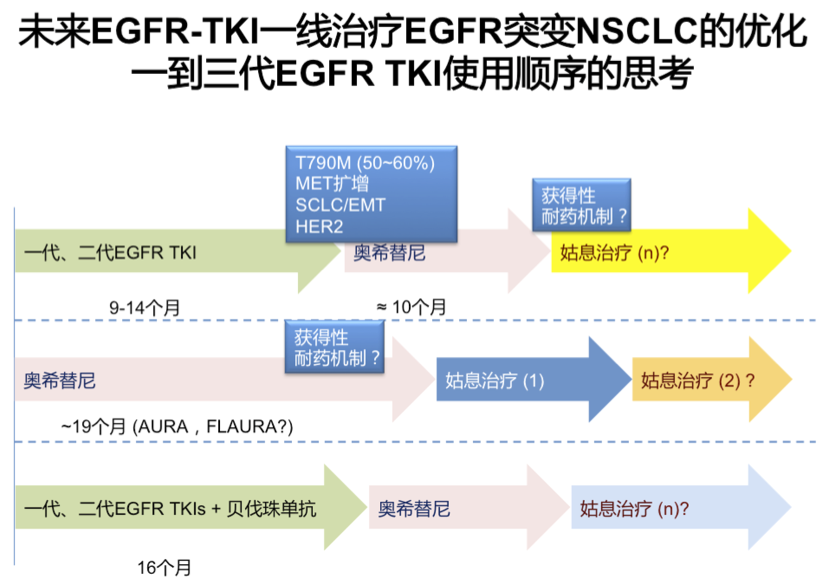
总结:目前,EGFR-TKI是晚期EGFR突变阳性NSCLC的标准治疗。TKI及其迭代产品的不断问世给EGFR突变阳性NSCLC治疗提供了更多选择,同时也给优化治疗策略提出了挑战:TKI治疗的“纵横”优化,即选择恰当的TKI,针对优势患者群,最终希望患者获益的最大化;TKI辅助治疗的探索已经获得初步成功,势必影响早期NSCLC治疗格局;三代TKI在晚期一线NSCLC治疗的III期数据在鼓舞人心的同时,也会伴随新的临床问题。对于EGFR突变阳性的NSCLC患者中,需要制定长期的治疗策略来应对肺癌慢病化的趋势。
III期不可切NSCLC的治疗及免疫治疗探索
讲者:河南省肿瘤医院 王慧娟 教授
王教授首先介绍了III期NSCLC的分类,这是一组异质性很强的疾病,第8版的III期NSCLC分为IIIA、IIIB和IIIC。III期NSCLC需要综合治疗,仅部分IIIA(N0-2)的患者可以进行完全性切除。总体而言,III期不可切除NSCLC 5年生存率不超过15%,远低于可手术切除NSCLC。
1999年,1999年,West Japan Lung Cancer Group的研究,比较同步或序贯方式放疗联合顺铂、长春地辛、丝裂霉素治疗III期不可切除NSCLC,首次证实同步放化疗用于III期不可切除NSCLC疗效,同步放化疗 vs. 序贯放化疗有OS的获益。2000年公布的RTOG 9410 研究是III期不可切除NSCLC同步化放疗的里程碑式研究,顺铂为基础的同步化放疗方案优于序贯治疗。3-5级的急性非血液系统毒性发生率同步多于序贯,随访11年,延迟毒性的发生率相似。
在此之后,进行了非常多提高疗效的尝试:
· 尝试一:提高放疗剂量(60GY or 更高),RTOG 0617研究显示,单纯放疗,提升剂量可提高生存;序贯放化疗,提升标准剂量无生存获益;同步放化疗,提升标准剂量降低总生存率。
· 尝试二:改变放射治疗方式,如CHARTWEL vs. 常规分割等,但结果显示两组没有差异。目前,正在探索Proton Chemo-RT和PET-based RT的研究。
· 尝试三:联合不同的化疗药物,如PROCLAIM研究,培美/顺铂 vs 依托泊苷/顺铂,但没有看到疗效差异。目前没有同步放化的标准化疗方案,循证证据最多的两种化疗方案分别是依托泊苷/顺铂和紫杉醇/卡铂。
· 尝试四:联合靶向药物(EGFR单抗及抗血管生成药物),联合EGFR单抗结果显示,联合西妥昔单抗,整体人群无获益,仅EGFR高表达的患者有获益。联合AE-941,PFS和OS均无获益。联合EGFR-TKI的研究显示,厄洛替尼联合同步放化疗毒性可控,OS可期待;主要终点TTP未达到。未选择人群,同步放化疗后吉非替尼维持治疗无获益。
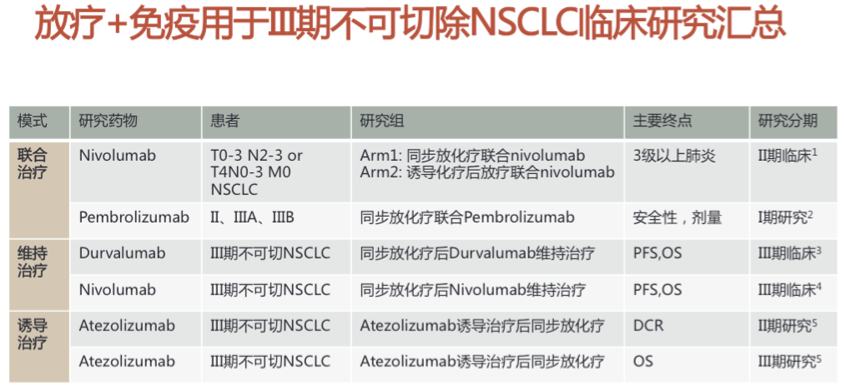
综上可知,自2000年确立了同步放化疗的地位后,对于III期不可手术切除的NSCLC,10余年来,我们没有取得任何进展。近年来,免疫检查点抑制剂带来了NSCLC治疗的变革。随着PD-1/PD-L1抑制剂单药治疗在晚期NSCLC二线和一线治疗相继取得突破性的进展,NSCLC的诊断和治疗策略正在逐渐发生着演变和优化。I-O治疗已成为晚期NSCLC治疗的重要手段之一。多个I-O联合治疗的研究正在进行中,为晚期NSCLC长期生存带来新希望。临床前研究提示放射与抗PD-L1治疗具有协同效应,回顾性研究提示前期放疗提高免疫治疗疗效。目前已经进行了多项放疗+免疫用于III期不可切除NSCLC临床研究,总结如下。
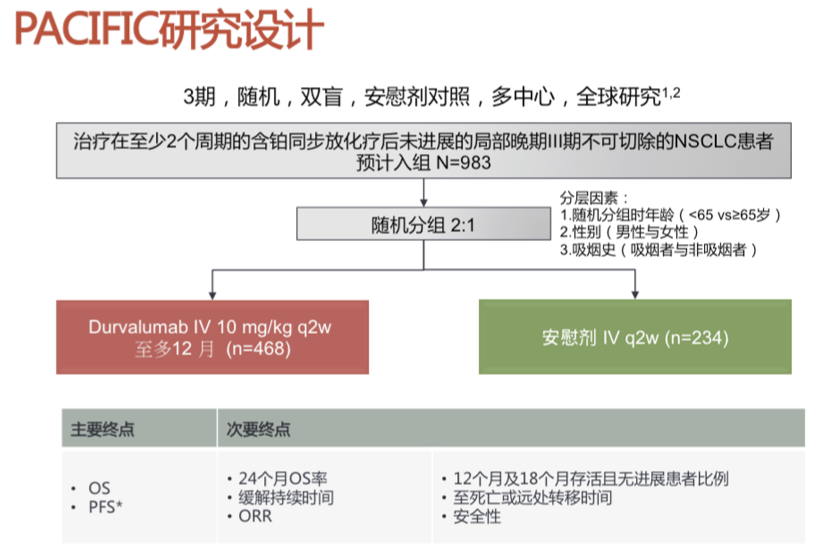
 PACIFIC 是一项随机、双盲、安慰剂对照的国际多中心临床研究,2:1随机,评估Durvalumab作为维持治疗用于接受了标准的含铂方案同步放化疗后,未发生疾病进展的无法手术切除的局晚期(III期)非小细胞肺癌者。PACIFIC研究的理论基础认为,放疗后可以增加PD-L1表达,动物模型显示,抗PD-L1与放疗的协同作用。因此,放疗后使用Durvalumab可以达到协同效应。该试验在 26 个国家/地区的 235 个中心进行,入组 702例确诊为局部晚期,不可切除的III期NSCLC患者。研究的主要终点为PFS和OS,次要终点包括 PFS 率与 OS率 、客观缓解率 (ORR) 及缓解持续时间等。PACIFIC研究设计如下。
PACIFIC 是一项随机、双盲、安慰剂对照的国际多中心临床研究,2:1随机,评估Durvalumab作为维持治疗用于接受了标准的含铂方案同步放化疗后,未发生疾病进展的无法手术切除的局晚期(III期)非小细胞肺癌者。PACIFIC研究的理论基础认为,放疗后可以增加PD-L1表达,动物模型显示,抗PD-L1与放疗的协同作用。因此,放疗后使用Durvalumab可以达到协同效应。该试验在 26 个国家/地区的 235 个中心进行,入组 702例确诊为局部晚期,不可切除的III期NSCLC患者。研究的主要终点为PFS和OS,次要终点包括 PFS 率与 OS率 、客观缓解率 (ORR) 及缓解持续时间等。PACIFIC研究设计如下。
入组人群的基线特征均衡,IIIB期患者,Durvalumab组和安慰剂组的患者比例分别为44.5%和45.1%;同步放化疗后疾病稳定的患者,两组分别为46.6%和48.1%。研究达到主要终点,与标准治疗相比,Durvalumab延长无疾病进展生存超过11个月(16.8个月 vs. 5.6个月;HR=0.52;95%CI:0.42-0.65),Durvalumab是第一个在III期NSCLC患者带来PFS显著获益的免疫检查点抑制剂。在预设的所有亚组(包括PD-L1表达状态)中,均观察到Durvalumab组PFS的获益。此外,使用Durvalumab的患者与服用安慰剂的患者相比,发生肿瘤转移的风险更低。Durvalumab组对比安慰剂组,显著提高ORR,两组分别为28.4% vs. 16.0% (RR=1.78; 95%CI:1.27-2.51)。中位疗效持续时间分别为未达到vs. 13.8个月(HR=0.43;95%CI:0.22-0.84)。安全性分析:接受Durvalumab治疗的患者与使用安慰剂的患者相比,最常见的治疗相关不良事件 (AE) 是咳嗽(35.4% vs. 25.2%)、肺炎/放射性肺炎(33.9% vs. 24.8%)、疲劳(23.8% vs.20.5%)、呼吸困难(22.3% vs. 23.9%)以及腹泻(18.3% vs.18.8%)。
研究结论:在预设的中期分析中,Durvalumab相比安慰剂显著改善患者的PFS,延长时间>11个月;在所有的亚组分析中,均观察到Durvalumab的获益。相比于安慰剂,接受Durvalumab治疗的患者,新病灶的发生率显著降低,包括脑转移灶。PACIFIC 试验将继续评估另一个首要研究终点总生存 (OS)。目前,PACIFIC试验的详细数据已同步在《新英格兰医学杂志》(NEJM)在线刊登。
在ESMO大会,PACIFIC研究发布现场,特邀来自比利时university hospital KU leuven的Johan Vansteenkiste教授大会现场点评:PACIFIC研究可以说是一场“海啸”,这场海啸带来的是“风险还是获益呢?(of risk or of benefit?)”毫无疑问,PACIFIC研究达到了PFS的研究终点,过去数十年,我们终于迎来了III期NSCLC第一个阳性的研究结果, Durvalumab组对比安慰剂组显著延长患者的PFS达11个月。但PACIFIC研究还有尚未回答的问题:
1. PFS vs. OS。
既往关于免疫检查点抑制剂的临床研究,除Keynote024研究外,多数研究均未观察到PFS的获益。此外,在III期肺癌中,因为放疗后续的一些并发症对疗效评估的影响,PFS并不能很好的反映患者OS的获益。
2. 在既往所有的飓风研究均为阴性结果的情况下,为什么PACIFIC研究可以取得阳性结果?
一方面,我们看到了免疫检查点抑制剂在IV期患者中取得地震式革新的同时,这些获益同样可以转化到III期的NSCLC患者。另一方面,放疗和免疫检查点抑制剂可能是非常好的联合伴侣:放疗可以通过诱导肿瘤微环境释放一系列的趋化因子,促进肿瘤新抗原的释放,上调PD-1和PD-L1的表达,此外,放疗还显示出远隔效应。
3. 如何在PACIFIC研究的基础上更进一步?
目前,在一些动物模型的研究中显示,免疫检查点抑制剂联合放疗,有协同效应,优于单纯放疗,且在放疗开始后尽早使用免疫检查点抑制剂效果更好。值得期待是,目前正在进行这方面的临床研究探索(ETOP 6-14 NICOLAS研究)。
总结,未来,我们对于III期NSCLC综合治疗的展望:
1. 如何进一步细分III期患者从而制定相应治疗策略
2. 探索不同临床亚型的最佳综合治疗策略:最优的化疗方案?最优的放疗计划?可切除患者的外科治疗策略?
3. 免疫治疗的加入出现曙光,仍需解决的问题:最佳生物标记物?最合理的联合治疗模式?最佳的治疗时间?靶向药物治疗的地位?
最后,希望我们迎来共同期待的免疫治疗新世界。
2017 ESMO 肺癌专家座谈会全体讨论
在专家座谈会的现场,邀请了全国各地前来ESMO与会的中国肺癌领域的临床工作者。一起分享解读FLAURA和PACIFIC研究,并探讨这些研究结果对我国临床实践的影响。主要集中讨论的问题如下:
1. 在现有公布的AURA亚组/FLAURA研究数据下,您觉得什么样的患者可能适合一线奥希替尼治疗?
FLAURA研究中,奥希替尼组的mPFS为18.9个月,这不能简单的理解为一线一代EGFR TKI,耐药后再行奥希替尼治疗(mPFS1+PFS2约为11.0m+10.4m)。一方面,一代或二代EGFR TKI耐药后,约50%的患者为T790M阳性,因此一半的患者不能接受奥希替尼治疗。此外,还有考虑到耐药患者,很多不能接受二次活检,因此也有可能错失接受奥希替尼治疗的机会。另外,我们还需要考虑药物的安全性和患者的耐受性,这方面奥希替尼更优于一代或二代TKI。因此,对于经济条件许可的患者,一线奥希替尼治疗是值得推荐的。
2. 如果奥希替尼用于EGFR突变阳性NSCLC患者的一线治疗,随之而来需要迫切解决的临床上诊断及治疗的问题有哪些?
我们需要明确奥希替尼耐药的机制,探寻患者耐药后的精准治疗。但值得期待的是,目前研究进展非常迅速,奥希替尼一线治疗的mPFS 18.9个月,这为 我们探索耐药机制提供了重要时机。
3. 在众多一代、二代和三代EGFR-TKI以及传统全身治疗之间进行排列组合时,您会综合考虑哪些因素来为患者制定全盘的治疗方案?
在中国,我们需要综合考虑药物的可及性,药物价格,患者的经济能力等来综合选择。目前,最值得关注的还是OS的问题,晚期患者,延长总生存是最重要的目标。
4. 如何看待PACIFIC研究的结果?
过去近20年,我们一直在进行局部晚期NSCLC的治疗探索,包括提高放疗剂量,改变放疗模式,联合靶向治疗等,但均以失败告终。PACIFIC研究是近20年来,我们在局部晚期NSCLC患者中,取得的第一个阳性结果,Durvalumab是第一个在III期NSCLC患者带来PFS显著获益的免疫检查点抑制剂。这一研究具有里程碑式的,说明免疫治疗不仅对晚期患者有效,局部晚期患者同样能从中获益。这一进一步验证了既往的科学理论,放疗联合免疫检查点抑制剂有协同效应。PACIFIC研究中,Durvalumab作为维持治疗,对比安慰剂可以显著延长11个月的PFS,这是非常鼓舞人心的结果。
5. 在NSCLC的免疫治疗中,我们是否找到了合适的人群或者说理想的bio-marker?
对免疫治疗预测生物标志物的探索,一直是研究的重点。目前,比较公认的预测标志物包括PD-L1的表达,肿瘤突变负荷(TMB)。在今年的ESMO会议上,也有很多关于NSCLC免疫预测标志物的研究发表,如采用外周血进行TMB的检测,能够很好的预测Atezoluzumab的疗效。但在PD-L1表达阴性或TMB低的人群中,也仍然有部分患者能从免疫治疗中获益。所以,我们还需要进行更多的探索。未来,免疫联合治疗值得期待,可以提高免疫检查点抑制剂单药的疗效,让更多人群从免疫治疗中获益。











 苏公网安备32059002004080号
苏公网安备32059002004080号


