近期,美国医学会杂志(JAMA)旗下的开放获取期刊JAMA Network Open正式发表了一项来自韩国的大规模回顾性队列研究。该研究由成均馆大学三星医学中心Dong Wook Shin教授与崇实大学Kyungdo Han教授团队共同完成。研究团队基于韩国国民健康保险服务(K-NHIS)数据库,纳入了超过7万名乳腺癌生存者与21万名匹配对照组人群,深入探讨了乳腺癌生存状态及相关治疗手段与阿尔茨海默病(AD)发病风险之间的关联。研究结果显示,乳腺癌生存者的阿尔茨海默病发生风险较无癌人群总体降低了8%,尤其是接受过放射治疗的患者显示出更低的风险关联。这一发现挑战了既往关于癌症治疗可能通过神经毒性增加痴呆风险的普遍担忧,为乳腺癌患者的长期神经认知健康管理提供了重要的循证医学依据。【肿瘤资讯】特此整理详细内容,以飨读者。

研究背景:癌症相关认知障碍与AD风险的争议
乳腺癌是全球女性最常见的恶性肿瘤,随着早期诊断和治疗技术的进步,其生存率已显著提高,早期患者生存率超过93%。然而,随着生存期的延长,癌症治疗带来的长期后遗症日益受到关注,其中“癌症相关认知障碍”(俗称“化疗脑”)是患者极为常见的困扰,表现为注意力不集中和记忆力下降。尽管如此,关于乳腺癌生存者罹患阿尔茨海默病的具体风险,既往流行病学证据尚存争议。部分早期研究提示癌症患者的AD发病率反而较低,而另一些研究则发现老年乳腺癌患者的风险增加。既往研究多受限于样本量小、未充分考虑死亡作为竞争风险,以及缺乏对吸烟、饮酒、肥胖等生活方式因素的校正。该研究旨在利用韩国全民医保大数据,通过严格的匹配和竞争风险模型,明确乳腺癌生存者与AD风险的真实关联,并进一步探索化疗、放疗及内分泌治疗对该风险的潜在影响。
研究设计与人群特征
该研究是一项基于人群的回顾性队列研究,数据来源于韩国国民健康保险服务(K-NHIS)数据库,该数据库覆盖了97%的韩国人口。研究筛选了2010年1月1日至2016年12月31日期间接受手术治疗的乳腺癌女性患者。为了确保研究结果的准确性,研究排除了既往有其他癌症史、年龄小于40岁、在癌症确诊前已诊断痴呆或数据缺失的患者。最终,共有70,701名乳腺癌生存者被纳入分析。研究采用1:3的比例,按年龄匹配了212,103名无癌症病史的女性作为对照组,最终纳入分析的对照组为180,360人(均在索引日前2年内接受过健康体检)。
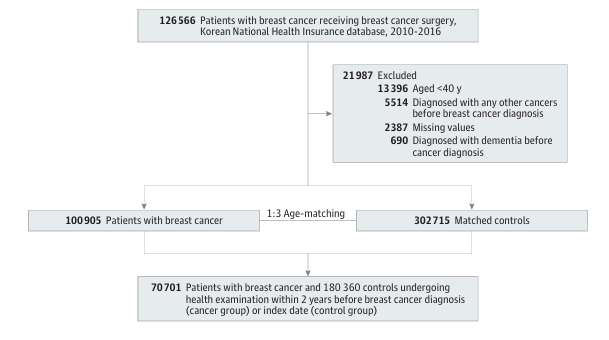
研究的主要终点是新发阿尔茨海默病的发病率,定义为随访期间记录有ICD-10编码(F00或G30)并处方了抗痴呆药物(如多奈哌齐、卡巴拉汀等)。为了准确评估风险,研究采用了Fine-Gray子分布风险模型(Competing Risk Regression Models)计算子分布风险比(SHR),将死亡视为竞争风险,并校正了年龄、收入、居住地、体重指数(BMI)、吸烟饮酒状态、运动习惯以及高血压、糖尿病等共病因素。
在基线特征方面,乳腺癌生存者的平均年龄为53.1岁。与对照组相比,乳腺癌组的合并症比例略高,包括糖尿病(6.7% vs 6.4%)、高血压(22.1% vs 21.7%)和血脂异常(18.1% vs 17.4%)。在治疗方面,71.7%的乳腺癌患者接受了放射治疗,56.8%接受了环磷酰胺,50.1%接受了蒽环类药物,47.0%接受了他莫昔芬治疗。中位随访时间为7.3年。
表1.患者基线特征
研究结果:总体风险降低,但受时间与年龄影响
研究结果显示,在随访期间,乳腺癌生存者中共确诊1,229例AD,发病率为2.45/1000人年;而对照组确诊3,430例,发病率为2.63/1000人年。在校正了多项混杂因素及竞争风险后,乳腺癌生存者的阿尔茨海默病发生风险较对照组显著降低8%(SHR,0.92; 95% CI, 0.86-0.98)。
表2. 按年龄分层的乳腺癌生存者与无癌对照组阿尔茨海默病风险的调整后子分布风险比 (SHR)
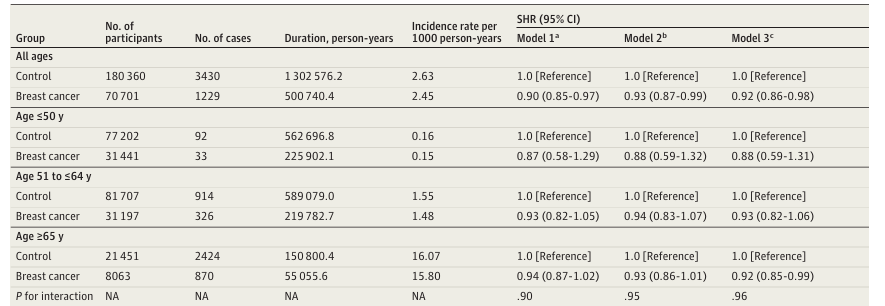
年龄分层分析揭示了这一保护效应在老年人群中更为显著。对于65岁及以上的乳腺癌生存者,AD风险显著降低(SHR, 0.92; 95% CI, 0.85-0.99)。然而,为了探究这种风险差异随时间的变化,研究进行了具有里程碑意义的Landmark分析。结果发现,这种较低的AD风险并未在长期生存中持续存在。具体而言,在诊断后的6个月内,乳腺癌患者的AD风险显著低于对照组(SHR, 0.92);但在随访满1年、3年及5年的Landmark分析中,两组间的AD风险差异不再具有统计学显著性(5年时SHR接近0.98,95% CI 0.89-1.08)。这表明,随着生存时间的延长,乳腺癌生存者的AD风险逐渐趋近于一般人群。
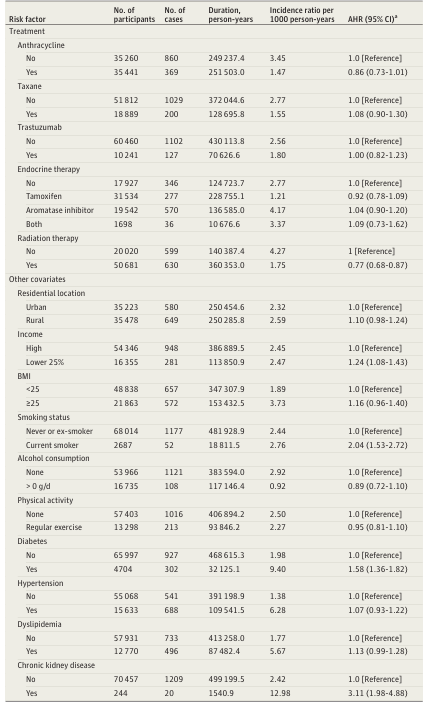
表3. 乳腺癌生存者中阿尔茨海默病发病的相关风险因素分析
治疗手段与AD风险的关联:放疗显示保护潜力
该研究的另一大亮点在于深入分析了不同抗癌治疗手段与AD风险的关系。多变量回归分析显示,接受放射治疗与乳腺癌生存者AD风险显著降低相关,校正后的风险比(AHR)为0.77(95% CI, 0.68-0.87)。这意味着接受放疗的患者AD发病风险降低了约23%。
在化疗药物方面,尽管使用蒽环类药物(如阿霉素)的患者显示出数值上的风险降低趋势(AHR, 0.86; 95% CI, 0.73-1.01),但差异未达到统计学显著性。同样,紫杉烷类药物(AHR, 1.08)、曲妥珠单抗(AHR, 1.00)以及内分泌治疗(包括他莫昔芬和芳香化酶抑制剂)均未显示与AD风险有显著统计学关联。
此外,研究还确认了传统AD风险因素在乳腺癌生存者中依然适用。低收入(AHR, 1.24)、当前吸烟(AHR, 2.04)、糖尿病(AHR, 1.58)和慢性肾脏病(AHR, 3.11)均显著增加了AD的发病风险。
讨论:机制探索与临床启示
该研究发现乳腺癌生存者AD风险略低,这一结果支持了既往部分流行病学研究及荟萃分析的结论,即癌症与AD之间可能存在一种“逆向关联”。研究者认为,这种关联不能仅用竞争死亡风险来解释,因为该研究已采用了Fine-Gray模型进行了严格校正。
关于放疗降低AD风险的发现颇具新意。虽然头颈癌放疗通常与痴呆风险增加相关,但在乳腺癌治疗中,脑部接受的非预期辐射剂量极低(估计约为0.2 Gy)。研究者推测,这种低剂量辐射可能通过抗炎机制、减少星形胶质细胞增生或小胶质细胞活化,发挥某种神经保护作用。当然,这也可能存在适应证偏倚,因为接受保乳术加放疗的患者往往分期更早、身体状况更好。
对于化疗,尽管“化疗脑”是公认的副作用,但该研究数据表明其并不直接导致阿尔茨海默病的病理改变。化疗引起的认知障碍与AD在机制上截然不同,前者通常是微妙的、非进行性的,且不会影响远期记忆提取。此外,有基础研究提示蒽环类药物在体外能抑制Tau蛋白聚集,这可能是其显示出潜在保护趋势的生物学基础。
Landmark分析的结果提示了“幸存者偏倚”的可能性。随着生存期延长至5年以上,风险趋于正常化,这与影像学研究观察到的化疗后脑灰质体积短期减少但长期可恢复的现象相吻合。
总结与展望
这项涉及7万余名患者的大型队列研究为乳腺癌生存者带来了一定程度的宽慰:尽管癌症治疗可能带来短期的认知困扰,但其并不会直接增加罹患阿尔茨海默病的长期风险,甚至在特定阶段表现出较低的风险。放射治疗与AD风险降低的独立关联值得未来进一步的病理生理学机制研究。
对于临床医生而言,这一发现强调了对乳腺癌生存者进行综合管理的必要性。虽然癌症治疗本身未增加AD风险,但吸烟、糖尿病等可改变的危险因素依然对AD发病起重要作用。因此,在关注肿瘤预后的同时,加强对患者生活方式的干预和共病管理,是降低远期神经退行性疾病风险的可行且有效的策略。未来仍需更长随访周期的研究,以全面评估随着生存期进一步延长(如10年、20年以上),这一人群的神经认知结局将如何演变。
Jeong SM, Jung W, Cho H, et al. Alzheimer Disease in Breast Cancer Survivors. JAMA Netw Open. 2025;8(6):e2516468. doi:10.1001/jamanetworkopen.2025.16468.
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


